
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
Parmi les dérivées monofonctionnelles du benzol le dérivé avec le groupe carboxylique— l'acide benzoïque occupe la place spéciale, elle est appliquée dans la médecine en forme du sel de sodium (le benzoate du sodium) comme l’expectorant.
L'acide benzoïque dans l'aspect libre se rencontre dans certains goudrons et les baumes, ainsi qu'à la canneberge, l'airelle rouge, mais se trouve plus souvent dans l'aspect lié, par exemple, en forme de N-dérivé benzoïque de l’acide aminoacétique C6H5CONHCH2COOH, appelé comme l'acide hippurique. L’acide hippurique se forme dans le foie à la coopération de l’acide benzoïque et l’acide aminoacétique, elle sort avec l'urine. Dans la pratique clinique par la quantité de l’acide hippurique dans l'urine des malades (après l'accueil du benzoate du sodium) on juge sur l’effectivité de la fonction neutralisant du foie.
Comme la liaison hétérofonctionnelle, p-aminophénol forme les dérivées selon chaque groupe fonctionnel en particulier et simultanément selon deux groupes fonctionnels. p-aminophénol est toxique. Ce sont ses derives – paracétamol, phécacétine qui exercent l'action analgésique (insensibilisant) et febrifuge provoquent plus grand intérêt pour la médicine.


p-aminobenzoïque acide (PABK) et ses dérivées.
Les ethers des aminoacides aromatiques possèdent la propriété totale — la capacité dans n'importe quel degré provoquer l'anesthésie locale, c.a.d la perte de la sensibilité. Cette propriété est particulièrement exprimé près des para-dérivées. Dans la médecine on utilise anesthésie (l'éther d’éthyle PABK) et la novocaïne (-diéthylaminoéthyle éther PABK). On applique la novocaïne en formed du sel (hydrochlorure) ce qu'est lié à la nécessité de l'augmentation de sa solubilité dans l'eau.

p-aminobensoïque acide c’est le facteur de la croissance des microorganismes et participe à la synthèse de l'acide folique (la vitamine B), au manque de laquelle les microorganismes périssent.
Il est facile de recevoire de l’acide sulfanilique (p-aminobenzolsulfoacide) pendant la sulfonation de l'aniline, elle existe dans l'aspect de l'ion dipolaire. L'amide de l’acide sulfanilique (sulfanilamide), connu sous le nom du streptocide, c’est le fondateur du groupe des moyens médicinaux qui possèdent l'activité antibactérienne et s’appellent sulfanilamides (les sulfamides). Leur action antibactérienne est fondée sur ce qu'ils sont antymétabolites par rapport à p-aminobenzoïque l'acide participant à la biosynthèse de l'acide folique dans les microorganismes. L'amide de l’acide sulfanilique a la ressemblance structurale avec p-aminobenzoïque acide et il peut empêcher la biosynthèse de l'acide folique que conduit à la destruction des bactéries. La sélectivité de l'action bactérienne des sulfanilamides est basée sur ce que l'acide folique dans l'organisme humain n'est pas synthétisée. Ainsi, les sulfanilamides bloquent les réactions métaboliques essentielles pour les bactéries définies (les pneumocoques, les streptocoques etc.) et en même temps ils n'influencent pas l'organisme de la personne.
L'acide salicylique se rapporte au groupe des acides hydroxybenzoïques. Comme o-hydroxybenzoïque acide elle décarboxyle facilement pendant la chauffe avec la formation du phénol.
L'acide salicylique est soluble dans l'eau, elle donne la couleur intensive avec le chlorure du fer (III) (le découvre qualitative du groupe hydroxyle du phénol). Elle donne l'action anti-spasmodique, fébrifuge et mycose, mais comme un acide fort (рКа 2,98) provoque l’irritation de l'appareil digestif et c'est pourquoi on applique cela seulement à usage externe. On appliqué à l'intérieur ses dérivé – les sels ou les éthers. L'acide salicylique est capable de former les dérivées selon n'importe quel groupe fonctionnel. Ce sont des salicylate du sodium des ésthers selon le groupe COOH (méthylsalicylate, phéhylsalicylate (salol)) et le groupe OH – l’acide acétylsalicylique (aspirine) ont la signification pratique. Les dérivées énumérées (excepté le salol) produisent l'action analgésique, fébrifuge et antiphlogistique. Méthylsalicylate à cause de l'action irritant est utilisé à usage externe dans les composés des onguents. Le salol est appliqué comme le désinfectant aux maladies intestinales et il est remarquable par ce que dans un milieu aigre de l'estomac il n’est pas hydrolysé mais il se désagrège seulement dans l'intestin, c'est pourquoi il est utilisé aussi comme le matériel pour les enveloppes protectrices de certains préparations médicinals qui ne sont pas stables dans un milieu aigre de l'estomac.
L'acide salicylique était reçu pour la première fois par la voie de l'oxydation de l'aldéhyde salicylique se trouvant dans la plante de la spirée (la génération Spireae). D'ici vient son nom initial —l'acide spiré avec lequel est lié le nom de l'aspirine (la lettre initiale «а» désigne l'acétyle). L'acide acétylsalicylique dans la nature n'est pas trouvé.
Des autres dérivées de l'acide salicylique c’est p-aminosalicylique acide (PASK) qui a une grande signification. Elle applique comme le moyen antituberculeux. PASK c’est l'antagoniste de p-aminobenzoïque acide qui est nécessaire pour l'activité vitale normale des microorganismes. Des autres isomères ne possèdent pas une telle action. m-aminosalicylique acide c’est la substance très toxique.
Les tâches standartes et leur résolution
La tâche ХVI. En qualité des moyens antiphlogistiques on utilise l'acide acétylsalicylique et salicylamide. À la participation desquels groupes de l’acide salicylique se forment ces dérivées ?
La résolution. L'acide salicylique c’est la liaison hétérofonctionnelle contenant les groupes carboxylique et hydroxyle. L'acide acétylsalicylique (aspirine) c’est l'ésther formé par l'acide acétique et par l’hydroxygroupe du phénol de l'acide salicylique. On peut synthétiser l'aspirine à la coopération de l'acide salicylique et l'anhydride de l’acide acétique en présence du catalyseur acide (par exemple, H2SO4).
Salicylamide
(l'amide de l'acide salicylique) on peut le recevoir par voie de la
coopération du groupe carboxylique de l'acide salicylique avec
l'ammoniaque. D'abord se forme le sel d’ammonium de l'acide
salicylique. C'est lié à la facilité de la formation de l'ion
d’ammonium NH4![]() .
Le transfert du proton de l'acide vers l'ammoniaque (vers une base
forte ) se réalise plus vite, que l’attaque nucléophile de
l'atome du carbone du groupe carboxylique par la molécule de
l'ammoniaque (nucléophile). À la chauffe du sel d’ammonium se
détache la molécule de l'eau et se forme l'amide de l'acide
salicylique.
.
Le transfert du proton de l'acide vers l'ammoniaque (vers une base
forte ) se réalise plus vite, que l’attaque nucléophile de
l'atome du carbone du groupe carboxylique par la molécule de
l'ammoniaque (nucléophile). À la chauffe du sel d’ammonium se
détache la molécule de l'eau et se forme l'amide de l'acide
salicylique.

L'acide salicylique le sel d’ammonuim de l'acide salicylique salicylamide
Les tâches pour la résolution indépendante :
3.1. L'acide acétondicarbonique entre dans la composition des corps cétoniques : HОOC–CH2–СО–CH2–COOH. Si le groupe carbonique est conjugué avec le groupe carboxylique ? Écrivez l'équation de la réaction de cet acide avec l'hydroxylamine et l’éthanol (en présence de l'acide).
3.2. Lequel des liaisons : 2-hydroxy-5-méthylhexal ou 5-hydroxy-2-méthylhexal coexistent dans un milieu aigre avec la forme cyclique ? Écrivez le schéma de la réaction.
3.3. Les dérivés de 2-pirrolidone – de lactame GAMK (-aminobutyrique acide)Une importante signification pour la médecine ont. Amenez le schéma de la formation cette liaison cyclique.
3.4. Quelle quantité de substances (mol) d’éthanol il est nécessaire d'introduire dans la réaction pour recevoir l'éther d’éthyle complet de l'acide citrique ? Amenez l'équation correspondante de la réaction.
3.5. L'éther benzylique de l'acide benzoïque (benzylbenzoate) С6Н5СООСН2С6Н5—le moyen antygaleux. Quels produits se forment à la suite de la réaction de l'hydrolyse de cet ésther dans le milieu alcalin? Écrivez l'équation de la réaction.
LE SUJET 4. LES LIAISONS HÉTÉROCYCLIQUES BIOLOGIQUEMENT IMPORTANTES
Les hétérocycliques (hétérocycles) sont des liaisons insérant dans le cycle un ou quelques atomes différant du carbone (hétéroatomes). Les systèmes hétérocycliques sont à la base de la structure des liaisons de diverses classes des substances biologiquement actives, tels que ADN, ARN, plusieurs préparations médicinales, ainsi que les alcaloïdes. Les derniers se présentent comme les hétérocycles de l'origine végétale contenant l’azote. Ils possèdent l'action physiologique bien exprimé. À ceux-ci se rapporte les moyens narcotiques différents, la nicotine, la caféine, la morphine, l'atropine etc.
Les hétérocycles aromatiques contenat l’azote sont des systèmes associés contenant l'atome (atomes) d’azote et satisfaisant au critère aromaticités ont la plus grande signification pour l'organisme. On peut subdiviser les hétérocycles aromatique en deux groupes.
1.
- systèmes abondants sont les molécules avec la densité
électronique augmentée à l'intérieur du cycle. Cela se passe
quand une paire des p-électrons de l'atome de l'azote entre dans le
couplage avec les -électrons
des atomes du carbone (р,
-
conjugaison). Dans ce cas l'hétéroatome c’est électronodonneur,
et l'augmentation de la densité électronique à l'intérieur du
cycle facilite le cours des réactions selon le mécanisme S![]() (à la-position
vers l'hétéroatome); les liaisons s'acidifient facilement. Comme
l'exemple du
- système hétérocyclique abundant on peut citer le pyrrole :
(à la-position
vers l'hétéroatome); les liaisons s'acidifient facilement. Comme
l'exemple du
- système hétérocyclique abundant on peut citer le pyrrole :



Пир
pyrrole indole (benzopyrrole) pyridine
L'atome de l'azote électronodonneur appelé pyrrole c’est le centre NH-acide. Les propriétés acides sont exprimées très faiblement; par exemple, la pyrrole coopère avec les métaux alcalins et leurs amides. La pyrrole se réduit avec de la peine dans les conditions sévères en formant l'hétérocycle «pyrrolidine» possédant les propriétés basiques fortes. Le noyau de la pyrrole fait partie dans la composition du porphyne, du porphyrine (les liaisons tétrapyrroles), d’aminoacide naturel «triptophane» à la composition de l'indole (benzopyrrole).
2.
-systèmes
déficitaires sont les hétérocycles avec la densité électronique
baissée à l'intérieur du cycle. Dans ce cas au couplage avec
-électrons
des atomes du carbone participe seulement un -électron
de l'atome de l'azote et l'état électronodéficitaire est
conditionné par l'électrocaractère négatif plus grand de l'atome
de l'azote par comparaison avec l'atome du carbone. Dans ce cas
l'hétéroatome c’est l'accepteur du proton grâce au paire des
électrons ne participant pas au couplage et il manifeste les
propriétés principales (l'atome de l'azote pyrridique). L'état
électronodéficitaire du système aromatique amène à la difficulté
de la réaction S![]() (dans-position
vers l'hétéroatome). Comme exemple le plus simple de ce système
hétérocyclique c’est la pyridine.
(dans-position
vers l'hétéroatome). Comme exemple le plus simple de ce système
hétérocyclique c’est la pyridine.
Les liaisons contenant le cycle pyrridique s'acidifient avec peine mais se rétablissent plus facilement (s’hydrogènent). Par exemple, au chinoline (à la benzopyridine), c’est le noyeu benzénique qui subit facilement à l'oxydation et
c’est le noyeu pyrridique qui subit facilement à la réduction.


chinoline 2,3-pyridincarbonique acide chinoline tétrahydrochinoline
Cependant les homologues de la pyridine s'acidifient facilement même dans les conditions molles. Ainsi, à l'oxydation de -pikoline (2-méthylpyridine) se forme l'acide nicotinique (la vitamine РР) :

Picoline l'acide nicotinique
L a
liaison dans la molécule de deux atomes pyridiques de l'azote amène
à l’augmentation du déficit des électrons à l'intérieur du
cycle et encore plus grand par comparaison avec le pyridine à la
baisse de l'activité (inertie) des liaisons dans les réactions S
a
liaison dans la molécule de deux atomes pyridiques de l'azote amène
à l’augmentation du déficit des électrons à l'intérieur du
cycle et encore plus grand par comparaison avec le pyridine à la
baisse de l'activité (inertie) des liaisons dans les réactions S![]() ainsi que à leur réduction de la basicité par comparaison avec la
pyridine. Ainsi, hétérocycle de six membres avec deux atomes
pyridiques de l'azote —pyrimidine— à la réaction avec l'acide
sulfurique forme les sels seulement selon un atome de l’azote.
ainsi que à leur réduction de la basicité par comparaison avec la
pyridine. Ainsi, hétérocycle de six membres avec deux atomes
pyridiques de l'azote —pyrimidine— à la réaction avec l'acide
sulfurique forme les sels seulement selon un atome de l’azote.
pyrimidine l'hydrosulfate du pyrimidine
Pour plusieurs hétérocycles avec deux atomes de l'azote et pour les autres liaisons hétérofonctionnelles est caractéristique le phénomène tautomérie.
Tautomérie
c’est une isomérie d'équilibre dynamique accompagnée par la
migration (transfert) du groupe mobile entre deux ou plusieurs
centres réactionnaires dans la molécule. Si se réalise le
transfert du proton Н![]() ,
la tautomérie s'appelleprototropique.
,
la tautomérie s'appelleprototropique.
Ainsi, à la base du phénomène de la tautomérie se trouve la coopération acide-basique. La variété de la tautomérie prototropique
–
lactime-lactamique
(le transfert de Н![]() entre les atomes de l'azote et de l'oxygène);
entre les atomes de l'azote et de l'oxygène);
– énamine-iminique (le transfert du proton entre les atomes de l'azote et du carbone);
– céto-énolique
(le transfert de Н![]() entre les atomes de l'oxygène et du carbone).
entre les atomes de l'oxygène et du carbone).
Il est confortable d'examiner les premiers deux aspects de la tautomérie sur l'exemple des dérivés du pyrimidine (des liaisons faisant partie des acides nucléiques), par exemple sur l'exemple de la cytosine (les flèches directes indiquent la direction du déplacement de l'équilibre tautomérique et les flèches replié indiquent la direction de la migration du proton) :

La tautomérie céto-énolique de l’acide pyruvique se décrit par l’équilibre :

Dans la plupart des cas le tautomère cétonique se trouve beaucoup plus stable. On peut confirmer la présence du tautomère énolique par la formation (à la coopération avec l'acide phosphorique) du phosphoénolpyruvate c’est le plus important métabolite en prosessus de la glycolyse :

Les dérivées du pyrimidine font partie d'une série d'alcaloïdes et des soulfanilamides.
La présence des hydroxygroupes donne aux dérivés correspondant du pyrimidine des propriétés acides. Particulièrement c’est 2,4,6-trihydroxypyrimidine — l'acide barbiturique — plus fort que l’acide acétique qui manifeste les propriétés acides fortes.
L'acide barbiturique peut être reçu à la coopération de l’éther malonique avec l'urée dans la présence de l’étoxyde du sodium.

Сe sont 5,5- dérivées disubstitués de l'acide barbiturique appelés les barbitrates jouent un grand rôle comme les moyens somnifères et antispasmodiques. On les reçoit analogiquement à l'acide barbiturique, en utilisant les éthers disubstitués de l'acide malonique. Pour les barbitrates il est possible seleument la tautomérie lactime-lactamique. Ils forment facilement les sels solubles dans l’eau avec un équivalent de l'alcalin.
Comme exemple des barbitrates servent 5,5-diéthylbarbiturique acide, le barbital (véronal) R = R¢ = C2H5, son sel de sodium, le barbital-sodium, 5-éthyl-5phénylbarbiturique acide, le phénobarbital (luminal) R=C2H5, R¢ = C6H5.
Des hétérocycles bicycliques dans la nature plus répandus sont des liaisons des séries purique ptéridinique.
Le purine c’est une liaison l'hétérocyclique bicyclique formé par les noyaux condensés du pyrimidine et de l’imidazol

Le système purique est aromatique. Elle insère 8 p-électrons des liens doubles et la paire non partagée des électrons de l'atome de l'azote dans la position 9 ce que correspond à la règle de Chukel (4n + 2, où n = 2). Le purine est stable à l'action des oxydants, il est bien dilué dans l'eau, amphotère, forme les sels non seulement avec les acides forts, mais (grâce à la présence du NH-groupe) avec les métaux alcalins.
6-Hydroxypurine (l'hypoxanthine), 2,6-dihydroxypurine (la xanthine) et 2,6,8-trihydroxypurine (l'acide urique) se forment dans l'organisme à metabo-lisme des acides nucléiques.
L'acide urique c’est le produit final du métabolisme des liaisons puriques dans l'organisme. Il se dégage avec l'urine au nombre de 0,5 … 1 g par jour. L'acide urique est dibasique, il est mauvaisement dilué dans l'eau, mais il est facilement dilué dans les alcalins en formant les sels (urates) avec un ou deux equivalents de l’alcalin. À certaines violations dans l'organisme les urates sont remis dans les articulations (la podagre), ainsi qu'en forme des calculs rénaux. À la suite de la chauffe de l’acide urique avec l'acide nitrique et ensuite avec l’addition de l'ammoniaque au mélange refroidi réactionnaire apparaît la couleur violet intensive. Cette couleur est utilisé pour la découverte qualitative des liaisons contenat le noyau purique (la reaction muréxydique).
Selon la conduite chimique la xanthine et l'hypoxanthine sont analogues à l'acide urique. Ils sont amphotéres et ils forment les sels avec les acides et les alcalins. Les dérivées N-méthylsubstituts de la xanthine se rapportent aux alcaloïdes.
Les aminopurines. Les plus importants sont 6-aminopurine, ou l'adénine et 1-amino-6-hydroxypurine, ou la guanine. Ils sont des composants obligatoires des acides nucléiques. L'adénine fait partie de certains coenzymes.
À l'action de l'acide azoteux sur l'adénine et la guanine se passe leur désamination avec la formation de l'hypoxanthine et la xanthine en conséquence


Le
système ptéridique est aromatique, il est stable à l'action des
oxydants, il manifeste les propriétés basiques. Dans la nature ce
sont hydroxy- et aminoptéridine qui sont assez largement répandus.
En particulier, le reste 2-amino-6-méthyl-4-оxo-
de ptéridine fait partie de l'acide folique et le fragment 2,4-
dioxoptéridine assiste dans la vitamine la plus importante
ribophlavine — le facteur de la croissance des organismes vivants
(vitamine В![]() ).
).
Les tâches standartes et leur résolution
La tâche ХVII. Au premier stade de la synthèse des moyens antimicrobiens d'une série furanique on passe la réaction de la nitration du furfurol. Pourquoi à la différence du furanne on peut nitrurer du furfurol par l'acide nitrique ?
La résolution. Le furfurol représente l'hétérocycle de cinq membres, il est aromatique, électronoabondant, il contient l’oxygène et possède les propriétés acidophobes (ne subit pas la présence des acides), c'est pourquoi sa nitration est possible, par exemple, par l’acétylnitrate dans la pyridine. Le groupe aldéhydique électronoaccepteur dans le furfurol baisse la densité électronique dans le noyau du furanne qu'amène à sa stabilisation considérable. Selon les propriétés chimiques il est proche au benzoaldéhyde et entre facilement dans les réactions de la substitution élecrophyle et il se nitrurer par l'acide nitrique en presence d’aldéhyde acétique.
HNO3,
(CH3CO)2O

furfurol 5-nitrofurfurol
Les tâches pour la résolution indépendante :
4.1. La vitamine РР (l'amide de l'acide nicotinique) prévient le développement de la pellagre. Recevez le nicotinamide de l'acide nicotinique et de chloranhydrite de l'acide nicotinique.
4.2. L'indole (benzpyrrol) c’est le fragment structural de plusieurs alcaloïdes, utilisé dans la pratique médicale (réserpine, la strychnine etc.). Lequel de deux cycles dans la molécule de l'indole participe préférablement à la reaction de la substitution électrophile ? Écrivez le schéma de la réaction de la soulfation.
4.3. Le moyen spasmolitique dibazol c’est l’hydrochlorure de 2-benzimidazol. Lequel de deux atomes de l'azote du noyaux du benzimidazol participe à la réaction de la formation de ce sel ?
4.4. Le sel de sodium du barbital (le barbital-sodium) est appliqué comme et le moyen calmant et somnifère. Quel centre de l'acidité dans la molécule du barbital participe à la formation du sel ? Quel type de tautomérie est possible pour les barbitrates ?
4.5. Le thé contient 1,3,7,9-tétraméthylurique acide. Écrivez la formule structurale de cette liaison. S'il est capable aux transformations tautomériques ? Pourquoi ?
4.6. Les procès inflammatoires pendant la podagre s'offrent par la précipitation dans les articulations du sel monosodique de l'acide urique. Dans quelle forme tautomérique l'acide urique participe à la formation du sel de sodium?
Le SUJET 5. Les aminoacides, les peptides, les PROTEINES
La structure et les propriétés des aminoacides et des peptides.
Les aminoacides ce sont les liaisons dans les molécules desquelles existent simultanément les fonctions aminés et carboxyliques.
5.1 La structure des aminoacides. On peut envisager tous les -aminoacides comme le résultat de la substitution de l'atome de l'hydrogène dans le -aminoacide le plus simple – la glycine – par n`importe quel radical R. Ainsi, conformément à la nature du radical R, appelé la chaîne latérale, on subdivise les -aminoacides en 4 groupes, se distinguant par les propriétés hydrophiles ou hydrophobes des chaînes latérales, ainsi que par la capacité de la chaîne latérale de manifester les propriétés acides ou basiques.
La stéréochimie des -aminoacides naturels se caractérise par ce que ils tous, excepté la glycine, ont l'atome asymétrique du carbon (l'atome lié aux fonctions amines et carboxyles).

Tous les -aminoacides naturels sont L-isomères énantiomorphes (les inverses optiques).
La configuration du centre asymétrique des aminoacides définit les propriétés biologiques comme des aminoacides eux-mêmes, et des combinaisons oligo - et polymériques, dont les monomères sont les résidus (les restes) des aminoacides (on appelle ces combinaisons les peptides).
5.2 Les propriétés des aminoacides. Les aminoacides représentent les substances incolores cristallines avec des températures (des constantes) de fusion assez élevées (plus de 230 °С). Plusieurs acides sont bien dissolubles dans l'eau et pratiquement non-dissolubles dans l'alcool et dans l'éther diéthylé, ce que indique sur le caractère saline de ces substances. La dissolubilité spécifique des aminoacides est conditionnée par la présence dans la molécule simultanément des aminogènes (le caractère basique) et de la fonction carboxylique (les propriétés acides), grâce à quoi les aminoacides appartiennent aux électrolytes amphotères.


Dans les solutions d'eau et en état solide les aminoacides existent seulement en forme des sels intérieurs - en état zwitterionique (des ions bipolaires).
L`équilibre acido-basique pour l'aminoacide peut être décrite:

le sel d'ammonium
Si on applique à la solution de l'aminoacide le champ électrique, alors en fonction du paramètre рН de la solution, les ions de l'aminoacide se déplaceront différemment: dans un milieu acide à рН <7 les cations ammoniques des aminoacides se déplacent vers le pôle négatif (la cathode), et dans le milieu alcalin à рН> 7 les carboxylat-anions - vers le pôle positif (l`anode). La signification de рН, quand la molécule de l'aminoacide est électroneutre, s`appelle le point isoélectrique, on la désigne рI. À la signification de рН, égal au paramètre рI, la molécule de l'aminoacide dans le champ électrique ne se déplace pas et la solution de l'aminoacide n`est pas le conducteur de courant.
La présence dans la molécule simultanément des groupes aminés et carboxyliques s`exprime aussi dans le comportement des aminoacides dans des réactions, où ne participe qu`un seule groupe fonctionnel de deux groupes.
Avec la participation de la fonction carboxyle peuvent passer toutes les reactions, caractéristiques pour des acides carboxyliques avec la formation des fonction dérivées correspondantes des acides carboxyliques (les éthers complexes, les amides etc.).
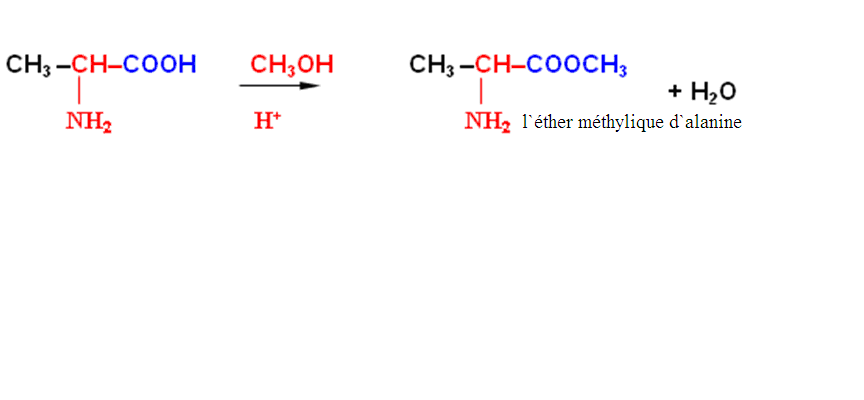

Il faut tenir compte de plus, ce que l'aminogène s`oxyde facilement, c'est pourquoi, par exemple, pour l`acquisition des halogénéshydrides des aminoacides il faut passer l`acylation préalable de l`aminogène. Après l`acquisition de l`halogénéshydride, la protection aci s`hydrolise.
L`acylation demande la transformation préalable du zwitter-ion en carboxylat-anion et passe avec succès à la présence dans le milieu réactionnaire de la fonction basique (la fonction basique est nécessaire pour le couplage d'un produit acide se détachant à l`acylation – l`halogène-hydrogène ou l`acide carboxylique).

L`une
des réactions les plus importantes dans l'organisme – la
décarboxylation
des aminoacides. Le détachement de СО![]() se passe sous l'effet des enzymes spéciaux – des décarboxylases:
se passe sous l'effet des enzymes spéciaux – des décarboxylases:

La formation des bases de Chiffe (comme la réaction typique des amines) est aussi propre aux aminoacides; on utilise le plus souvent les réactions des aminoacides avec le benzaldéhyde:
C`est à la formation des bases de Chiff qu`est fondée la réaction de l'identification des aminoacides, connue comme «l`épreuve (l`essai) ninhydrine», largement appliquée pour la visualisation des zones des aminoacides (la coloration intense bleu-violet apparaît) à leur séparation électrophorétique et chromatographique, et aussi pour la définition quantitative du teneur des aminoacides dans les solutions :


La désamination des aminoacides, comme toute amine primaire, passe à l`effet de l'acide azoteux aux aminoacides. Cette réaction est à la base de la méthode de la définition du teneur de l'azote et de la quantité d'aminogènes dans les aminoacides (la méthode de Van-Slaik).

La biosynthèse des aminoacides. Tous les -aminoacides naturels sont divisés en irremplaçables (la valine, l'histidine, l'isoleucine, la leucine, la lysine, le méthionine, l`acide α-amino-β-hydroxybutyrique, le tryptophanne, le phénylalanine), qui pénètrent dans l'organisme seulement de l`environnement, et les remplaçables, dont la synthèse se passe dans l'organisme.
En qualité des substances initiales à la biosynthèse des aminoacides d'autres aminoacides peuvent se produire aussi, par exemple, d`après la réaction de transamination. La biosynthèse des -aminoacides peut se passer et à la base des liaisons d`une autre classe.
Les catalyseurs et les participants de ce procès sont les ferments (les transaminases) et le coenzyme le pyridoxalphosphate, qui sert du transporteur de l'aminogène.
5.3 Les peptides. Les groupes aminés et carboxyliques des aminoacides peuvent réagir l'une avec l'autre avec la formation de la liaison intermoléculaire amidée –СО–NH–.

Alanine sérine dipeptide alanile-sérine
Les amides formées à la suite de la coopération d'un certain nombre des aminoacides s`appellent des peptides. En fonction du nombre des restes des amino-acides, on distinguent di - trois - tetra - peptides etc. De plus, les peptides, dont la masse moléculaire ne fait plus de 10 000 s`appellent les oligopeptides, d`autres, avec la masse moléculaire plus 10 000 – les polypeptides, ou les albumines. Les liaisons amidées dans le composé des peptides s`appellent les liaisons peptidiques.
L`agroupement peptidique se caractérise par une série des propriétés.
1. L`agroupement peptidique a une structure rigide planaire, c.a.d. tous les atomes, qui font partie de cet agroupement, s'installent dans un seul plan.
2. Les atomes de l'oxygène et l'hydrogène de l`agroupement peptidique des peptides naturels et des albumines se trouvent dans la trans-position par rapport à la liaison С—N, puisque à la trans-configuration des substituants les chaînes latérales se sont plus éloignées l'une de l'autre, ce qui est important pour la stabilisation de la structure de la molécule albuminée.
3. La liaison peptidique est stable à la température 310 K dans les milieux, proches des neutres (les conditions physiologiques). Dans des milieux acides et alcalins la liaison subit l'hydrolyse. Dans les conditions de l'organisme l'hydrolyse se passe enzymatiquement.
4. Les liaisons supplémentaires, en général, non-covalentes entre le groupe peptidique et les chaînes latérales conditionnent l'existence des formes diverses de la molécule albuminée. Par exemple, les liaisons intramoléculaires hydrogéniques (N—Н -- О=С) stabilisent la structure secondaire de l'albumine.
Le début (le commencement) de la chaîne polypeptidique c`est la fin, portante l'aminogène libre (N-fin); la chaîne polypeptidique s'achève par la fonction carboxyle libre (la C-fin). En général, à la représentation de la formule du peptide on dispose la N-fin à gauche, et la C-fin — à droite :

On nomme le peptide, en énumérant successivement, à partir de la N-fin, les noms des aminoacides, faisant partie du peptide; de plus le suffixe «-in» est remplacé par le suffixe «- il» pour tous les aminoacides, excepté C-final. Pour la description de la structure des peptides on n`applique pas des formules traditionnelles structurales, mais les désignations réduites (l`abréviation), permettant de faire les notes plus compactes.
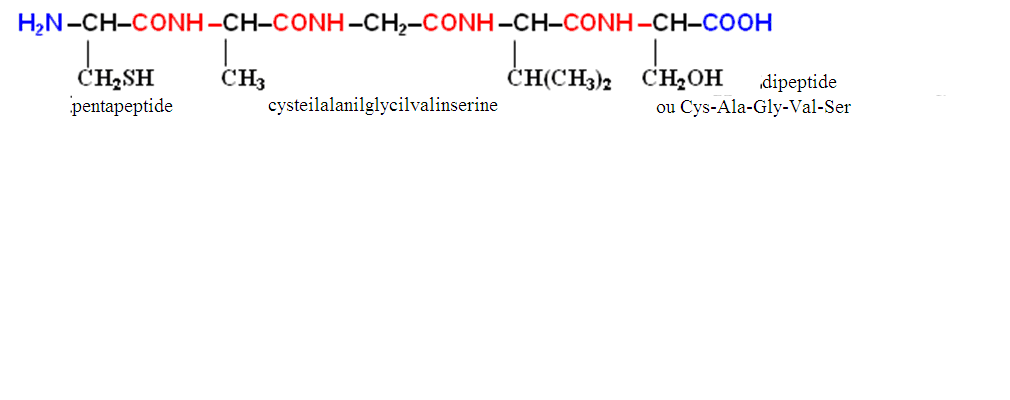
La notion «la structure du peptide» (de même que «la structure primaire de l'albumine») comprend les caractéristiques suivantes :
1) le nombre total des restes (des résidus) amino-acides ;
2) la liste des aminoacides faisant partie du peptide, et l'indication de la quantité des résidus amino-acides de chaque espèce (le composé amino-acide du peptide ou de l'albumine);
3) la succession de la fixation (le couplage) des aminoacides l'un avec l'autre (on nomme ce paramètre la succession (la séquence) amino-acide; il reflète la structure primaire du peptide ou de l`albumine soi-disante); on marque la succession de gauche à droite de la N-fin vers la C-fin.
5.4 Les réactions qualitatives. Pour l'identification de certains peptides et albumines on utilise «les réactions de couleur» soi-disantes.
La réaction universelle au groupe peptidique - l'apparition de la coloration rouge - violet à l`addition à la solution de la protéine des ions du cuivre (II) dans le milieu alcalin (la réaction du biuret).
La réaction aux restes (résidus) des aminoacides aromatiques - tyrosine et phénylalanine – c`est l`apparition de la coloration jaune au traitement de la solution de la protéine par l'acide nitrique concentré (la réaction xanthoprotéique).
Les protéines soufrés (sulfurés) donnent la coloration noire au chauffage avec la solution de l'acétate du plomb (II) dans le milieu alcalin (la réaction de Fole).
D`après les composés, les protéines se subdivisent en simples et complexes. À l'hydrolyse des protéines simples en qualité des produits de la désagrégation on résulte les - aminoacides seulement. Les protéines complexes également avec la partie proprement albuminée comprenant les - aminoacides, contiennent les parties organiques ou inorganiques de la nature non-peptidique, appelés les groupes prosthétiques.
Les exemples des protéines complexes sont des protéines de transport - le myoglobine et l'hémoglobine, où la partie protéique - la globine – qui est jointe avec le groupe prosthétique - l`héme (l`hématine réduite). D'après le type du groupe prosthétique on les rapporte aux hémoprotéines. Les phosphoprotéines contiennent le résidus (le reste) de l'acide phosphorique, les métalloprotéines - les ions du métal.
