
- •Физика. Экзамен.
- •1) Кинематика материальной точки, Основная задача кинематики, три способа геометрического описания движения материальной точки. Кинематическое уравнение движения материальной точки.
- •2) Кинематические характеристики движения точки: скорость и ускорение. Нормальное и тангенциальное ускорение материальной точки.
- •3) Кинематика вращательного движения абсолютно твёрдого тела. Угловая скорость и угловое ускорение, их связь с линейной скоростью и линейным ускорением точек вращающегося тела.
- •4) Динамика поступательного движения материальной точки. Законы Ньютона.
- •5) Динамика материальной точки. Основные уравнения движения материальной точки в дифференциальной форме.
- •6) Динамика системы частиц, центр инерции системы, закон движения центра инерции.
- •7) Динамика системы частиц, закон сохранения импульса в замкнутой системе.
- •8) Динамика переменной массы. Уравнение движения тела переменной массы. Уравнение Циолковского.
- •9) Механическая энергия и работа. Работа переменной силы. Мощность. Работа консервативных сил.
- •15) Динамика вращательного движения тела. Основной закон динамики вращательного движения тела относительно неподвижной оси вращения.
- •16) Динамика вращательного движения тела. Момент импульса, закон сохранения момента импульса.
- •17) Гармонические колебания и их характеристики. Дифференциальное уравнение свободных колебаний.
- •18) Механические гармонические колебания; пружинный, физический и математический маятники.
- •19) Энергия гармонических колебаний. Закон сохранения энергии свободных гармонических колебаний.
- •20) Затухающие колебания, дифференциальное уравнение затухающих колебаний. Логарифмический декремент затухания.
- •21) Механические волны. Уравнение бегущей волны. Фазовая скорость.
- •22) Статистический и термодинамический методы исследования макроскопических свойств системы. Термодинамические параметры, равновесные состояния и процессы. Уравнение состояния системы.
- •Состояние оценивается параметрами: температура, плотность, давление, объем.
- •23) Опытные законы идеальных газов.
- •24) Основное уравнение молекулярно-кинетической теории газов.
- •25) Закон распределение Максвелла по скоростям теплового движения молекул.
- •26) Барометрическая формула. Распределение Больцмана во внешнем потенциальном поле.
- •27) Основы термодинамики: внутренняя энергия, число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
- •28) Первое начало термодинамики. Работа газа при изменении его объёма. Теплоёмкость газа.
- •29) Первое начало термодинамики. Применения первого начала термодинамики к изопроцессам.
- •30) Реальные газы. Уравнение Ван-дер-Вальса.
- •31) Обратимые и необратимые процессы. Круговой процесс. Термический кпд цикла.
- •32) Тепловые двигатели. Цикл Карно и его кпд для идеального газа.
- •33) Энтропия, её связь между термодинамической вероятностью. Свойства энтропии. Второе и третье начала термодинамики.
- •34) Электрический заряд. Законы сохранения и квантования заряда. Взаимодействие электрических зарядов. Закон Кулона.
- •35) Электрическое поле. Напряжённость электрического поля. Напряжённость поля точечного заряда. Принцип суперпозиций полей. Графическое изображение поля.
- •36) Поток вектора напряжённости электрического поля. Теорема Остроградского-Гаусса.
- •37) Расчёт напряжённости электрических полей, созданных равномерно заряженной плоскостью, объёмно заряженным шаром, заряженной сферой.
- •38) Работа сил электрического поля при перемещении заряда. Циркуляция вектора напряжённости электрического поля.
- •39) Потенциал электростатического поля. Разность потенциалов.
- •40) Связь между напряжённостью и разностью потенциалов. Напряжённость, как градиент потенциала. Эквипотенциальные поверхности.
25) Закон распределение Максвелла по скоростям теплового движения молекул.
Распределение молекул газа по величине скоростей называется распределением Максвелла.
Закон
Максвелла о распределении молекул
идеального газа по скоростям основан
на предположениях, что газ состоит из
большого числа N одинаковых молекул,
его температура постоянна, а молекулы
совершают тепловое хаотическое движение.
При этом на газ не действуют силовые
поля. Функция распределения молекул по
скоростям
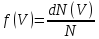 определяет
относительное число молекул dN(V)/N,
скорости которых лежат в интервале от
V до V+dV.
определяет
относительное число молекул dN(V)/N,
скорости которых лежат в интервале от
V до V+dV.



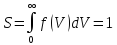
Vв – соответствующий максимум f(V).
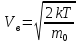
26) Барометрическая формула. Распределение Больцмана во внешнем потенциальном поле.
В реальности молекулы газа находятся в поле тяготения Земли. Тяготение с одной стороны и тепловое движение с другой приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.

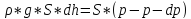

Воздух – идеальный газ. g=const, T=const.

 =
=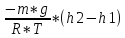

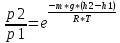

Распределение Больцмана.
p = n * k * T

 , где
, где
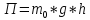 - потенциальная энергия молекулы в поле
тяготения Земли.
- потенциальная энергия молекулы в поле
тяготения Земли.
Распределение Больцмана во внешнем потенциальном поле, где n – концентрация молекул газа.
27) Основы термодинамики: внутренняя энергия, число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
Внутренняя энергия – энергия хаотичного движения молекул и энергия взаимодействия этих частиц.
Число степеней свободы - наименьшее число независимых координат, определяющих положение и конфигурацию молекулы в пространстве.
Закон
равномерного распределения энергии по
степеням свободы молекул можно
сформулировать следующим образом:
статистически в среднем на каждую
степень свободы молекул приходится
одинаковая энергия. Поступательное
движение молекул характеризуется
средней кинетической энергией, равной
![]() .
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
.
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
![]()
В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
![]()
28) Первое начало термодинамики. Работа газа при изменении его объёма. Теплоёмкость газа.
Превращение энергии. Идёт на изменение энергии U и совершение работы A:
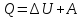
Работа
газа при изменении его объёма: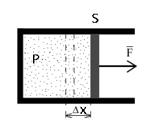
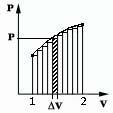
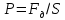
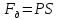
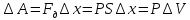
Площадь под графиком с осями P, V пропорциональна работе газа.
Теплоёмкость – количество теплоты, переданной системе.
 (удельная теплоёмкость тела)
(удельная теплоёмкость тела)
Теплоёмкость при постоянном объёме:
V=const (A=0)
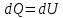
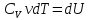

Теплоёмкость при постоянном давлении:
P=const
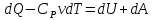
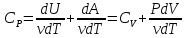
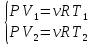 ⇒ PdV=νRdT ⇒
⇒ PdV=νRdT ⇒
 (уравнение Майера)
(уравнение Майера)

29) Первое начало термодинамики. Применения первого начала термодинамики к изопроцессам.
Изохорный процесс:
V=const, dV=0, dA=PdV=0
⇒ Первое начало: dQ=dU=CVνdT
Изобарный процесс:
P=const
Первое начало: dQ=dU+dA
R=A/νdT (универсальная газовая постоянная)
Изотермический процесс:
T=const
Первое начало: dQ=dA
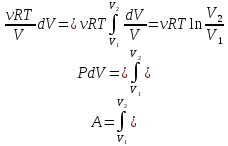
Адиабадный процесс:
Процесс при котором отсутствует теплообмен, т.е. dQ=0.
Первое начало: dU+dA=0
dA=-dU
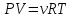
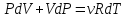
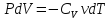
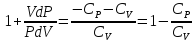
 (показатель адиабаты, или коэффициент
Пуассона)
(показатель адиабаты, или коэффициент
Пуассона)


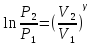
PVγ=const
