
- •Структура микроэмульсий и мицеллярных растворов
- •Термодинамика мицеллообразования.
- •Фазовые диаграммы растворов пав
- •Лимитирующие стадии.
- •Обмен через дисперсионную среду.
- •Одночастичный обмен при столкновении мицелл.
- •Механизм обмена типа "слияние-разделение".
- •Обобщенная модель столкновительного комплекса.
- •Кинетика тушения люминесценции в мицеллах.
Термодинамика мицеллообразования.
Образование мицелл в полярном растворителе начинается, когда концентрация ПАВ превышает определенное критическое значение, которое называется критической концентрацией мицеллообразования (ККМ). Концентрационные зависимости ряда физических величин (например, коэффициента поверхностного натяжения, вязкости, электропроводности, осмотического давления, светорассеяния) претерпевают излом в точке ККМ. Значение ККМ зависит от природы ПАВ. Как правило, с ростом длины алкильного хвоста ККМ падает, причем для n10-15 эта зависимость линейна. Для каждого ПАВ существуют также критическая температура, так называемая точка Крафта, ниже которой мицеллы не образуются. Рассмотрим простую термодинамическую модель мицеллярного раствора, считая, что процессы агрегации происходят путем последовательного присоединения отдельных молекул ПАВ по следующей схеме:
М1 + М1 М2
М2 + М1 М3
Мi-1 +M1 Mi
Мn-1 +M1 Mn
где символ Miобозначает агрегат (или мицеллу), содержащийi молекул ПАВ. Из условия химического равновесия следует следующее соотношение между химическими потенциалами мицеллыnи химическим потенциалом молекул ПАВ
n1 = n
С другой стороны, рассматривая данную систему как слабый раствор, содержащий nразличных компонент, можно представить свободную энергию мицеллярного раствора в виде
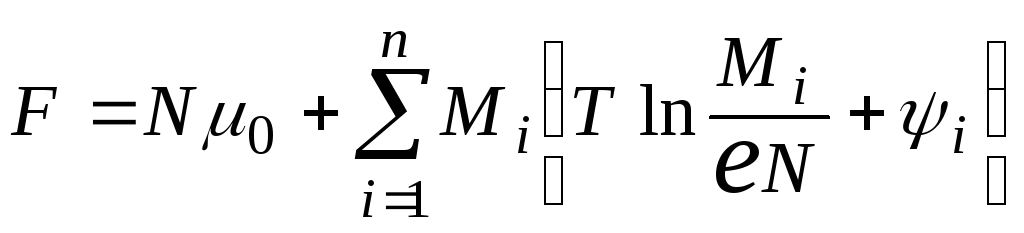 .
.
Здесь 0 – химический потенциал чистого растворителя, аNиMi– соответственно число молекул растворителя и число мицелл. Функцияi(Р,Т)представляет собой усредненную потенциальную энергию взаимодействия мицеллыMiс окружающими молекулами растворителя. Далее можно обычным образом ввести парциальные химические потенциалы растворителя и мицелл.
![]()
![]()
где Ci– соответствующие концентрации мицелл, содержащих в своем составеiмолекул ПАВ.Принимая во внимание условие химического равновесия (2), находим:
![]()
или
![]() .
.
Полная концентрация молекул ПАВ в мицеллярном растворе
![]()
Для нахождения зависимости iот числа агрегации необходимо рассмотрение микроскопической структуры мицеллы.
Фазовые диаграммы растворов пав
При небольшом превышении концентрации ПАВ значения ККМ, форма мицелл и число агрегации практически не изменяются, т.е. избыточное по сравнению с ККМ количество молекул ПАВ идет на образование новых мицелл. Таким образом, концентрация мицелл с данным числом агрегации растет пропорционально разности полной концентрации ПАВ и ККМ. Строго говоря, мицеллярный раствор нельзя рассматривать как отдельную фазу, отличную от мицеллярного раствора ПАВ. Тем не менее, образование мицелл при концентрации ПАВ выше ККМ приводит к существенному изменению ближнего порядка раствора. Действительно, в отдельно взятой мицелле радикально изменяется взаимное расположение молекул ПАВ. С общей точки зрения, образование мицелл представляет собой критическое явление типа фазового перехода 2-го рода, связанное с изменением параметра порядка системы.
При дальнейшем повышении концентрации наблюдается вторая критическая концентрация мицеллообразования, превышение которой может привести к изменению структуры мицеллы, например, переходу от сферической формы мицеллы к дискообразной или цилиндрической формам.
Другой сценарий состоит в том, что может произойти расслоение раствора на две фазы, имеющие разную концентрацию молекул ПАВ. Фаза с большим содержанием ПАВ может быть как изотропной так и анизотропной. Одной из часто реализующихся возможностей является образование гексагональной фазы, образованной цилиндрическими мицеллами различной длины, при этом цилиндрические мицеллы упакованы в двумерную решетку, имеющую гексагональную симметрию.
Кроме этого возможны еще другие структурные организации, например, образование ламелярной фазы, т.е. фазы, образованной дискообразными мицеллами различного диаметра.
В дальнейшем мы будем рассматривать в основном разбавленные мицеллярные растворы и микроэмульсии, условно считая, что они образованы сферическими мицеллами. Как показывают результаты молекулярного моделирования, реальная форма мицелл довольно сильно отличается от идеальной сферической.
Мицеллярный катализ
Важным свойством водных мицеллярных растворов является их способность растворять или солюбилизировать в мицеллярной фазе молекулы гидрофобных веществ. В мицеллярных растворах и микроэмульсиях локальные концентрации солюбилизированных низкомолекулярных веществ могут на несколько порядков превышать их средние объемные концентрации. Именно с этим связано явление ускорения химических реакций в мицеллярных растворах, которое известно в литературе как мицеллярный катализ [i]. Если при этом скорость процесса лимитируется непосредственно актом химической реакции внутри мицеллы, то есть можно считать, что реакция не нарушает равновесия реагентов между мицеллярной фазой и дисперсионной средой, то скорость необратимой бимолекулярной реакции А + В Х описывается законом действия масс
![]() (1)
(1)
где ![]() - объемная доля мицеллярной фазы, а
эффективная константа скорости реакции
определяется соотношением
- объемная доля мицеллярной фазы, а
эффективная константа скорости реакции
определяется соотношением
![]() (2)
(2)
в котором ![]() = [A]m
/[A]s
и
= [A]m
/[A]s
и ![]() = [A]m
/[A]s
— коэффициенты распределения реагентов
А и В между мицеллярной фазой и
дисперсионной средой, а
= [A]m
/[A]s
— коэффициенты распределения реагентов
А и В между мицеллярной фазой и
дисперсионной средой, а ![]() и ks
константы скорости реакции, соответственно
в мицеллах и в среде.
и ks
константы скорости реакции, соответственно
в мицеллах и в среде.
Однако для быстрых реакций, когда скорость процесса лимитируется доставкой реагентов в мицеллу, кинетика реакции становится намного сложней и не соответствует уравнению (1). В этом случае необходимо привлечение микроскопического описания. Вводится функция распределения молекул по мицеллам
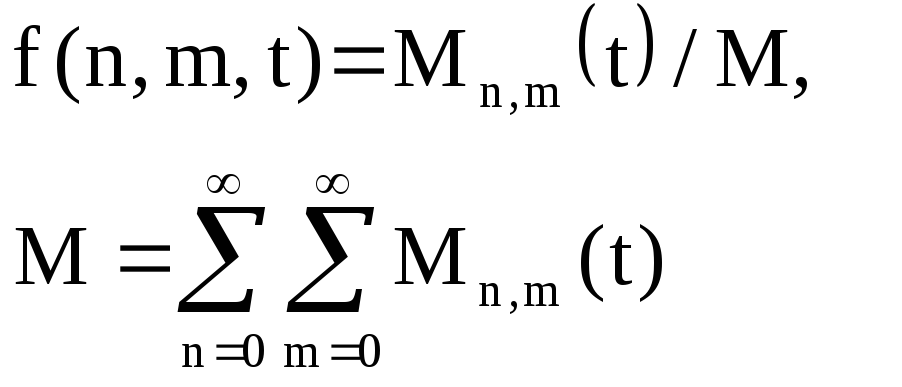 (3)
(3)
которая определяется как отношение концентрации мицелл, содержащих n молекул реагента А и m молекул реагента B, к суммарной концентрации мицелл в растворе. Для нахождения функции распределения необходимо решить систему нелинейных дифференциальных уравнений
 (4)
(4)
где ![]() -
вероятность в единицу времени образования
p молекул продукта С в мицеллах типа
Mn,m,
-
вероятность в единицу времени образования
p молекул продукта С в мицеллах типа
Mn,m,
![]() - вероятность в единицу времени перехода
Mn,m
Mp,q
за счет
процессов межмицеллярного и/или
межфазного обмена молекул реагентов А
и В
. Затем переходят к наблюдаемым величинам,
таким как средние числа молекул реагентов
А
и В
в расчете
на одну мицеллу
- вероятность в единицу времени перехода
Mn,m
Mp,q
за счет
процессов межмицеллярного и/или
межфазного обмена молекул реагентов А
и В
. Затем переходят к наблюдаемым величинам,
таким как средние числа молекул реагентов
А
и В
в расчете
на одну мицеллу
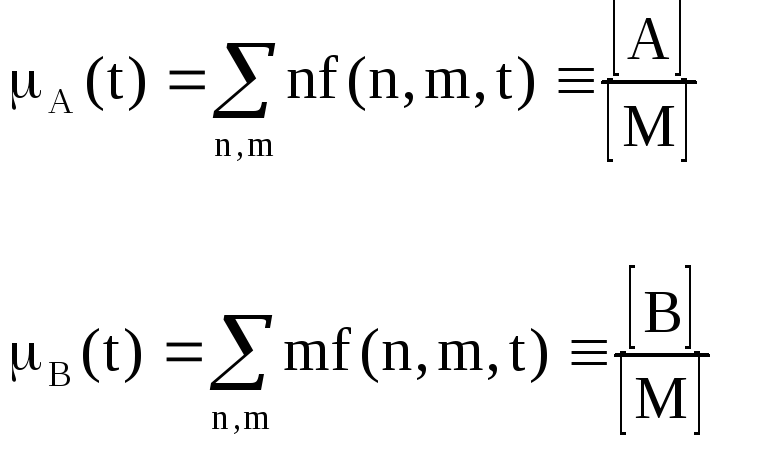 (5)
(5)
В принципе кинетическое уравнение для первых моментов функции распределения должно быть намного проще, но тем не менее до настоящего времени сколь-нибудь общего решения данной кинетической задачи не получено.
Последние 10-15 лет усилия исследователей были сосредоточены на решении одного частного случая этой кинетической задачи, когда один из реагентов находится в большом избытке, так что его расходом в ходе реакции можно пренебречь. Например, этому условию точно удовлетворяет процесс тушения люминесценции возбужденной молекулы-люминофора L* молекулой тушителя.
L* + Q L + Q*
В этом случае уравнения (4) существенно упрощаются, так как Q = = const, L* <<1 и вместо двухиндексной функции распределения (3) вводится одноиндексная функция распределения P*n(t) – относительная доля мицелл, содержащих n молекул тушителя Q и одну возбужденную молекулу люминофора L*. Ниже мы подробно рассмотрим эту кинетическую задачу, но сначала остановимся на вопросах распределения молекул по мицеллам и процессах межмицеллярного обмена солюбилизированных молекул.
