
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Химия элементов. Свойсвта s-элементов и d-элемнтов I, II групп.
- •Водород, вода. Пероксид водорода
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства элементов iв группы: Cu, Ag, Au
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Элементы iiв группы: Zn, Cd, Hg
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Контрольные вопросы и задания
- •Индивидуальные задания
- •Исходные данные
- •1.4. Тестовые задания
- •Тема 2. Свойства элементов и соединений III - viiв групп.
- •2.1. Теоретические сведения
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства элементов viib группы. Марганец
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •Свойства оксидов и гидроксидов марганца
- •2.2. Контрольные вопросы и задания
- •2.3. Индивидуальные задания
- •Исходные данные
- •2.4. Тестовые задания
- •Тема 3. Свойства элементов viiib группы и их соединений
- •Атомные характеристики элементов
- •Основные физико-химические свойства металлов
- •3.4. Тестовые задания
- •Тема 4. Свойства элементов и соединений III - iVa групп
- •4.1. Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Индивидуальные задания
- •Исходные данные
- •4.4. Тестовые задания
- •Тема 5. Свойства элементов и соединений vа группы
- •5.1. Теоретические сведения
- •Кислородные соединения азота.
- •Кислородсодержащие соединения фосфора
- •Атомные характеристики элементов
- •5.2. Контрольные вопросы и задания
- •5.3. Индивидуальные задания
- •Исходные данные
- •5.4. Тестовые задания
- •Тема 6. Свойства элементов и соединений vIa группы
- •6.1. Теоретические сведения
- •Природные источники элементов VI а группы
- •6.2. Контрольные вопросы и задания
- •6.3. Индивидуальные задания
- •Исходные данные
- •6.4. Тестовые задания
- •Тема 7. Элементы viIа группы. Благородеые газы
- •7.1. Теоретические сведения
- •Природные источники галогенов
- •Атомные характеристики элементов
- •Физико-химические свойства простого вещества
- •Физико-химические свойства галогеноводородов
- •Соединения галогенов с кислородом
- •Физико-химические свойства оксидов галогенов
- •Электродные потенциалы галогенов
- •Окислительно-восстановительные потенциалы хлора
- •Характеристика кислот
- •7.2. Контрольные вопросы и задания
- •7.3. Индивидуальные задания
- •Исходные данные
- •7.4. Тестовые задания
- •Программа дисциплины «общая и неорганическая химия» (первый и второй вопросы экзаменационных билетов)
- •Перечень практических вопросов (третий вопрос экзаменационных билетов)
- •Перечень тем типовых задач (четвертый вопрос экзаменационных билетов)
- •Критерии экзаменационной оценки «отлично»
- •«Хорошо»
- •«Удовлетворительно»
- •«Неудовлетворительно»
- •План общей характеристики группы элементов (атома элемента)
- •План характеристики элемента и его соединений
- •Перечень видеофильмов по изучаемым темам курса «общая и неорганическая химия»
- •Библиографический список
- •Оглавление
Свойства элементов iв группы: Cu, Ag, Au
Медь, серебро и золото являются d-элементами, простые вещества – металлы: конфигурация наружных электронных оболочек атомов… (n-1)d10ns1:
29Cu[18Ar]3d104s1; 47Ag[34Xe] 4d105s1; 79Au[54Kr] 4f145d106s1
Завершение предвнешней оболочки происходит за счет перехода одного s-электрона наружного слоя на предвнешнюю d-орбиталь. Такая d-оболочка недостаточно стабильна: в образовании химических связей у элементов подгруппы меди могут принимать участие и d-электроны предвнешнего слоя; поэтому Cu, Ag и Au могут проявлять степени окисления +1, +2, +3. На внешней электронной оболочке атомы меди, серебра и золота содержат по 1 электрону, как у атомов щелочных металлов, но на предвнешней – 18 – электронные оболочки (у атомов щелочных металлов – 8ē). Наличие 18 ē в предвнешней оболочке и более высокий заряд ядра у элементов подгруппы меди приводит к эффекту её сжатия. Вследствие этого радиусы атомов Cu, Ag и Au меньше радиусов атомов щелочных металлов тех же периодов, а энергия ионизации больше. Поэтому медь, серебро и золото резко отличаются от щелочных металлов более высокими значениями плотностей, температур плавления и кипения, положительными значениями электродных потенциалов, малой химической активностью (табл. 3, 4). Химическая активность убывает от меди к золоту: серебро и золото – благородные металлы, трудно поддающиеся окислению. Благодаря стойкости по отношению к химическим воздействиям, Cu, Ag и Au с древнейших времен находят широкое практическое применение.
Таблица 3
Атомные характеристики элементов
|
Элемент |
Cu |
Ag |
Au |
|
Атомный номер |
29 |
47 |
79 |
|
Ковалентный радиус, нм |
0,117 |
0,134 |
0,134 |
|
Металлический радиус, нм |
0,128 |
0,144 |
0,146 |
|
Радиус иона, нм Э+ Э2+ Э3+ |
0,077 0,073 0,054 |
0,115 0,094 0,075 |
0,137 – 0,085 |
|
Электроотрицательность |
1,75 |
1,42 |
1,42 |
|
Первый потенциал ионизации, В |
7,7264 |
7,5763 |
9,2258 |
|
Степени окисления (выделены наиболее устойчивые степени окисления) |
+1,+2,+3 |
+1,+2,+3 |
+1,+3 |
Таблица 4
Основные физико-химические свойства металлов
|
Металл |
Cu |
Ag |
Au |
|
Тип кристаллической решётки |
Кубическая гранецентрированная | ||
|
Плотность , г/см3 |
8,96 |
10,50 |
19,32 |
|
Температура плавления, оС |
1083,6 |
962,08 |
1064,58 |
|
Стандартный электродный потенциал процессов Ео, В: Э+ + 1е → Э Э2+ + 2е → Э Э3+ + 3е → Э |
0,521 0,337 – |
0,799 – – |
1,691 – 1,498 |
Легче всего эти металлы реагируют с галогенами: Cu – при обычной температуре, а Ag и Au – при нагревании. Сухой кислород при обычной температуре на них не действует.
При нагревании до температуры красного каления медь окисляется кислородом до CuO, при более высокой температуре до Cu2O:
2CuO(т) Cu2O(т) + 1/2O2(г);
Серебро и золото не окисляются кислородом и при нагревании. С серой соединяется не только медь, но и серебро. С водородом, азотом и углеродом они не образуют соединений даже при высоких температурах.
В электрохимическом ряду Cu, Ag и Au стоят правее водорода, поэтому они не вытесняют водород из растворов кислот. На медь и серебро действуют только азотная и концентрированная серная кислоты (при нагревании):


 6ē
6ē
3Cu(т) + 2HNO3(p) + 6HNO3(p) = 3 Cu(NO3)2(в) + 2NO(г) + 4H2O(ж)
Cu(т) + 2HNO3(к) + 2HNO3(к) = Cu(NO3)2(в) + 2NO2(г) + 2H2O(ж)
2Ag(т) + H2SO4(к) + H2SO4(к) = Ag2SO4(в) + SO2(г) + 2H2O(ж)
(в этих кислотах окислителем служат не ионы Н+, а ионы NO3- и SO42-).
Золото растворяется в селеновой кислоте, «царской водке», хлорной воде и насыщенной хлором хлороводородной кислоте:
2Au(т) + 6H2SeO4(к) = Au(SeO4)3(в) + 2SeO2(г) + 6H2O
Au(т) + HNO3(к) + 4HCl(к) = HAuCl4(в) + NO(г) + 2H2O
2Au(т) + 3Cl2(г) + 2HCl(к) = 2HAuCl4(в)
Все три металла легко растворяются в ртути, образуя сплавы-амальгамы. Амальгама серебра, быстро твердеющая сразу же после приготовления, используется в стоматологии для пломбирования зубов.
Медь, серебро и золото образуют многочисленные сплавы друг с другом и с другими металлами. К действию щелочей в отсутствии окислителей они устойчивы. В присутствии CN- – ионов в водном растворе медь, серебро и золото окисляются кислородом, вследствие комплексообразования, а медь – ионом водорода воды:
4 Au(т) + 8NaCN(в) + O2(г) + 2H2O(ж) = 4NaAu(CN)2(в) + 4NaOH(в)
4Ag(т) + 8KCN(в) + O2(г) + 2H2O(ж) = 4KAg(CN)4(в) + 4KOH(в)
2 Cu(т + 4KCN(в) + 2H2O(ж) = 2KCu(CN)2(в) + 2KOH(в) + H2(г)
Ионы металлов обладают окислительными свойствами, усиливающимися от Cu (II) к Au (III), и высоким поляризующим действием, которым обусловлена окраска большинства соединений, способность к образованию комплексов, малая термическая прочность оксидов, гидроксидов и некоторых галогенидов.
Для ионов меди, серебра и золота весьма характерно образование комплексных соединений с анионами кислот, аммиаком, многими органическими соединениями. В комплексных соединениях связи металл-лиганд в значительной степени ковалентны. Для Cu (I) и ее аналогов характерны координационные числа 2 (с линейной структурой комплекса) и 4 (тетраэдрическая, иногда искаженная, структура), а для Cu (II) также 6 (октаэдрическая) и возможно 6 (квадратная пирамида, например, в комплексе меди с -аланилгистидином, реже – тригональная бипирамида), для Au (III) характерно координационное число – 4.
Оксиды и гидроксиды элементов 1В группы. В соответствии с характерными степенями окисления элементы образуют следующие оксиды: Cu2O (красный), CuO (черный), Ag2O (темно-бурый), Au2O (фиолетовый), Au2O3 (черно-бурый). Они почти всегда нерастворимы в воде и обладают амфотерным характером (с трудом растворяются в концентрированных щелочах и концентрированных кислотах) с преобладанием основных свойств у оксидов меди и серебра и кислотных – у оксидов золота.
Оксиды серебра и золота при нагревании разлагаются с выделением кислорода:
2Ag2O(т) = 4Ag(т) + O2(г)
Cu2O образуется при действии восстановителя – глюкозы, формалина, гидразина или гидроксиламина – на щелочной раствор фелинговой жидкости (см. ниже) или сульфата меди (II) при нагревании по схеме:
CuSO4(в) + 2NaOH(в) = Cu(OH)2(т) + Na2SO4(в)



 O
O
O
O
2
Сначала
выпадает
желтый
осадок
CuOH,
переходящий
в
красный
Cu2O



H OH
(CHOH)4 (CHOH)4


CH2OH CH2OH
CuO получают при нагревании меди до 400–800 оС в присутствии кислорода. Выше 1100 оС оксид разлагается по вышеприведённой схеме:
2CuO(т) Cu2O(т) + 1/2O2(г)
CuO легко образуется при термическом разложении основного карбоната меди или гидроксида меди (II):
t
Cu2(OH)2CO3(т) = 8CuO(т) + H2O(ж) + CO2(г)
t
Cu(OH)2(т) = CuO(т) + H2O(ж)
Гидроксиды CuOH, Cu(OH)2, AgOH, AuOH и Au(OH)3 малорастворимы в воде, термически малоустойчивы, легко отщепляют воду, переходя в оксиды. Поэтому щелочи из раствора соли серебра осаждают бурый оксид серебра (I):
2AgNO3(в) + 2NaOH(в) = Ag2O (т) + H2O(ж) + 2NaNO3(в).
Cu(OH)2 осаждается в виде студенистой голубоватой массы при действии щелочи на соли меди (II):
CuSO4(в) + 2NaOH(в) = Cu(OH)2(т) + Na2SO4(в).
Он легко растворим в кислотах с образованием аквакомплексов [Cu(H2O)6]2+ сине-зеленого цвета, и только в сильно концентрированных растворах щелочей – с образованием гидроксокупратов:
Cu(OH)2(т) + 2NaOH(конц) = Na2[Cu(OH)4] (в)
Cu(OH)2(т) + 4NH3(г) = [Cu(NH3)4](OH)2(в).
Реакция образования комплексного иона [Cu(NH3)4]2+ темно-синего цвета используется в аналитической химии для обнаружения иона меди (II).
Константа нестойкости аммиаката меди 2,1·10-13. Молекула аммиака является довольно сильным лигандом и вызывает значительное расщепление d – подуровня меди. Формируется низкоспиновый тетраэдрический парамагнитный комплекс (наличие неспаренных электронов у иона Cu2+), с максимумом поглощения видимого света с длиной волны λ = 304 нм, что соответствует энергии расщепления d – подуровня - 349 кДж/моль.
Гидроксид меди (II) хорошо растворяется в многоатомных спиртах (этиленгликоле, глицерине) и в растворах тартратов – солей винокаменной кислоты, образуя комплексные соединения хелатного типа. Растворы окрашиваются в красивый темно-синий цвет. Например, фелингов раствор, приготовленный из сегнетовой соли KNaC4H4O6, CuSO4 и NaOH, используется в биохимии для обнаружения и количественного определения восстановителей: альдегидов, моносахаридов, некоторых витаминов, гормонов. С восстановителями фелингов раствор на холоду выделяет CuOH желтого цвета, а при нагревании выпадает красный осадок Cu2O:
 O
O
C
O O
C
O
O
C
O O
C
H ONa
H-C-OH C – O– O– – C H-C-OH COONa
HO-C-H + K2Na2H2 HC – О – Cu – О –CH + NaOH+ H2O HO-C-H + 2HC-OH + Cu2O
оксид
H-C-OH CH-O– O--CH H-C-OH H–C–OH меди(I)
H-C-OH – COO– – COO– H-C-OH COOK
CH2OH CH2OH
D – глюкоза, Na, K-тартрат–комплексное соединение меди, D – глюконат натрия, Na,K– тартрат
Свойства Сu2+ образовывать в щелочной среде окрашенные в сине-фиолетовый цвет комплексные соединения с белками и биуретом (NH2 – CO – NH – CO – NH2), например:
 NH2
– CO – N – CO – NH2
NH2
– CO – N – CO – NH2
Cu2+
NH2 – CO – N – CO – NH2
– используют в биохимии для обнаружения пептидных связей. Реакция Cu2+ с биуретом и белками называется биуретовой.
Au(OH)3 – бурого цвета – осаждается при действии щелочи на раствор AuCl3 или H[AuCl4]. При его высушивании образуется AuO(OH) – метазолотая кислота, а при осторожном нагревании до 140 – 150 оС получается оксид Au2O3, который разлагается на Au и О2 при нагревании выше 160 оС.
Гидроксид золота (III) – амфотерное соединение с преобладанием кислотных признаков: Au(OH)3 легко растворяется в щелочах, образуя тетрагидроксоаураты (III):
Au(OH)3(т) + NaOH(в) = Na[Au(OH)4](в)
и в кислотах – с образованием анионных комплексов:
Au(OH)3(т) + 4HNO3(р) = H[Au(NO3)4](в) + 3 H2O(ж)
Оксиды и гидроксиды меди и серебра легко растворяются в водном растворе аммиака, образуя устойчивые комплексные основания, по силе приближающейся к щелочам, например:
Ag2O(т) + 4 NH3(в) + H2O(ж) = 2[Ag(NH3)2](OH)(в)
Нужно иметь в виду, что при продолжительном стоянии раствора [Ag(NH3)2]OH образуется черный осадок гремучего серебра AgN3 – вещества с очень сильными взрывчатыми свойствами.
В растворах галогеноводородных кислот оксиды и гидроксиды меди и серебра образуют соли типа МеГ или МеГ2 и ацидокомплексы:
Ag2O(т) + 2HCl(в) = 2AgCl(т) + H2O(ж)
AgCl(т) + HCl(в) = H[AgCl2](в).
Соли меди, серебра и золота. Большинство солей одновалентных меди, серебра и золота трудно растворяются в воде. Малорастворимы галогениды, цианиды, сульфиды. Растворимость галогенидов уменьшается от фторидов к иодидам. Например, AgF – растворим в воде, остальные галогениды практически нерастворимы: Кs(AgCl) = 1,6·10-10, Кs(AgBr) = 4,0·10-13, а Кs(AgI) = 9.7·10-17. Комплексные соединения меди, серебра и золота большей частью хорошо растворимы в воде, поэтому реакции комплексообразования часто используют для перевода малорастворимых солей в раствор.
Например, хлориды меди (I) и серебра растворяются в водном растворе аммиака:
AgCl(т) + 2NH3(в) = [Ag(NH3)2]Cl(в).
При действии HNO3 на хлорид диамминсеребра выпадает осадок AgCl вследствие образования из NH3 иона NH4+:
[Ag(NH3)2]Cl(в) + HNO3(в) = AgCl(т) + 2 NH4NO3(в).
Галогениды меди (I), серебра (I) и золота (I) легко образуют комплексы с тиосульфат- и цианид- лигандами: [Cu(S2O3)2]3-, [Ag(S2O3)2]3-, [Cu(CN)2]-, [Ag(CN)2]-, [Au(CN)2]-, когда константы нестойкости этих комплексов меньше, чем константы растворимости галогенидов, например:
CuI(т) + 2Na2S2O3(в) = Na3[Cu(S2O3)2](в) + NaI(в)
AgCN(т) + KCN(в) = K[Ag(CN)2](в);
с концентрированными галогеноводородными кислотами дают комплексные анионы [CuГ2]-, [Ag Г2]-, [Au Г2]– и растворяются в галогенидах щелочных металлов:
AgI(т) + KI(в) = K[AgI2](в).
Ионы меди, серебра и золота проявляют окислительные свойства, например:
2AgNO3(в) + H2O2 + 2KOH(в) = 2Ag + O2 + 2KNO3(в) + 2H2O
2Cu(CH3COO)2(в) + 4HI(в) = 4CH3COOH(в) + 2CuI +I2
3Na2[Sn(OH)4] (в) + 2AuCl3(в) + 6KOH(в) = 3Na2[Sn(OH)6] (в) + 2Au + 6HCl(в)
Газообразный диоксид серы – SO2 восстанавливает Cu2+ в Cu+ из кипящего концентрированного раствора Cu(CH3COO)2 в уксусной кислоте:
3Cu2+(в) + 2SO2(в) + 3H2O(ж) = CuSO4(в) + 6H+(в) + Cu2SO3(т).
Вследствие окислительных свойств соли меди (I), серебра (I) и золота (I) менее устойчивы, чем соли щелочных металлов. Так, галогениды серебра разлагаются на простые вещества при действии света и при нагревании:
2AgГ = 2Ag + Г2
Соли Cu (I) и Au (I) легко диспропорционируют:
2CuCl = Cu + CuCl2
3AuCl = 2Au + AuCl3
Галогениды меди (I) образуются при восстановлении солей меди (II). Например, CuCl получают при нагревании смеси, содержащей CuCl2, концентрированную хлороводородную кислоту и порошок меди:
CuCl2(в) + Cu + 2HCl(в) = 2H[CuCl2] (в)
При разбавлении водой малоустойчивый комплекс Н[CuCl2] диссоциирует на HCl и CuCl, выпадающий в осадок. Иодид меди (I) выделяется при действии иодида калия на сульфат меди (II):
2CuSO4(в) + 4KI(в) = 2CuI + I2 + 2K2SO4(в).
Галогениды серебра – AgГ – образуются при непосредственном взаимодействии простых веществ или осаждением из раствора нитрата серебра: Ag+ + Г– = AgГ(т). Они светочувствительны, т.е. разлагаются (чернеют) на свету с выделением металлического серебра. На этом свойстве основано их применение в фотографии.
Действием восстановителей (формальдегида, глюкозы и др.) на аммиачные растворы солей серебра можно посеребрить стеклянные предметы (реакция «серебряного зеркала»):

 O
O
O
O

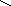 H
– C + 2[Ag(NH3)2]OH
= H – C + 2Ag
+ 4NH3
+ H2O
H
– C + 2[Ag(NH3)2]OH
= H – C + 2Ag
+ 4NH3
+ H2O
H OH
Этим способом изготавливают зеркала, серебрят внутреннюю поверхность в термосах, в сосудах Дьюара – для уменьшения потери теплоты лучеиспусканием. Реакция «серебряного зеркала» – характерная реакция на ион Ag+.
Она используется для подтверждения подлинности фармацевтических препаратов с альдегидной группой в молекуле.
Из солей кислородсодержащих кислот растворимыми в воде являются AgNO3, AgClO4, AgClO3, а Ag2CO3, Ag2CrO4, Ag2S2O3 и др. плохо растворимы.
Хорошо растворимый в воде нитрат серебра получают растворением металлического серебра в азотной кислоте. Бесцветные кристаллы AgNO3 чернеют под влиянием света вследствие выделения металлического серебра. Гидролизу эта соль не подвергается. Нитрат серебра является исходным продуктом для получения других соединений серебра.
Соли двухвалентной меди получают действием кислот на CuO, Cu(OH)2, CuCO3 или Cu2(OH)2CO3. Важнейшими растворимыми в воде солями меди (II) являются CuSO4·5H2O, CuCl2·2H2O, Cu(NO3)2·3H2O. В нейтральных и кислых растворах ионы меди (II) гидратированы и образуют голубые аквакомплексы [Cu(H2O)6]2+, которые довольно прочно удерживают молекулы воды. Окраска твердых солей различна. Например, безводный CuSO4 бесцветен. Он получается при нагревании до температуры 105–120 оС синих кристаллов медного купороса CuSO4·5H2O. Строение пентагидрата сульфата меди представлено схемой:
 O
O–
O
O–
S
O O
H2O OH2
Cu
H2O OH2
H2O O O
S
O O
H2O OH2
Cu
H2O OH2
O O
S
O O–
Четыре молекулы воды в медном купоросе координированы вокруг иона меди (II) в плоскости, два сульфат-иона – по оси, а пятая молекула Н2О выполняет роль мостика, соединяющего водородными связями молекулы воды и SO42– – группу, как показано на схеме.
Катионы меди – сильные комплексообразователи по отношению к лигандам, содержащим карбоксильную (–СОО-), амино (–NH2), циано- (–CN–), тиольную (–SH) группы. За счёт реакции с тиольными группами белков катионы меди инактивируют ферменты и разрушают нативную конформацию белка – на этом основано их антимикробное действие.
Ионы меди (II) образуют комплексные соединения катионного типа (аквакомплексы, аминокомплексы [Cu(NH3)4]2+), анионного (гидроксо- и ацидокомплексы) и нейтрального типа. Например, при взаимодействии CuSO4 с NH3 происходит реакция с образованием темно-синего раствора:
CuSO4(в) + 4NH3(в) = [Cu(NH3)4]SO4(в)
Cu2+(в) + 4NH3(в) = [Cu(NH3)4]2+(в).
Гидроксокомплексы меди (II), содержащие комплексный гидроксокупрат-ион [Cu(OH)4]2- сине-фиолетового цвета, получают при растворении Cu(OH)2 в очень концентрированных растворах щелочей (см. выше). Гидроксокупраты (II) очень нестойки и при разбавлении щелочных растворов водой разлагаются с выделением осадка Cu(OH)2.
Легко разлагаются при разбавлении водой галогенокупрат (II)-ионы и зеленая окраска переходит в голубую:
[CuCl4]2-(в) + 4H2O(ж) ↔ [Cu(H2O)4]2+(в) + 4Cl-(в)
Ионы меди (II) подвергаются гидролизу и формируют кислую реакцию среды:
Cu2+(в) + НОН(ж) ↔ CuОН+(в) + Н+ .
Карбонаты щелочных металлов из растворов солей меди (II) осаждают основной карбонат меди зелено-голубого цвета:
2CuSO4(в) + 2K2CO3(в) + H2O(ж) = Cu2(OH)2CO3(т) + 2K2SO4(в) + CO2(г)
Сульфид меди CuS черного цвета нерастворим в воде и растворе HCl.
Из соединений золота (III) известны Au2O3, Au(OH)3, галогениды – AuCl3, AuBr3, AuF3. Они проявляют амфотерные свойства, с преобладанием кислотных.
Трихлорид золота – AuCl3 получают действием хлора на золото. При растворении трихлорида золота в воде образуется гидроксотрихлорзолотая (III) кислота:
AuCl3(в) + H2O(ж) = H[Au(OH)Cl3] (в).
При добавлении к AuCl3 соляной кислоты образуется H[AuCl4]. Ее соли – галогенаураты (III) – хорошо растворимы в воде и органических растворителях. AuCl3 и H[AuCl4]ּ4H2O используют для получения других соединений золота.
Окислительные свойства Au (III) выражены сильнее, чем у Ag (I) и Cu (II):
H[AuCl4](в) + 3FeSO4(в) = Au(т) + Fe2(SO4)3(в) + FeCl3(в) + HCl(в)
Соли тяжелых металлов (меди, серебра, золота и др.) токсичны, так как образуют с белками нерастворимые соли, вызывая денатурацию белков. Однако медь является необходимым микроэлементом растительных и животных организмов и содержится в них в небольших количествах – около 100 мг . Она входит в состав белков: гемокупреина, церулоплазмина, купрпротеина, ряда ферментов и концентрируется преимущественно в печени, головном мозге, в крови. Средняя дневная доза потребления меди для человека 4–5 мг. Соединения меди необходимы для синтеза гемоглобина и фосфолипидов. Например, медьсодержащий белок плазмы крови – церулоплазмин (98 % меди, содержащейся в плазме крови) выполняет в организме многопрофильную функцию, выполняя роль не только резервуара для меди, но и транспортную функцию, регулирующую баланс меди в организме. Недостаток меди ведет к развитию анемии (разрушению эритроцитов), нарушению остеогенеза, нарушается нормальное развитие соединительных тканей и кровеносных сосудов, а избыток может повлечь перерождение печени.
Важную физиологическую роль выполняет фермент супероксиддисмутаза, ускоряющий реакцию разложения супероксид-иона – О2-, возникающего в клетках вследствие свободнорадикального окисления веществ.
Не менее важную роль выполняет фермент цитохромоксидаза в дыхательной цепи.
У моллюсков и членистоногих кислород переносится медьсодержащим белком гемоцианином, находящимся только в плазме, а процесс связывания и освобождения кислорода происходит за счёт окисления и восстановления ионов меди (Сu+, Cu2+) в гемоцианине, что объясняет голубой цвет крови у этих организмов.
Сульфат меди CuSO4 ·5H2O применяется в качестве антисептического, вяжущего, прижигающего средства для наружного применения в глазной и урологической практике. При приеме внутрь оказывает рвотное действие. В малых дозах соли меди входят в состав препаратов, улучшающих кроветворение.
В организме взрослого человека обнаруживается около 1 мг серебра. Ионы серебра бактерицидны. Они убивают грамположительные и грамотрицательные микроорганизмы, а также вирусы, инактивируя их ферментативные центры. Бактерицидные свойства серебра использовали еще в Древнем Египте: для лечения ран накладывали на их поверхность металлические серебряные пластины. В настоящее время применяется «серебряная вода», «серебряная марля», нитрат серебра, который обладает антисептическим и прижигающим действием. Последнее обусловлено способностью AgNO3 свертывать белки, превращая их в нерастворимые соединения при прижигании ран и язв. Для этих целей в медицине применяют нитрат серебра в виде палочек (Stilus Argenti nitrici). В небольших концентрациях раствор нитрата серебра оказывает вяжущее и противовоспалительное действие. В медицине используют коллоидные препараты серебра (колларгол – 70 % Ag, протаргол – 8 % Ag и др.), где мелкодисперсное металлическое серебро связано с белком и лишь частично ионизировано. В них сохраняются дезинфицирующие свойства серебра, но пропадает прижигающее действие. Токсическое действие соединений серебра, как и в случае меди, обусловлено тем, что ионы серебра взаимодействуют с тиольными серо- и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ. При этом образуются биокластеры хелатного типа, вследствие чего белки становятся нерастворимыми, теряют ферментативную активность.
В организме взрослого человека обнаруживается до 10 мг золота. Препараты золота применяют также в качестве эффективных противовоспалительных средств. Золото, как благородный металл, устойчивый к окислению в различных средах, используют в стоматологии для изготовления зубных протезов. Некоторые соедиения золота являются фармпрепаратами.
Все растворимые соединения меди, серебра и золота токсичны, особенно соединения меди.
