
Антибиотики — Венгеровский
.pdf
близки по фармакологическим свойствам к метронидазолу. БЕНЗ- Н И Д А З О Л (РОХАГАН) избирательно нарушает жизнедеятельность трипаносом при болезни Шагаса.
Метронидазол подавляет большое число видов анаэробных про стейших и бактерий. В анаэробных условиях токсическое действие на чувствительные штаммы трихомонад развивается от концент рации < 0,05 мкг/мл, в присутствии 1% кислорода МПК возраста ет. Препарат активен против дизентерийной амебы, трофозоитов лямблий (1-50 мкг/мл), анаэробных кокков, грамотрицательных бактерий (включая бактероиды), спорообразующих грамположи тельных бацилл. К метронидазолу резистентны аэробные и факуль тативно-аэробные бактерии, а также грамположительные бацил лы, не образующие спор.
Для метронидазола характерен широкий профиль фармаколо гической активности. Он угнетает клеточный иммунитет, в экспе рименте вызывает мутации и канцерогенез, повышает чувствитель ность к радиации клеток, находящихся в состоянии гипоксии.
Метронидазол является пролекарством и подвергается метабо лической активации. Его нитрогруппа получает электроны из элек трон-транспортной системы, имеющей низкий отрицательный ре- докс-потенциал. В клетках простейших и анаэробных бактерий транспорт электронов осуществляет ферредоксин, локализованный в уникальных органоидах - гидрогеносомах. В реакции восстанов ления нитрогруппы метронидазола образуются реактивные интермедиаты - нитрорадикалы. Они повреждают ДНК, белки и мембра ны. У млекопитающих электрон-транспортная система, представ ленная флавопротеином, характеризуется высоким редокс-потен- циалом.
Резистентность микроорганизмов к действию метронидазола развивается как по анаэробному, так и по аэробному механизму. Анаэробный механизм резистентности культивируемых трихомо над обусловлен инактивацией ферредоксина. В организме челове ка резистентность трихомонад вызвана их переходом на аэробный тип метаболизма. У таких простейших снижается содержание фер редоксина, что нарушает восстановление нитрогруппы метронида зола.
Метронидазол полностью и быстро всасывается из кишечника, созда вая в крови максимальную концентрацию 10 мкг/мл через 1 ч после при
ема в дозе 500 мг (эффективная подавляющая концентрация - 8 мкг/мл или меньше). Бактерии кишечника восстанавливают небольшое количе ство метронидазола, вызывая разрыв кольца имидазола. Повторный при ем с интервалами 6-8 ч приводит к кумуляции. Объем распределения мет ронидазола - почти вся водная среда организма. Связь с белками - 10%. Метронидазол проникает в секрет влагалища, семенную жидкость, слю ну, грудное молоко, через плацентарный барьер. Терапевтическая кон центрация метронидазола определяется в спинномозговой жидкости.
Метаболический клиренс составляет половину от общего клиренса метронидазола. В печени происходит окисление его боковой цепи с обра зованием неактивного и активного метаболитов, которые затем связыва ются с глюкуроновой кислотой. Неизмененный метронидазол и его мета болиты выводятся с мочой (60-80%) и желчью (6-15%). Один из метабо литов окрашивает мочу в красновато-бурый цвет. Период полуэлимина ции метронидазола - около 8 ч. Окисление метронидазола ускоряют ин дукторы метаболизма ксенобиотиков - фенобарбитал, дифенин, преднизолон и рифампицин. Напротив, циметидин ингибирует окисление. Сведе ния о фармакокинетике производных нитроимидазола приведены в табл. 12.2.
Таблица 12.2
Фармакокинетика противопротозойных средств - производных нитроимидазола
|
|
Время создания |
Связь с |
Актив |
Период |
|
|
Биодоступ |
максимальной |
полуэли |
|||
Препарат |
белками |
ные метабо |
||||
ность, % |
концентрации в |
минации, |
||||
|
|
крови,ч |
крови,% |
литы |
ч |
|
|
|
|
|
|||
|
|
|
|
|
|
|
Метро |
100 |
1 |
10 |
+ |
|
|
нидазол |
|
|
|
|
|
|
Нимора- |
90 |
2 |
10 |
+ |
13 |
|
зол |
|
|
|
|
|
|
Орнида- |
90 |
3 |
15 |
+ |
20 |
|
зол |
|
|
|
|
|
|
Секнида- |
80 |
4 |
10 |
+ |
10-14 |
|
зол |
|
|
|
|
|
|
Тинида- |
90 |
2 |
10 |
+ |
15 |
|
зол |
|
|
|
|
|
|
|
|
|
|
|
|
Метронидазол проявляет высокую терапевтическую эффектив ность при трихомониазе половой системы у мужчин и женщин. Обычно принимают внутрь однократно дозу 2 г. Если больной пло хо переносит метронидазол в большой дозе, прибегают к альтерна тивной схеме лечения - по 250 мг 3 раза в сутки в течение 7 дней. Местно используют 0,75% гель и вагинальные суппозитории, со держащие 500 или 1000 мг метронидазола. Повторный курс тера-
пии рецидивирующего трихомониаза проводят спустя 4-6 нед. Мет ронидазол назначают также сексуальному партнеру больного. До начала приема метронидазола, во время лечения и после его окон чания подсчитывают количество лейкоцитов крови.
Метронидазол оценивают как препарат выбора при амебиазе. Больные принимают внутрь 600-800 мг 3 раза в сутки на протяже нии 5-10 дней. Суточная доза метронидазола для детей составляет 35-50 мг/кг. Быстрое всасывание метронидазола снижает его эф фективность при амебиазе с локализацией паразитов в просвете кишечника. Лучшие результаты терапии достигаются при лока лизации амеб в стенке кишечника и других внутренних органах. В эндемичных очагах амебиаза рекомендуют проводить массовое лечение метронидазолом 1 раз в месяц, повторяя его в течение нескольких месяцев.
При лямблиозе метронидазол назначают внутрь: взрослым - по 250 мг, детям - по 5 мг/кг 3 раза в сутки в течение 5 дней. Взрос лым больным можно рекомендовать трехдневный прием препара та в суточной дозе 2 г.
Метронидазол вводят в вену при тяжелых бактериальных ин фекциях, вызванных бактероидами, клостридиями, фузобактериями, пептококками, пептострептококками и видами Helicobacter, в том числе для профилактики послеоперационных инфекций живота и таза, лечения эндокардита, пневмонии, менингита, абс цесса головного мозга. Вначале препарат вливают в вену в удар ной дозе 15 мг/кг, затем на протяжении 7-10 дней вводят поддер живающую дозу 7,5 мг/кг каждые 6 ч.
Метронидазол назначают внутрь для эрадикации Helicobacter pylori при язвенной болезни, а также лечения псевдомембранозного колита вместо дорогого антибиотика - ванкомицина.
Метронидазол редко вызывает побочные эффекты, требующие прекращения терапии. Иногда при его приеме возникают голов ная боль, сухость и металлический вкус во рту, тошнота, рвота, боль в животе, диарея. Возможно развитие кандидамикоза полос ти рта (глоссит, стоматит), крапивницы, гиперемии лица, кожно го зуда, цистита с нарушением мочеиспускания, обратимой лейко пении. Больные ощущают давление в полости таза. Очень редко наблюдаются слабость, головокружение, энцефалопатия, судоро ги, шаткая походка и другие расстройства координации движе ний, онемение рук и ног, парестезия. При появлении нейротоксических осложнений терапию метронидазолом прекращают. Восста новление функций после нейропатии медленное и неполное.
Метронидазол подобно тетураму (дисульфирам) ингибирует альдегиддегидрогеназу. После употребления алкогольных напитков на фоне приема метронидазола накапливается токсический уксус ный альдегид. Он вызывает дискомфорт в животе, рвоту, гипере мию, головную боль. Пациентам, получающим метронидазол, ре комендуется воздерживаться от употребления алкоголя.
В эксперименте установлены канцерогенные, мутагенные и те ратогенные свойства метронидазола и его метаболитов. В клинике они не регистрируются.
Метронидазол противопоказан при гиперчувствительности к производным нитроимидазола, заболеваниях нервной системы, в I триместре беременности, детям. На время лечения прекращают грудное вскармливание. Дозу метронидазола снижают при назна чении больным обструктивными заболеваниями желчных путей, алкогольным циррозом печени, почечной недостаточностью.
АМИНИТРОЗОЛ показан при трихомониазе, лямблиозе, раневых ин фекциях и трофических язвах кожи. Назначают внутрь 100 мг 3 раза в сутки в течение 7-15 дней. При трихомониазе с лечебной и профилакти ческой целями дополнительно используют вагинальные суппозитории. Суспензию и аэрозоль аминитрозола наносят на пораженную кожу 1 раз в сутки.
НИМОРАЗОЛ отличается длительным действием. После приема внутрь в дозе 1,5 г концентрация ниморазола в крови превышает минимальную трихомонацидную концентрацию (0,3-3 мкг/мл) в 5 раз через 3 ч, в 9 раз через 25 ч. Спустя 12 ч после последнего приема концентрация нимо разола выше МПК в 2,5 раза. При трихомониазе принимают внутрь 2 г
однократно или 500 мг 2 раза в сутки на протяжении 6 дней. ОРНИДАЗОЛ назначают внутрь при трихомониазе (взрослым с мас
сой тела больше 60 кг - 500 мг утром и вечером в течение 5 дней, детям - 25 мг/кг однократно), амебной дизентерии и лямблиозе (взрослым - 1,5 г утром и вечером, детям - 40 мг/кг однократно). Курс лечения амебиаза - 3 дня, лямблиоза - 1-2 дня. Орнидазол не ингибирует альдегиддегидрогеназу, поэтому совместим с приемом алкоголя.
СЕКНИДАЗОЛ принимают однократно внутрь: при трихомониазе, амебной дизентерии и лямблиозе доза для взрослых составляет 2 г, для детей - 30 мг/кг (при амебном поражении печени взрослым назначают суточную дозу 1-3 г, детям - 30 мг/кг на протяжении 5 дней).
ТИНИДАЗОЛ дополнительно подавляет лейшмании. Взрослые боль ные трихомониазом и лямблиозом принимают внутрь 2 г однократно во
время или после еды. При амебиазе назначают взрослым 2 г 1 раз в сутки в течение 2-3 дней, детям - 50-60 мг/кг 1 раз в сутки 3 дня.
П е н т а м и д и н
Открытие противопротозойного эффекта производных диамидина про изошло случайно, в процессе поиска новых сахаропонижающих средств. Для медицинской практики были предложены стильбамидин, пентами дин и промамидин. В настоящее время применяется стабильный и мало токсичный ПЕНТАМИДИНА ИЗЕТИОНАТ (препарат для инъекций - ПЕНТАМ 300, аэрозоль - НЕБУПЕНТ). 1,74 мг пентамидина изетионата содержит 1 мг основания пентамидина. Раствор используют сразу же пос ле приготовления.
Пентамидин подавляет многие виды простейших. Его применяют для лечения висцерального лейшманиоза, пневмоцистоза, в комбинации с сурамином вводят в вену на ранней стадии западноафриканского трипа носомоза, вызванного Trypanosoma brucei gambiense (сонная болезнь).
ДИМИНАЗЕН (БЕРЕНИЛ) является препаратом ветеринарной прак тики, но используется в ряде эндемичных ареалов Африки для терапии трипаносомоза человека.
Ароматические диамидины оказывают протистоцидное влияние на
Trypanosoma brucei, Babesia canis, Leishmania donovani, неделящиеся клетки Pneumocystis carinii. Неэффективны против Т. cruzi. Препараты обладают противогрибковой активностью в отношении Blastomyces dermatitidis. Пентамидин успешно применялся для лечения системного бластомикоза, но в настоящее время уступил место амфотерицину В.
Производные диамидина поступают в чувствительные клетки Т. brucei при участии энергозависимой высокоаффинной системы переноса пури нов (транспортер Р-2). В результате уменьшается использование аденина, аденозина и других пуринов. Диамидины также нарушают обмен поли аминов - путресцина и спермидина, необходимых для деления и созрева ния африканских трипаносом. Препараты обратимо ингибируют S-адено- зил-Ь-метиониндекарбоксилазу - фермент, катализирующий превращение 8-аденозил-£-метионина в S-метиладенозилгомосцистеамин. При дефиците гомоцистеамина нарушается присоединение к путресцину аминопропильного радикала, что тормозит продукцию спермидина (рис. 12.1).
Пентамидин как ингибитор топоизомеразы II переводит в линейное состояние ДНК трипаносом, прямо связывается с их ДНК. У Pneumocystis carinii пентамидин ингибирует топоизомеразу, по неустановленному ме ханизму нарушает обмен глюкозы.
Пентамидин накапливается в печени, селезенке, надпочечниках, поч ках, создает терапевтическую концентрацию в легких, проникает через плаценту, почти не поступает в головной мозг. Содержание пентамидина в легких при пневмоцистозе можно повышать, используя ингаляцион-
сн2— сн2— сн - сн - соон |
||
NH, |
I |
|
Орнитим NH, |
||
|
||
Орнитиндекарбоксилаэа
Аденин
I
Рибоза
Н3С — S — СН - СН2 - СН - СООН
NHj
S-Адеиозил- L-метионин S-Аденозил -
метионинде • карбоксила»
ЭФЛОРНИТИН со |
|
|
|
|
\ |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
ПЕНТАМИДИН |
|
|
СН,—СН,—СН,—СН, |
|
Аденин |
|
|
||
|
NH, |
|
NHj |
|
Рибоза |
|
|
|
Путрвсцин |
|
НС - STСН — СН,— СН |
||||
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
S-Метладвноаил- |
|
|
|
|
|
|
|
Г О М О Ц И С 1 И С И 1 И Н |
|
|
|
|
|
Пролиламин |
J |
5'. метал- |
||
|
Спермидин- |
|
|||||
|
сиктетаэа |
|
' |
|
|
пюедэнозин |
|
|
|
|
CHj-CHj— СН — |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
NH. |
|
Глутатион-SH |
||
|
|
СН,—СН,—СН.-СН |
|||||
|
|
|
|
|
|||
|
|
I 2 2 |
' I |
|
|
|
|
СН2— C H j - СН2— NH |
NH, |
|
|
|
|||
NH, |
Спермидин |
|
|
|
|
||
МЕЛАРСОПРОЛ • Трипанотион-SH
Трипанотион
редуктаза
Окисленный
трипанотион
Рис. 12.1. Противопротозойные средства, нарушающие метабо лизм полиаминов у трипаносом
ный путь введения (препарат плохо всасывается из легких в кровь). Пен тамидин выводится с мочой в неизмененном виде. После однократного вливания в вену больным СПИДом его период полуэлиминации составля ет около 6 ч. При повторном введении пентамидин кумулирует, период полуэлиминации возрастает до 12 ч, следы препарата определяются через 6 нед после окончания терапии.
Пентамидин в однократной суточной дозе 4 мг/кг основания вводят в
мышцы или медленно в вену. В гемолимфатической стадии африканского трипаносомоза, вызванного Т. brucei gambiense, показаны внутримышеч ные инъекции пентамидина на 1, 3, 5, 7, 13 и 17-й дни, сурамин вливают в вену (20 мг/кг, максимально - 1 г) в 1-й и 13-й дни. Допустимо вводить
один пентамидин в мышцы через день. Пентамидин плохо проникает че рез гематоэнцефалический барьер, поэтому его нерационально применять при заражении Т. brucei rhodesiense, которая поражает головной мозг уже на ранней стадии заболевания. По этой же причине пентамидин не назна чают для лечения поздних стадий африканского трипаносомоза с пораже нием центральной нервной системы.
При висцеральном лейшманиозе (кала-азар), вызванном Leishmania donovani, пентамидин вводят в мышцы в дозе 2-4 мг/кг в течение 12-15 дней. В регионах, где распространены резистентные штаммы лейшманий, необходим повторный курс через 1-2 нед. В Судане и Китае пентамидину отдается предпочтение, так как альтернативные средства - соединения сурьмы вызывают артериальную гипертензию у аборигенов. Пентамидин эффективен и при кожном лейшманиозе (заражение L. tropica), хотя тра диционно для этой цели не используется.
Пентамидин применяют для профилактики и лечения пневмонии, вызванной Pneumocystis carinii. Это одна из наиболее частых оппортуни стических инфекций у больных СПИДом с количеством лимфоцитов CD4* меньше 200 в 1 мм'. Профилактически препарат назначают инфляцион но в форме аэрозоля с помощью небулайзера. Месячная доза - 300 мг. Больные СПИДом с количеством лимфоцитов CD4* от 100 до 200 в 1 мм' переносят пентамидин лучше, чем ко-тримоксазол. При еще более низ ком содержании лимфоцитов предпочитают ко-тримоксазол.
Для лечения пневмоцистоза пентамидин назначают как средство вто рого ряда при плохой переносимости ко-тримоксазола. Пентамидин вво дят в мышцы или вену в дозе 4 мг/кг 1 раз в сутки на протяжении 14 дней. Дозы 2-3 мг/кг также эффективны, но вызывают меньше побочных эффектов. Клиническое улучшение наступает через 4-6 дней после пер вой инъекции. Труднее излечить ослабленных пациентов с пониженным противоопухолевым и противовирусным иммунитетом.
В дозе 4 мг/кг пентамидин вызывает нежелательные эффекты у 50% больных. При его быстрой инфузии в вену возможны возбуждение, голо вокружение, головная боль, рвота, тахикардия, обморок, остановка ды хания. Возникает ортостатическая гипотензия вследствие освобождения гистамина. Для профилактики коллапса больные после инъекции долж ны несколько часов лежать. Медленное вливание в вену или введение в
мышцы переносится лучше. В местах внутримышечных инъекций могут образовываться стерильные абсцессы.
Опасность для жизни представляет вызываемая пентамидином гипог ликемия. Она обусловлена стимуляцией Р-клеток островков поджелудоч ной железы. У больных инсулинзависимым сахарным диабетом парадок сально развивается гипергликемия. Другие побочные эффекты пентами дина - кожная сыпь, тромбофлебит, тромбоцитопения, лейкопения, ане мия, гиперкалиемия, гипокальциемия, повышение активности печеноч ных ферментов в крови, нефротоксичность. У 24% больных обратимо на
рушаются функции почек вследствие ингибирования дигидрофолатредуктазы нефроцитов.
Пентамидин с осторожностью назначают на фоне гипогликемии, са харного диабета, при колебаниях артериального давления, тромбоцитопении, заболеваниях печени и почек, ослабленным пациентам.
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ АМЕБИАЗА
Д и л о к с а н и д а фуроат
Производное дихлорацетамида дилоксанид применяется для лечения амебиаза с конца 1950-х годов. Эфир ДИЛОКСАНИДА ФУРОАТ (ФУРАМИД) в большей степени подавляет патогенные амебы, чем дилоксанид. Минимальная амебицидная концентрация - 0,01-0,1 мкг/мл.
После приема внутрь эфир почти полностью гидролизуется в просвете и слизистой оболочке кишечника с образованием дилоксанида и фуроевой кислоты. В системный кровоток поступает только дилоксанид. Пик его концентрации в крови достигается через 1 ч. 60-90% дозы выводится в виде глюкуронидов с мочой, 4-9% удаляется с калом. Период полуэли минации - 6 ч.
Дилоксанида фуроат назначают для монотерапии носителям цист при бессимптомном течении амебиаза. Такой же амебицидной активностью обладают йодохинол и паромомицин. При амебной дизентерии и пораже нии внутренних органов лечение одним дилоксанидом неэффективно. Больным амебной дизентерией проводят терапию комбинацией дилокса нида фуроата с метронидазолом или паромомицином. Для лечения сис темного амебиаза показан совместный прием дилоксанида фуроата с мет ронидазолом или хлорохином.
Дилоксанида фуроат принимают внутрь в дозе 500 мг 3 раза в сутки на протяжении 10 дней. При необходимости продолжительность лечения увеличивают до 20 дней. Детям назначают 20 мг/кг в сутки в течение 10 дней.
Дилоксанида фуроат хорошо переносится. Изредка он вызывает рво ту, кожный зуд и крапивницу.
Производные 8-оксихинолина
Препараты этой группы ЙОДОХИНОЛ (ДИЙОДОГИДРОКСИХИН, ЙОДОКСИН, МЕБЕКСИН) и КЛИОХИНОЛ (ЙОДОХЛОРОГИДРОКСИХИН) широко применяли для купирования амебной диареи. В последние годы установлено, что длительный прием галогенпроизводных 8-оксихи нолина в дозах, превышающих 2 г, может сопровождаться развитием тя желых побочных эффектов. Наиболее токсичен клиохинол, вызывающий подострую миелооптическую нейропатию. Данное осложнение протекает
по типу миелита. Впервые оно было описано как инфекционная патоло гия в Японии. Сейчас известны только спорадические случаи.
Йодохинол может вызывать атрофию зрительного нерва с потерей зре ния, диспепсические расстройства, дисфункцию щитовидной железы. Большинство больных амебиазом успешно излечиваются с помощью ди локсанида фуроата, не прибегая к приему йодохинола.
Йодохинол противопоказан при непереносимости йода, заболеваниях щитовидной железы, печени, почек, детям. До и во время курса терапии необходимы периодические консультации офтальмолога.
Х л о р о х ин
Хлорохин является основным средством лечения малярии. Этот пре парат применяют также при системном амебиазе, если отсутствует тера певтический эффект метронидазола или больные не переносят производ ные нитроимидазола. Хлорохин создает высокую концентрацию в пече ни, поэтому наиболее эффективен в отношении трофозоитов Entamoeba histolytica, поражающих печень. Состояние больных улучшается быстро, резистентность амеб не развивается.
Хлорохин оказывает слабое лечебное действие при локализации амеб в тонком кишечнике. Это обусловлено быстрым всасыванием препарата в кровь. Известно, что амебное поражение толстого кишечника часто ста новится причиной системного амебиаза, поэтому хлорохин назначают при кишечном амебиазе с профилактической целью.
Взрослые больные системным амебиазом принимают внутрь хлорохи на фосфат в суточной дозе 1 г в течение 2 дней, затем переходят на ежед невный прием 500 мг на протяжении 2-3 нед. Возможны увеличение дозы и повторение курса терапии.
Э м е т и н и д е г и д р о э м е т и н
В начале XX в. было установлено, что алкалоид корня ипекакуаны эметин оказывает системное амебицидное действие. Дегидроэметин (мебадин) обладает такой же эффективностью, но менее токсичен. У трофо зоитов Entamoeba histolytica препараты необратимо блокируют синтез белка, нарушая движение рибосом вдоль матричной РНК.
Эметин и дегидроэметин длительное время применяли для терапии кишечной и системной форм амебиаза. В современной медицине их пол ностью вытеснили метронидазол и дилоксанида фуроат.
При введении под кожу и в мышцы в течение 10 дней и продолжи тельнее алкалоиды ипекакуаны могут вызывать тяжелые побочные эф фекты. Возникают боль, мышечная слабость и стерильные абсцессы в месте инъекции, тошнота и рвота центрального происхождения, обостряется диарея, появляются тахикардия, аритмия, застойная сердечная недоста точность, артериальная гипотензия. Механизм кардиологических ослож
нений связан с блокадой адрено- и холинорецепторов. Описаны случаи генерализованной мышечной слабости, тремора, пареза конечностей.
Противопротозойные антибиотики
Противопротозойной активностью обладают многие антибиотики. Для лечения кишечного амебиаза применяют паромомицин, тетрациклины и эритромицин. Паромомицин является средством с прямым амебицидным эффектом. Другие антибиотики, воздействуя на кишечную микрофлору, тормозят размножение патогенных амеб. Тетрациклин плохо всасывается в кровь и нарушает деление амеб, находящихся в кишечнике.
Антибиотик-аминогликозид широкого спектра действия паромомицин получают из культуры почвенной бактерии Streptomyces rimosus. Он про являет протистоцидиые и бактерицидные свойства, в кишечнике подав ляет как нормальную, так и патогенную микрофлору. Паромомицин при меняют для лечения амебиаза, висцерального лейшманиоза, тениаринхоза и тениоза. Получены первые клинические данные об эффективности паромомицина при криптоспоридиозе у больных СПИДом.
ПАРОМОМИЦИНА СУЛЬФАТ (ГУМАТИН, МОНОМИЦИН) при ки шечном амебиазе назначают внутрь в суточной дозе 25-35 мг/кг, разде ленной на 3 приема. Длительность курса терапии - 7 дней. Реже антиби отик используют в дозе 66 мг/кг. Паромомицин плохо всасывается в кровь. Побочные эффекты - боль в животе, диарея.
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ЛЕЙШМАНИОЗА
Натрия стибоглюконат
Соединения сурьмы с давних времен применяют для лечения лейшма ниоза и других протозойных инвазий. Первым соединением трехвалент ной сурьмы для лечения кожной и висцеральной форм лейшманиоза был антимоний-калий тартрат (тартар рвотный). Он обладает высокой токсич ностью и неудобен для приема. В настоящее время используют препараты пятивалентной сурьмы - производные фенилстибоновой кислоты. Такое строение имеют НАТРИЯ СТИБОГЛЮКОНАТ (ПЕНТОСТАМ) и МЕГЛЮМИН АНТИМОНИАТ (ГЛЮКАНТИН). Натрия стибоглюконат содержит 30-34% пятивалентной сурьмы.
Натрия стибоглюконат нарушает биоэнергетику безжгутиковой фор мы лейшманий, подавляя гликолиз и р-окисление жирных кислот. Воз никает дефицит АТФ и ГТФ. Кроме того, сурьма связывается с тиоловыми группами белков. Неизвестно, требуется ли для уничтожения лейш маний Восстановление пятивалентной сурьмы в трехвалентную.
Соединения пятивалентной сурьмы создают в клетках более высокую концентрацию, чем препараты трехвалентной сурьмы. Однократная доза натрия стибоглюконата выводится с мочой в течение 24 ч. Элиминация препарата двухфазная: период полуэлиминации в первой фазе - 2 ч, во
второй фазе - 33-76 ч. Пятивалентная сурьма в процессе выведения из организма частично восстанавливается в трехвалентную.
Для лечения лейшманиоза взрослым и детям вводят в вену и мышцы натрия стибоглюконат в дозе 20 мг/кг пятивалентной сурьмы в течение 20-30 дней. В случае появления токсических реакций у ослабленных боль ных 1-2 инъекции можно пропустить.
Неудачи лечения кожно-слизистого, висцерального и реже - кожного лейшманиоза в эндемичных очагах обусловлены реинвазией, особеннос тями фармакокинетики препаратов сурьмы у аборигенов и резистентнос тью лейшманий. Механизм резистентности - нарушение транспорта со единений сурьмы в цитоплазму простейших.
Висцеральный лейшманиоз (кала-азар) в странах Восточной Африки, вызванный резистентными штаммами L. donovani, лечат с помощью пен тамидина или комбинации натрия стибоглюконата и антибиотика парамомицина. При кожно-слизистом лейшманиозе как альтернативное сред ство назначают амфотерицин В.
Натрия стибоглюконат хорошо переносится большинством больных. Иногда появляется боль в месте внутримышечной инъекции. Возникают расстройства пищеварения, миалгия, тугоподвижность суставов, в крови повышается активность печеночных аминотрансфераз. На ЭКГ регистри руются обратимые уплощение зубца Т и удлинение или инверсия интер вала Q Т. Эти нарушения могут приводить к аритмии. При висцеральном лейшманиозе трудно дифференцировать, являются ли отклонения на ЭКГ симптомом болезни или результатом токсического действия натрия сти боглюконата. При быстром внутривенном введении препарата известны случаи шока и внезапной смерти.
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ПНЕВМОЦИСТОЗА
Атовахон
Вначале 1980-х годов было открыто, что синтетическое производное оксинафтохинона АТОВАХОН (МЕПРОН) оказывает протистоцидное вли яние на плазмодии малярии, Pneumocystis carinii, тахизоиты и цисты Toxoplasma gondii. С 1992 г. атовахон разрешен в США для лечения пнев монии, вызванной P. carinii, у больных, которые не переносят ко-тримок сазол. Возможность применения атовахона при токсоплазмозе изучается
вэксперименте.
Атовахон - вещество с высокой липофильностью, структурный аналог убихинона. Его МПК в отношении P. carinii варьирует от 0,1 до 3 мкг/мл в зависимости от чувствительности штаммов. Атовахон по конкурентно му принципу вытесняет убихинон из дыхательной цепи митохондрий про стейших. Он нарушает транспорт электронов и синтез пиримидиновых оснований. У плазмодия малярии атовахон связывается с цитохромом Ьс1 (комплекс III).
Биодоступность атовахона при приеме внутрь низкая из-за плохой растворимости в воде. Жирная пища увеличивает его всасывание втрое. Максимум концентрации атовахона в крови двухфазный: первый пик раз вивается спустя 1-8 ч, второй пик - через 1-4 дня. Атовахон подвергается энтерогепатической циркуляции. Связь с белками крови - 99%. Концент рация в головном мозге составляет 1% от концентрации в крови. 94% дозы выводится в неизмененном виде с калом, в моче определяются толь ко следы препарата. Период полуэлиминации - 2-3 дня.
Атовахон рассматривают как альтернативный препарат для терапии пневмоцистоза с легким течением или умеренной тяжестью симптомов. Он показан пациентам, которые могут принимать лекарственные сред ства внутрь, но не переносят ко-тримоксазол или внутривенные инъек ции пентамидина изетионата. Доза для взрослых - 750 мг 3 раза в сутки в течение 21 дня. Необходимо, чтобы в крови создавалась концентрация не менее 10 мкг/мл. Дети принимают 40 мг/кг. Атовахон не назначают боль ным тяжелой формой пневмоцистоза и для профилактики этой инвазии.
Токсичность атовахона зависит от состояния иммунной системы боль ных. На фоне СПИДа и других иммунодефицитных состояний возникают серьезные побочные эффекты. Их трудно отличать от проявлений основ ного заболевания. При нормальной функции систем иммунитета атова хон переносится хорошо. Иногда он вызывает гипертермию, рвоту, диа рею, головную боль, повышает активность аминотрансфераз и амилазы в крови. Диспепсические расстройства обусловлены раздражением кишеч ника. У 20% больных появляется макулопапулезная сыпь на коже. Пре парат не оказывает канцерогенное, мутагенное и тератогенное действие.
Атовахон противопоказан при гиперчувствительности. Его с острожностью применяют в детском и пожилом возрасте, во время беременности и грудного вскармливания. Инактивация атовахона ускоряется под влия нием индукторов метаболизма ксенобиотиков (рифампицин, фенобарби тал). При патологии печени атовахон изменяет печеночный метаболизм и выделение в желчь других лекарственных средств.
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ТРИПАНОСОМОЗА
С у р а м и н
Сурамин был предложен для лечения африканского трипаносомоза в 1920 г. в Германии. Основанием для создания этого препарата стало ис следование Пауля Эрлиха о трипаноцидной активности красителей - трипанового красного, трипанового синего, афридола фиолетового. Сурамин имеет сложную полианионную структуру с шестью отрицательно заря женными сульфанильными группами. В медицинской практике приме няют свежеприготовленные растворы препарата СУРАМИН-НАТРИЙ (АНТРИПОЛ, БАЙЕР 200, ГЕРМАИНИН).
Протистоцидное действие сурамина на Т. brucei начинается постепен - но, так как препарат медленно проникает в клетки паразитов при учас тии специфического транспортного комплекса. Сурамин ингибирует мно гие ферменты трипаносом, повреждает мембраны клеточных органоидов, аналогичных лизосомам млекопитающих.
Как известно» африканские трипаносомы продуцируют энергию в ре акциях гликолиза. При окислении одной молекулы глюкозы образуются только 2 молекулы АТФ, пируват выделяется в кровь хозяина. Чтобы обеспечить энергетическую потребность (трипаносомы делятся каждые 7 ч), гликолиз протекает в 50 раз интенсивнее, чем в клетках млекопитаю щих. Трипаносомы экстрагируют глюкозу из крови, их гликолитические ферменты сосредоточены в специфических органоидах - гликосомах. Для реокисления НАД Н в НАД продукт гликолиза глицерол-3-фосфат прони кает в единственную митохондрию трипаносом, где при участии глицеролфосфатоксидазы превращается в свой предшественник - диоксиацетонфосфат. Сурамин снижает активность глицеролфосфатоксидазы, что сопровождается нарушением биоэнергетики. Степень ингибирования гли церолфосфатоксидазы коррелирует с трипаноцидным действием.
Сурамин вводят в вену. При инъекциях под кожу и в мышцы он вы зывает местное воспаление и некроз. Объем распределения составляет около 40 л. Как высокополярное вещество, сурамин не проникает в клетки. Связь с белками крови - 99,7%, прочная. 80% дозы выводится почками в неиз мененном виде. Концентрация сурамина в крови быстро уменьшается в течение первых нескольких часов после инъекции, затем концентрация снижается на протяжении нескольких дней. Начальный период полуэли минации - 48 ч, конечный период полуэлиминации длится около 50 дней.
Сурамин в комбинации с пентамидином применяют при африканском трипаносомозе. Препарат не проникает в центральную нервную систему, поэтому показан на начальных стадиях западноафриканского трипаносо моза, вызванного Т. brucei gambiense. Для восточноафриканского трипа носомоза, вызванного 7". brucei rhodesiense, типично раннее поражение головного мозга. В любом случае перед началом лечения сурамином необ ходим паразитологический анализ спинномозговой жидкости.
Сурамин вливают в вену в 10% растворе через 24 ч после пункции спинномозгового канала. Взрослым пациентам вводят 1 г, детям - 20 мг/кг на 1, 3, 7, 14 и 21-й дни заболевания.
Для химиопрофилактики африканского трипаносомоза сурамин вли вают в вену в дозе 1 г 1 раз в неделю на протяжении 5-6 нед. Химиопрофилактику из-за высокой токсичности сурамина не рекомендуют прово дить путешественникам, которые приезжают в эндемичный район на корот кий срок.
Сурамин вызывает побочные эффекты различной интенсивности. Он особенно токсичен для ослабленных больных. Часто возникают тошнота, слабость, гипертермия, кожная эритема, головная боль, металлический
вкус во рту, парестезия, периферическая нейропатия. Эти нарушения проходят после окончания лечения. Редкие осложнения - рвота, диарея, стоматит, озноб, боль в животе, альбуминурия, отеки. У 0,1-0,3% паци ентов развиваются шок и потеря сознания. При терапии сурамином афри канского трипаносомоза, протекающего на фоне СПИДа, наблюдаются обратимые лейкопения, тромбоцитопения, протеинурия, в крови повы шаются активность аминотрансфераз, содержание билирубина и креатииина. В последнее время у таких больных отмечено появление кератопатии и недостаточности надпочечников.
Больные, получающие инъекции сурамина, требуют тщательного на блюдения. Сурамин не применяют при непереносимости пробной дозы, тяжелых заболеваниях почек, отменяют при стойкой альбуминурии. Чув ство давления в области кистей и стоп может предшествовать перифери ческой нейропатии.
М е л а р с о п р о л
В 1948 г. Э. Фридхейм установил, что меларсопрол - димеркаптопропанольное производное меларсеноксида эффективен при запущенных ста диях африканского трипаносомоза. МЕЛАРСОПРОЛ (МЕЛ В; АРСОБАЛ) не растворяется в воде, его вводят в вену в виде раствора в пропиленгликоле.
Меларсопрол представляет собой арсеноксид, который быстро, но об ратимо связывается с тиоловыми группами ферментов. У трипаносом он ингибирует пируваткиназу, что нарушает продукцию энергии в реакциях гликолиза.
Основной механизм трипаноцидного эффекта заключается в связыва нии трипанотиона - дитиольного конъюгата глутатиона и спермидина [№-Мв-бис(глутатионил)-спермидин]. Трипанотион, выполняя функцию глутатиона, защищает мембраны кинетопластид от повреждения свобод ными радикалами кислорода. Продукт реакции трипанотиона с меларсопролом Мел Т по конкурентному принципу ингибирует трипанотионредуктазу - фермент восстановления трипанотиона (см. рис. 12.1). В кон центрации 0,5-10 мкмоль меларсопрол вызывает лизис чувствительных штаммов Т. brucei, резистентные штаммы не разрушаются препаратом в концентрации больше 100 мкмоль. Резистентность обусловлена наруше нием транспорта меларсопрола в трипаносомы при участии транспортера пуринов. Чувствительные и резистентные штаммы содержат одинаковое количество трипанотиона и проявляют одну и ту же активность трипанотионредуктазы.
При введении в вену меларсопрол создает терапевтическую концент рацию в спинномозговой жидкости. 70-80% дозы выводится кишечни ком.
Меларсопрол является препаратом выбора при трипаносомозе. При
западноафриканском трипаносомозе (7*. brucei gambiense) его применяют только на поздней стадии, когда развился менингоэнцефалит. Больным восточноафриканским трипаносомозом (7\ brucei rhodesiense) меларсоп рол вводят сразу же после установления диагноза, так как поражение центральной нервной системы возникает уже на ранней, гемолимфатический стадии болезни. Меларсопрол из-за высокой токсичности не ис пользуют для химиопрофилактики трипаносомоза.
Больные, инфицированные Т. brucei rhodesiense, при рецидиве болез ни после цикла терапии меларсопролом обычно излечиваются после вто рого курса. При трипаносомозе, вызванном Т. brucei gambiense, для вто рого курса химиотерапии назначают эфлорнитин.
Меларсопрол вливают медленно в вену. Недопустимо попадание ра створа в мышцы вследствие сильного раздражающего действия. Доза для взрослых больных с массой тела больше 50 кг и содержанием белка в спинномозговой жидкости меньше 40 мг составляет 3,6 мг/кг 1 раз в день. Инъекции проводят 3-4 дня с повторением спустя 7 дней. Третий курс может понадобиться еще через 10-21 день. Излечение наступает у 80-90% пациентов. Истощенных больных тяжелым менингоэнцефалитом сначала лечат сурамином.
Меларсопрол оценивают как средство с высокой токсичностью. Вскоре после его инъекции повышается температура тела. Гипертермия особенно выражена на фоне паразитемии. Более серьезным осложнением является поражение центральной нервной системы. У 5% больных возникает реак тивная энцефалопатия. Ее симптомы - судороги, острый отек головного мозга, быстро прогрессирующая кома. Патогенез энцефалопатии связы вают с иммунной реакцией в ответ на освобождение антигенов из погиб ших трипаносом, а не с прямым нейротоксическим влиянием меларсопрола. Для неотложной помощи при энцефалопатии показан преднизолон.
Аллергические реакции чаще наблюдаются во время второго курса химиотерапии. Известны случаи периферической нейропатии, артериаль ной гипертензии, миокардита, альбуминурии, гепатита, спастической боли в животе. После инъекции меларсопрола больные должны длительное время лежать и не принимать пищу.
Меларсопрол применяют только в условиях стационара. Режим дози рования при появлении токсических эффектов может изменяться. Препа рат противопоказан в период эпидемии гриппа, больным лепрой, людям с недостаточной активностью глюкозо-6-фосфатдегидрогеназы эритроцитов.
Э ф л о р н и т и н
ЭФЛОРНИТИН (сх-дифторметилорнитин, ДФМО; ОРНИДИЛ) являет ся необратимым («суицидным») ингибитором орнитиндекарбоксилазы - фермента, катализирующего первый, лимитирующий этап биосинтеза путресцина из орнитина (см. рис. 12.1). Полиамины - путресцин и спер-
мидин необходимы для деления и последующей дифференцировки кле ток. Эфлорнитин оказывает лечебное действие при западноафриканском трипаносомозе, вызванном Т. brucei gambiense, включая поздние стадии с поражением головного мозга. Избирательное действие на трипаносомы обусловлено тем, что у человека кругооборот полиаминов ускорен и их фонд быстро восполняется. В эксперименте эфлорнитин сдерживает про лиферацию опухолевых клеток млекопитающих. Препарат имеет очень высокую стоимость.
Эфлорнитин оказывает протистостатическое действие на 7*. brucei gambiense. Под его влиянием трипаносомы превращаются из длинных и тонких в короткие и толстые, утрачивают способность к делению, пере стают изменять конфигурацию гликопротеиновой клеточной оболочки и удаляются с помощью антител хозяина.
Эфлорнитин принимают внутрь и вводят в вену. При приеме внутрь биодоступность составляет 54%, пик концентрации в крови отмечается через 4 ч. Препарат не связывается с белками крови, проникает в органы, преодолевает гематоэнцефалический барьер. Его концентрация в голов ном мозге достигает 90% от концентрации в крови. 80% дозы эфлорнитина выводится почками в неизмененном виде, период полуэлиминации - около 3 ч. Фармакокинетика эфлорнитина является дозозависимой.
Эфлорнитин применяют для терапии западноафриканского трипано сомоза в поздней стадии. Многие пациенты лечатся эфлорнитином после курса терапии препаратами мышьяка. Взрослым больным вводят в вену 100 мг/кг каждые 6 ч в течение 14 дней. Выздоровление наступает у 60%. Детям старше 12 лет эфлорнитин назначают в большей дозе в расчете на поверхность тела, так как у них препарат быстрее элиминируется и хуже проникает в центральную нервную систему. Если у детей эфлорнитин вызывает судороги, дозу в первой половине курса лечения снижают.
Менее эффективен прием эфлорнитина внутрь (100 мг через 6 ч на протяжении 21-45 дней). Увеличение дозы сопровождается развитием ос мотической диареи.
При восточноафриканском трипаносомозе, вызванном Т. brucei rhodesiense, может помочь внутривенная терапия эфлорнитином с после дующими инъекциями сурамина.
Эфлорнитин часто вызывает побочные реакции. При его внутривен ной инфузии возникают анемия (у 48% пациентов), диарея (у 39%), лей копения (у 27%), тромбоцитопения, алопеция, рвота, боль в животе, го ловная боль, головокружение, гипертермия, анорексия (у 10%), судороги [у 7%). Необходима периодическая проверка слуха. В эксперименте эф лорнитин обладает тератогенным действием. Препарат противопоказан при беременности, детям до 12 лет. Эфлорнитин вводят в большом объеме жидкости, что может становиться опасным у больных артериальной гипертензией, сердечной и почечной недостаточностью.
Н и ф у р т и м о к с
НИФУРТИМОКС (БАЙЕР 2502, ЛАМПИТ) является основным сред ством химиотерапии южноамериканского трипаносомоза (болезнь Шагаса), вызванного Trypanosoma cruzi. По химической структуре он пред ставляет собой 3-метил-4(5'-нитрофурфурилиденамино)-тетрагидро-4Н-1,4- тиазин-1,1 -диоксид.
Нифуртимокс подавляет безжгутиковые формы Т. cruzi (трипомастиготы и амастиготы). К препарату наиболее чувствительны внутриклеточ ные амастиготы. Их развитие останавливается при концентрации нифуртимокса всего 1 мкмоль. Для трипаноцидного действия на трипомастиготы необходима концентрация 10 мкмоль.
В цитоплазме Т. cruzi нифуртимокс при участии трипанотионредуктазы восстанавливается с образованием нитрорадикала. Затем происходит аутоокисление, в результате которого регенерирует исходный нитрофуран, образуются радикалы супероксида, гидроксила, перекись водорода и другие реакционноспособные формы кислорода. Свободные радикалы вы зывают перекисное окисление мембранных липидов, инактивируют ферменты, повреждают ДНК, стимулируют мутагенез. Трипанотион в про цессе восстановления нифуртимокса окисляется в неактивную дисульфидную форму, что снижает эффективность антиперекисной защиты парази тов.
Нифуртимокс хорошо всасывается при приеме внутрь, подвергается пресистемной элиминации. Максимальная концентрация в крови уста навливается через 3,5 ч. Метаболиты не обладают трипаноцидной актив ностью. 0,5% дозы выводится с мочой. Период полуэлиминации - около 3 ч.
Единственное показание для применения нифуртимокса - южноаме риканский трипаносомоз в острой стадии. Препарат неэффективен при хронической.стадии заболевания, когда возникают необратимые пораже ния внутренних органов аутоиммунной природы (кардиомиопатия).
Нифуртимокс прекращает паразитемию и обеспечивает исцеление 80% больных южноамериканским трипаносомозом в острой стадии. Наиболее чувствительны к препарату штаммы Т. cruzi в Аргентине, Чили, Венесу эле, на юге Бразилии. Слабее на нифуртимокс реагируют штаммы, выде ленные от больных в центральных районах Бразилии.
Нифуртимокс принимают внутрь 4 раза в сутки. Взрослым больным назначают суточную дозу 8-10 мг/кг в течение 4 мес. Детям в возрасте от 1 года до 10 лет рекомендуют принимать суточную дозу 15-20 мг/кг, де тям в возрасте 11-16 лет - 12,5-15 мг/кг. Длительность курса терапии у детей - 3 мес. При серьезных нарушениях пищеварения дозу снижают.
При приеме нифуртимокса возможны дозозависимые побочные эффек ты. Возникают аллергические реакции (дерматит, лихорадка, желтуха, инфильтраты в легких, анафилактический шок), тошнота, рвота, миалгия, слабость. Серьезную опасность представляет повреждение нервной системы - головная боль, психические расстройства, парестезия, поли неврит. Нифуртимокс может вызывать лейкопению, снижать количество сперматозоидов, нарушать клеточный иммунитет. Дети переносят препа рат лучше, чем взрослые. Во время лечения запрещено употреблять алко гольные напитки.
Глава 13 ПРОТИВОМАЛЯРИЙНЫЕ СРЕДСТВА
Противомалярийные средства применяют для профилактики и
л е ч е н и я |
м а л я р и и . |
Б е возбудителями я в л я ю т с я |
п л а з м о д и и : |
Plasmodium |
vivax и P. |
ovale вызывают трехдневную |
малярию, Р. |
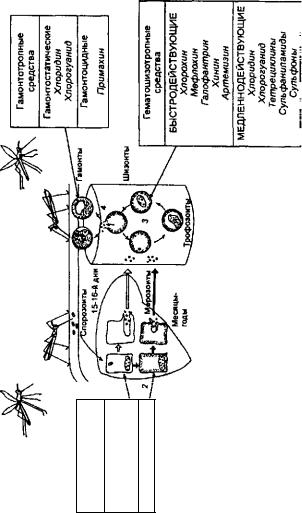
malariae - четырехдневную малярию, P. falciparum - тропическую малярию. Малярийный плазмодий проходит 2 стадии развития - бесполый цикл в организме человека (шизогония) и половой цикл в теле москита (спорогония).
При укусе со слюной москита в кровь человека попадают спорозоиты. Они быстро внедряются в клетки печени, где превраща ются в преэритроцитарные (первичные тканевые) формы и затем -
втканевые мерозоиты. Спустя месяц мерозоиты выходят из пече ни в кровь. В эритроцитах они развиваются в эритроцитарные шизонты, которые на конечном этапе формирования подвергаются множественному делению (меруляция). Образующиеся при этом эритроцитарные мерозоиты выходят из разрушенных эритроцитов
вплазму. Это сопровождается приступом лихорадки. Дальнейшее развитие эритроцитарных мерозоитов происходит в 2 направлени ях. Они заражают новые эритроциты и повторяют цикл шизого нии или превращаются в эритроцитах в гамонты - женские и муж ские половые клетки (оплодотворение возможно только в теле москита).
При трех- и четырехдневной малярии в печени остаются параэритроцитарные (вторичные тканевые) формы, при тропической малярии они отсутствуют. Параэритроцитарные формы являются зрелыми и могут заражать эритроциты на протяжении года, вызы вая рецидив малярии.
Классификацию противомалярийных средств проводят в зави симости от их избирательного воздействия на стадии развития малярийного плазмодия и целей клинического применения (рис. 13.1).
Гистошизотропные |
средства |
для |
индивидуальной |
(личной) |
|
химиопрофилактики |
малярии |
подавляют |
преэритроцитарные |
||
формы малярийного плазмодия. Токсическим влиянием на них обладают хлоридин и хлорогуанид. Эти препараты, а также гемагошизотропные средства применяют для предупреждения заболе-
01 1НЫ изотропедства
(СТ С
«о оридин оогуани
5 о
э
S
§ Пр
Я
4я
о оЪ
га5 ейEL ч^ СS
? * 2
>Я*
о. § « -5
31s
S я
SI з
аСО<й аГ*S н"Г
оa I * I
£ g a
ЯЯ
иmgЯяН
S
оS g? о
gм-коО. га
ftSO оftо
2 ft
XЯО. *
я в Я
5 •- ™
я Я5- S Sо pa2 »она
К •&я I £»
Яя, ftg0 5
Яо pa4 нft
.я
1а
2ft
я
