
- •Биологическая терапия- новые возможности при ВЗК
- •ЭПИДЕМИОЛОГИЯ
- •Динамика заболеваемости ВЗК в регионах РФ
- •Цели терапии ВЗК
- •Цели терапии ВЗК
- •Группы препаратов
- •Месалазин 400 мг № 50
- •Салофальк-ректальная пена и клизмы- оптимальные формы месалазина при дистальных формах ЯК
- •ГИБП для лечения ВЗК
- •Ингибиторы ФНО для лечения ВЗК
- •Консенсус ECCO
- •Клинические рекомендации,
- •Отдельные аспекты терапии ингибиторами
- •ГИБП для лечения ВЗК
- •Неудовлетворённые потребности в терапии ВЗК ингибиторами ФНОα: вопросы эффективности
- •Неудовлетворённые потребности в терапии ингибиторами ФНОα: вопросы безопасности 1-5
- •Молекулы клеточной адгезии:
- •Интегрины
- •Многоэтапное взаимодействие между лейкоцитами и эндотелием обеспечивает миграцию из сосудов в ткани
- •Взаимодействие α4β7 интегрина с MAdCAM-1:
- •Механизм действия ведолизумаба
- •Энтивио ® (ведолизумаб)
- •Показания к применению препарата ведолизумаб:
- •Ведолизумаб: схема лечения одинакова для язвенного колита и болезни Крона
- •Новый этап в биологической терапии ВЗК: таргетное воздействие на ЖКТ
- •Быстрое достижение и поддержание заживления слизистой оболочки при терапии ЯК ведолизумабом
- •Поддержание клинической ремиссии при ЯК1−3
- •Результаты исследования ведолизумаба у пациентов со средне-тяжелым и тяжелым активным ЯК
- •Достижение и поддержание длительной клинической ремиссии в терапии болезни Крона ведолизумабом
- •Поддержание клинической ремиссии при БК 1−3
- •Низкая иммуногенность ведолизумаба в исследованиях при ЯК и болезни Крона
- •Анализ частоты инфекций и серьезных инфекций: благоприятный профиль безопасности ведолизумаба
- •Профиль безопасности ведолизумаба
- •Серьезные инфекции, представляющие интерес. Объединенные данные по безопасности ведолизумаба
- •Долговременная безопасность ведолизумаба
- ••Гуманизированное моноклональное антитело к α4β7 рецепторам интегрина лимфоцитов, селективно блокирующее воспаление в кишечнике.
- •Ведолизумаб в терапии воспалительных заболеваний кишечника.
- •Выводы
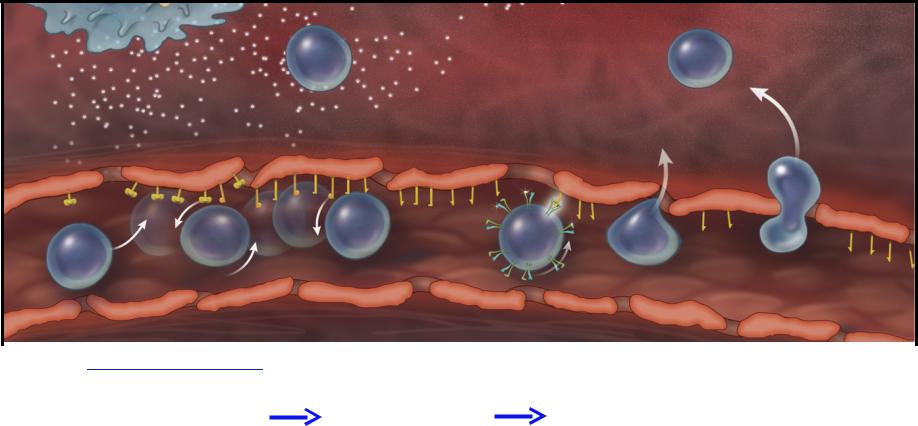
Многоэтапное взаимодействие между лейкоцитами и эндотелием обеспечивает миграцию из сосудов в ткани
Диапедез- миграция через эндотелий
|
Скольжение и качение |
активация |
адгезия |
||||
|
|
|
|
интегринов |
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
лимфоцит |
|
|
|
|
|
|
|
|
Хемокины : |
|
|
|
||
|
Селектины: |
|
|
Интегрины прочно связываются с |
|
||
|
заякоривание |
|
активация |
|
|
адрессинами: остановка движения |
|
|
лимфоцитов |
|
интегринов |
|
|
лимфоцита |
|
|
|
|
|
|
|
|
|
von Andrian UH, et al. N Engl J Med 2000;343(14):1020–1034.; Abbas et al. Basic Immunology. Functions and Disorders of the Immune System (4th Ed) Elsevier, Philadelphia 2012.

Взаимодействие α4β7 интегрина с MAdCAM-1:
ведущая роль в миграции лимфоцитов, вызывающих воспаление при ВЗК
•α4β7 интегрин экспрессирован на поверхности подгруппы T-клеток, которые мигрируют преимущественно в ЖКТ при ВЗК
•MAdCAM-1 является лигандом α4β7 интегрин и экспрессируется главным образом на клетках эндотелия сосудов в кишечнике
MAdCAM-1
α4β7 интегрин
лимфоцит
22 |
Сокращения: ВЗК- воспалительные заболевания кишечника , ЖКТ- желудочно- кишечный тракт |
|
1. Peyrin-Biroulet L, et al. Lancet. 2008;372:67-81, 2. Briskin, M, et al. Am J Pathol.1997; 151: 97-110. |
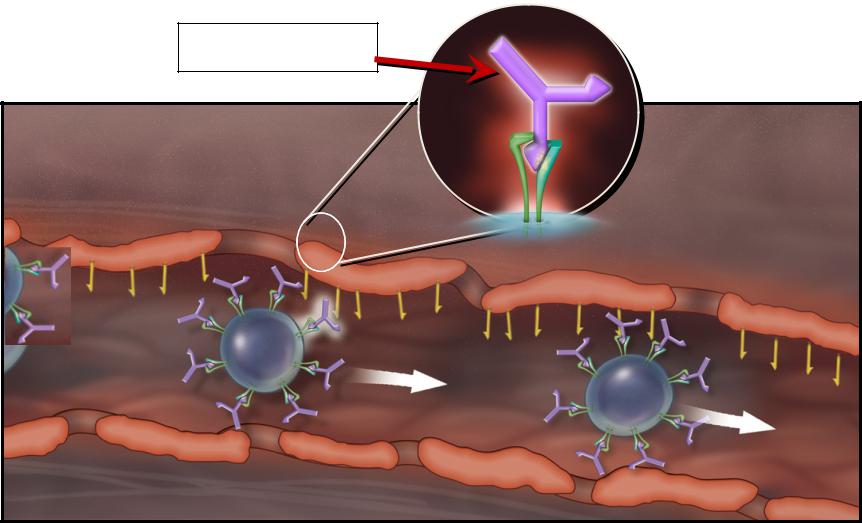
Механизм действия ведолизумаба
Ведолизумаб связывается с α4β7 интегрином, тем самым препятствует миграции лимфоцитов в ЖКТ
Ведолизумаб
Стенка ЖКТ
α4β7
интегрин
лимфоцит
Кровеносный
сосуд
Сокращения: ЖКТ – желудочно-кишечный тракт
Soler D, et al. J Pharmacol Exp Ther 2009;330(3):864–875.
Энтивио ® (ведолизумаб)
• Дата регистрации в РФ: 22.06.2016
• Торговое наименование: Энтивио®
• Международное непатентованное название:
Ведолизумаб
• Лекарственная форма: лиофилизат для приготовления концентрата для приготовления раствора для инфузий.
1 флакон содержит:
действующее вещество: ведолизумаб – 300,0 мг
Инструкция по применению лекарственного препарата для медицинского применения Энтивио® РУ №ЛП-003697
Показания к применению препарата ведолизумаб:
Пациенты со среднетяжелыми или тяжелыми активным язвенным колитом и болезнью Крона с 18 лет и старше :
•с неадекватным ответом, неэффективностью лечения (или снижением эффективности) или непереносимостью одного или нескольких препаратов стандартной терапии;
•с неудовлетворительным ответом, утратой ответа или непереносимостью одного или нескольких ингибиторов фактора некроза опухоли-альфа (ФНО-α).
1.Инструкция по применению лекарственного препарата для медицинского применения Энтивио® РУ №ЛП-003697
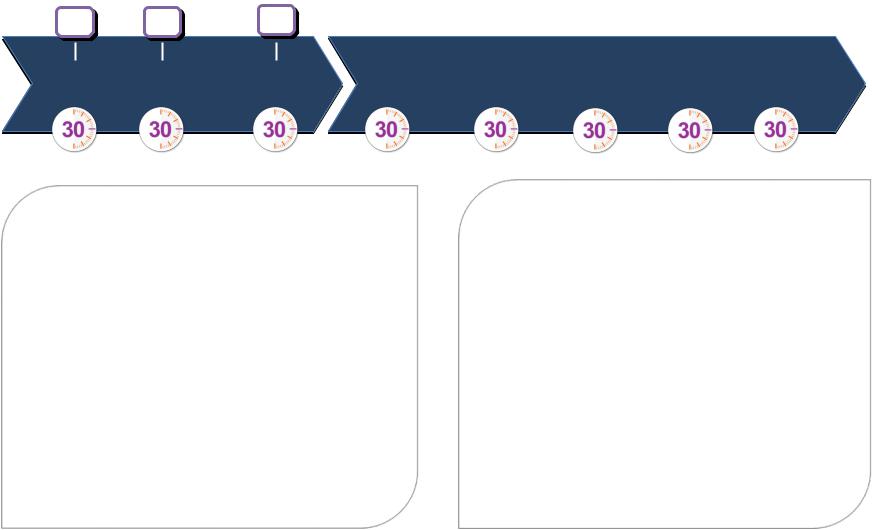
Ведолизумаб: схема лечения одинакова для язвенного колита и болезни Крона
неделя 0 |
2 |
6 |
Поддерживающая терапия |
|||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||
Индукция |
|
|
||||||||
|
|
каждые 8 недель |
|
|
||||||
|
|
|
|
|
|
|
|
|||
300мг |
300мг |
300мг |
300мг |
300мг |
300мг |
300мг |
300мг |
|||
• Ведолизумаб 300 мг вводится в виде |
|
. |
|
|
|
|||||
внутривенной инфузии в течение 30 минут, |
•Пациентам, у которых отмечается |
|||||||||
затем в той же дозе через 2 недели и через |
клинический ответ на лечение, после 14-й |
|||||||||
6 недель после первого введения, и далее |
недели продолжают вводить препарат с |
|||||||||
каждые 8 недель. |
|
|
|
интервалом в 8 недель. |
|
|
||||
• У пациентов с БК с отсутствием |
|
•У пациентов со снижением клинического |
||||||||
клинического ответа на терапию, |
|
ответа на лечение, терапевтический эффект |
||||||||
терапевтический эффект может быть |
|
может быть достигнут с помощью введения |
||||||||
достигнут с помощью введения препарата |
препарата ведолизумаб 300 мг каждую 4-ую |
|||||||||
в дозе 300 мг на 10-й неделе. |
|
неделю |
|
|
|
|||||
1. Инструкция по применению лекарственного препарата для медицинского применения Энтивио® РУ №ЛП-003697
Новый этап в биологической терапии ВЗК: таргетное воздействие на ЖКТ
•Ведолизумаб - первый биологический препарат для лечения язвенного колита и болезни Крона, селективно блокирующий воспаление в кишечнике
•Представитель нового класса биологических
препаратов – блокатор α4β7-интегрина, расширяющий терапевтические возможности при ВЗК

Быстрое достижение и поддержание заживления слизистой оболочки при терапии ЯК ведолизумабом
пациенты (%)
Неделя 6 индукционная терапия
Плацебо (n=149) Ведолизумаб (n=225)
p<0.001
пациенты (%)
Неделя 52 поддерживающая терапия
Плацебо (n=149) Ведолизумаб (n=225)
p<0.001
Mean % (95% ДИ): средняя разница между группами ведолизумаб и плацебо 16.1 (6.4, 25.9) в индукционной и 32.0 (20.3, 43.8) в поддерживающей терапии Заживление слизистой оболочки: значение по подшкале эндоскопической оценки шкалы клиники Мейо 0 или 1
Адаптировано из: Feagan BG et al. N Engl J Med 2013; 369: 699-710.
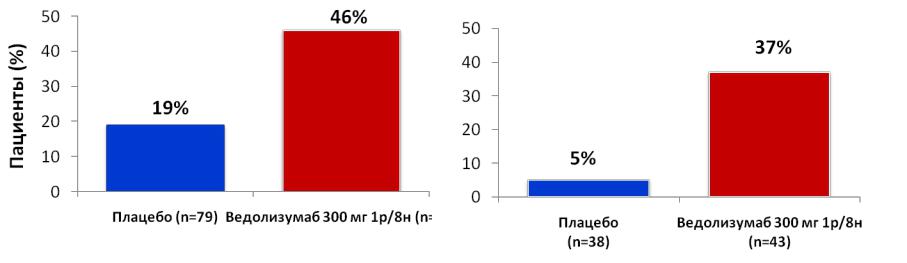
Поддержание клинической ремиссии при ЯК1−3
Сохранение значимо более высоких показателей клинической ремиссии на неделе 52 при ЯК в сравнении с плацебо вне зависимости от предшествовавшей терапии ингибиторами ФНО-α
Без предшествовавшей терапии |
С неудачей терапии |
ингибиторами ФНОα1,3 |
ингибиторами ФНОα 1-3 |
*Клиническая ремиссия: общая оценка по шкале Мейо ≤2, отсутствие подшкал с оценкой >1. Поисковая конечная точка (поддерживающая терапия); 95% ДИ: подгруппа без предшествующей терапии ингибиторами ФНОα (12,4–41,2), с неудачей терапии ингибиторами ФНО α(15,8–48,0)
1. Feagan et al. Am J Gastroenterol 2012; 107:S609–S610;. 2. Takeda Pharmaceuticals International GmBH. Entyvio® (vedolizumab). Summary of Product Characteristics. June 2014. Last accessed June 2014; 3. Feagan et al. N Engl J Med 2013;369:699-710.
Результаты исследования ведолизумаба у пациентов со средне-тяжелым и тяжелым активным ЯК
• Индукционная терапия ведолизумабом:
У половины (47%) пациентов достигает клинический ответ к неделе 6
• Поддерживающая терапия ведолизумабом, на неделе 52:
Более чем в 2 раза выше частота заживления слизистой оболочки у пациентов в группе ведолизумаба, чем в группе плацебо
У каждого второго пациента, не получавшего ранее ингибиторы ФНОα ,была клиническая ремиссия
У каждого третьего пациента, с неудачей предшествовавшей терапии ингибиторами ФНОα, была клиническая ремиссия
У каждого третьего пациента была достигнута бесстероидная ремиссия
На основании данных: Feagan BG et al. N Engl J Med 2013; 369: 699-710.
