
Формулы
Вероятность того, что физическая величина x, характеризующая молекулу, лежит в интервале значений от x до x + dx, определяется по формуле
dW(x) = f(x) dx,
здесь f(x) – функция распределения молекул по значениям данной физической величины x (плотность вероятности). Приведенная формула выражает также долю молекул, для которых физическая величина x заключена в интервале от x до x + dx.
Количество молекул, для которых физическая величина x, характеризующая их, заключена в интервале значений от x до x + dx,
dN = N dW(x) = N f(x) dx.
Барометрическая формула (распределение давления в однородном поле силы тяжести и распределение частиц в однородном силовом поле, соответственно):
 ,
,
здесь p – давление на высоте h, n – концентрация молекул на высоте h, p0, n 0 давление и концентрация частиц на уровне моря (h = 0), m0 – масса одной молекулы, M – молярная масса, g – ускорение свободного падения, k – постоянная Больцмана, T – термодинамическая (абсолютная) температура, R – универсальная газовая постоянная;
Распределение Максвелла (распределение молекул по скоростям):
 ,
,
здесь ʋ – скорость молекулы;
Число молекул, скорости которых заключены в пределах от ʋ до ʋ + dʋ:
 ,
,
здесь N – общее число молекул;
Число молекул, относительные скорости которых заключены в пределах от u до u + du:
 ,
,
здесь u = ʋ/ʋв – относительная скорость, равная отношение скорости ʋ к наивероятнейшей скорости ʋв.
Эффективное сечение столкновения молекулы:
σ = πd2,
здесь d – эффективный диаметр молекулы (внесистемная единица измерения 1 барн = 10–28 м2).
Среднее число соударений, испытываемых одной молекулой газа в единицу времени:
 ,
,
здесь n – концентрация молекул, ‹ʋ› – средняя арифметическая скорость молекул;
Среднее длина свободного пробега:
 ;
;
Импульс, переносимый молекулами из одного слоя в другой через элемент поверхности:
 ,
,
здесь η – динамическая вязкость газа, dʋ/dz – градиент (поперечный) скорости течения его слоев, ΔS – площадь элемента поверхности, dt – время переноса;
Динамическая вязкость:
 ,
,
здесь ρ – плотность газа;
Вязкое трение:
 ,
,
здесь F – сила внутреннего трения между движущимися слоями газа;
Закон Фурье:

здесь ΔQ – теплота, прошедшая посредством теплопроводности через сечение площадью ΔS за время Δt, λ – теплопроводность, dT/dx – градиент температуры;
Теплопроводность (коэффициент теплопроводности) газа:
 ,
,
здесь cV – удельная теплоемкость газа при постоянном объеме;
Закон Фика:
 ,
,
здесь Δm – масса газа, перенесенная в результате диффузии через сечение площадью ΔS за время Δt, D – коэффициент диффузии, dN/dx – градиент концентрации молекул;
Диффузия (коэффициент диффузии):
 .
.
Задачи
Распределение Больцмана
10.1. Пылинки, взвешенные в воздухе, имеют массу m = 10–18 г. Во сколько раз уменьшится их концентрация n при увеличении высоты на Δh = 10 м? Температура воздуха T = 300 К.
10.2. Одинаковые частицы массой m = 10–12 г каждая распределены в однородном гравитационном поле напряженностью G = 0,2 мкН/кг. Определить отношение n1/n2 концентраций частиц, находящихся на эквипотенциальных уровнях, отстоящих друг друга на Δz = 10 м. Температура T во всех слоях считается одинаковой и равной 290 К.
10.3. Масса m каждой из пылинок, взвешенных в воздухе, равна 10–18 г. Отношение концентрации n1 пылинок на высоте hl = 1 м к концентрации n0 их на высоте h0 = 0 равно 0,787. Температура воздуха T = 300 К. Найти по этим данным значение постоянной Авогадро NA.
10.4. Определить силу F, действующую на частицу, находящуюся во внешнем однородном поле силы тяжести, если отношение n1/n2 концентраций частиц на двух уровнях, отстоящих друг от друга на Δz = 1 м, равно e (e – основание натуральных логарифмов). Температуру T считать везде одинаковой и равной 300 К.
10.5. На сколько уменьшится атмосферное давление p = 100 кПа при подъеме наблюдателя над поверхностью Земли на высоту h = 100 м? Считать, что температура T воздуха равна 290 К и не изменяется с высотой.
10.6. На какой высоте h над поверхностью Земли атмосферное давление вдвое меньше, чем на ее поверхности? Считать, что температура T воздуха равна 290 К и не изменяется с высотой.
10.7. Барометр в кабине летящего вертолета показывает давление p = 90 кПа. На какой высоте h летит вертолет, если на взлетной площадке барометр показывал давление p0 = 100 кПа? Считать, что температура T воздуха равна 290 К и не изменяется с высотой.
10.8. Найти изменение высоты соответствующее изменению давления на Δp = 100 Па, в двух случаях: 1) вблизи поверхности Земли, здесь температура T1 = 290 К, давление p1 = 100 кПа; 2) на некоторой высоте, здесь температура T2 = 220 К, давление p2 = 25 кПа.
10.9. Барометр в кабине летящего самолета все время показывает одинаковое давление p = 80 кПа, благодаря чему летчик считает высоту h полета неизменной. Однако температура воздуха изменилась на ΔT = 1 К. Какую ошибку Δh в определении высоты допустил летчик? Считать, что температура не зависит от высоты и что у поверхности Земли давление p0 = 100 кПа.
10.10. Ротор центрифуги вращается с угловой скоростью ω. Используя функцию распределения Больцмана, установить распределение концентрации n частиц массой m, находящихся в роторе центрифуги, как функцию расстояния R от оси вращения.
10.11. В центрифуге с ротором радиусом a, равным 0,5 м, при температуре T = 300 К находится в газообразном состоянии вещество с относительной молекулярной массой Mr = 103. Определить отношение na/n0 концентраций молекул у стенок ротора и в центре его, если ротор вращается с частотой n = 30 с–1.
10.12. Ротор центрифуги, заполненный радоном, вращается с частотой n = 50 с–1. Радиус a ротора равен 0,5 м. Определить давление p газа на стенки ротора, если в его центре давление p0 равно нормальному атмосферному. Температуру T по всему объему считать одинаковой и равной 300 К.
10.13. В центрифуге находится некоторый газ при температуре T = 271 К. Ротор центрифуги радиусом a = 0,4 м вращается с угловой скоростью ω 500 рад/с. Определить относительную молекулярную массу Mr газа, если давление p у стенки ротора в 2,1 раза больше давления p0 в его центре.
10.14. Ротор ультрацентрифуги радиусом a = 0,2 м заполнен атомарным хлором при температуре T = 3000 К. Хлор состоит из двух изотопов: 37Cl и 35Cl. Доля w1 атомов изотопа 37Cl составляет 0,25. Определить доли wʹ1 и wʹ2 атомов того и другого изотопов вблизи стенок ротора, если ротору сообщить угловую скорость вращения ω, равную 104 рад/с.
Распределение молекул по скоростям и импульсам
10.15. Зная функцию распределения молекул по скоростям, вывести формулу наиболее вероятной скорости ʋв.
10.16. Используя функцию распределения молекул по скоростям, получить функцию, выражающую распределение молекул по относительным скоростям u (u = ʋ/ʋв).
10.17. Какова вероятность W того, что данная молекула идеального газа имеет скорость, отличную от ʋв/2 не более чем на 1%?
10.18. Найти вероятность W того, что данная молекула идеального газа тлеет скорость, отличную от ʋв не более чем на 1%.
10.19. Зная функцию распределения молекул по скоростям, вывести формулу, определяющую долю w молекул, скорости ʋ которых много меньше наиболее вероятной скорости ʋв.
10.20. Определить относительное число w молекул идеального газа, скорости которых заключены в пределах от нуля до одной сотой наиболее вероятной скорости ʋв.
10.21. Зная функцию распределения молекул по скоростям, определить среднюю арифметическую скорость ‹ʋ› молекул.
10.22. По функции распределения молекул по скоростям определить среднюю квадратичную скорость ‹ʋкв›.
10.23. Определить, какая из двух средних величин, ‹1/ʋ› или 1/‹ʋ›, больше, и найти их отношение k.
10.24.
Распределение молекул по скоростям в
молекулярных пучках при эффузионном
истечении (эффузионное истечение – это
истечение газов через отверстия, малые
по сравнению с длиной свободного пробега
молекул) отличается от максвелловского
и имеет вид
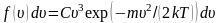 .
Определить из условия нормировки
коэффициент C.
.
Определить из условия нормировки
коэффициент C.
10.25.
Зная функцию распределения молекул по
скоростям в некотором молекулярном
пучке
 найти выражения для: 1) наиболее вероятной
скорости ʋв;
2) средней арифметической скорости ‹ʋ›.
найти выражения для: 1) наиболее вероятной
скорости ʋв;
2) средней арифметической скорости ‹ʋ›.
10.26. Водород находится при нормальных условиях и занимает объеме V = 1 см3. Определить число N молекул в этом объеме, обладающих скоростями, меньшими некоторого значения ʋmax = 1 м/с.
10.27. Вывести формулу наиболее вероятного импульса pв молекул идеального газа.
10.28. Найти число N молекул идеального газа, имеющих импульс, значение которого точно равно наиболее вероятному значению pв.
10.29. Вывести формулу, определяющую среднее значение компонента импульса ‹px› молекул идеального газа.
10.30. На сколько процентов изменится наиболее вероятное значение pв импульса молекул идеального газа при изменении температуры на один процент?
10.31. Найти выражение для импульса молекул идеального газа, энергии которых равны наиболее вероятному значению энергии.
Распределение молекул по кинетическим энергиям поступательного движения
10.32. Найти выражение средней кинетической энергии ‹E› поступательного движения молекул. Функцию распределения молекул по энергиям считать известной.
10.33. Преобразовать формулу распределения молекул по энергиям в формулу, выражающую распределение молекул по относительным энергиям w (w = E/‹E›, здесь E – кинетическая энергия; ‹E› – средняя кинетическая энергия поступательного движения молекул).
10.34. Определить долю w молекул идеального газа, энергии которых отличаются от средней энергии ‹E› поступательного движения молекул при той же температуре не более чем на 1%.
10.35. Вывести формулу, определяющую долю w молекул, энергия E которых много меньше kT. Функцию распределения молекул по энергиям считать известной.
10.36. Определить долю w молекул, энергия которых заключена в пределах от El = 0 до E2 = 0,01kT.
10.37. Число молекул, энергия которых заключена в пределах от нуля до некоторого значения E, составляет 0,1% от общего числа молекул. Определить величину E в долях kT.
10.38. Считая функцию распределения молекул по энергиям известной, вывести формулу, определяющую долю w молекул, энергии E которых много больше энергии теплового движения молекул.
10.39. Число молекул, энергия которых выше некоторого значения E1, составляет 10–4 от общего числа молекул. Определить величину E1 в долях kT, считая, что E >> mkT.
Указание. Получающееся трансцендентное уравнение решить графически.
10.40. Используя функцию распределения молекул по энергиям, определить наиболее вероятное значение энергии Eв.
10.41. Преобразовать функцию f(E)dE распределения молекул по кинетическим энергиям в функцию f(θ)dθ распределения молекул по относительным кинетическим энергиям (здесь θ = E/Eв; Eв – наиболее вероятное значение кинетической энергии молекул).
10.42. Найти относительное число w молекул идеального газа, кинетические энергии которых отличаются от наиболее вероятного значения Eв энергии не более чем на 1%.
10.43. Определить относительное число w молекул идеального газа, кинетические энергии которых заключены в пределах от нуля до значения, равного 0,01Eв (Eв – наиболее вероятное значение кинетической энергии молекул).
10.44. Найти выражение для кинетической энергии молекул идеального газа, импульсы которых имеют наиболее вероятное значение pв.
10.45. Во сколько раз изменится значение максимума функции f(E) распределения молекул идеального газа по энергиям, если температура T газа увеличится в два раза? Решение пояснить графиком.
10.46. Определить, во сколько раз средняя кинетическая энергия ‹E› поступательного движения молекул идеального газа отличается от наиболее вероятного значения ‹E› кинетической энергии поступательного движения при той же температуре.
Длина свободного пробега и число столкновений молекул
10.47. Найти среднюю длину свободного пробега ‹ℓ› молекул водорода при давлении p = 0,1 Па и температуре T = 100 К.
10.48. При каком давлении p средняя длина свободного пробега ‹ℓ› молекул азота равна 1 м, если температура T газа равна 300 К?
10.49. Баллон вместимостью V = 10 л содержит водород массой m = 1 г. Определить среднюю длину свободного пробега ‹ℓ› молекул.
10.50. Можно ли считать вакуум с давлением p = 100 мкПа высоким, если он создан в колбе диаметром d = 20 см, содержащей азот при температуре T = 280 К?
10.51. Определить плотность ρ разреженного водорода, если средняя длина свободного пробега ‹ℓ› молекул равна 1 см.
10.52. Найти среднее число ‹z› столкновений испытываемых в течение t = 1 с молекулой кислорода при нормальных условиях.
10.53. Найти число N всех соударений, которые происходят в 1 с между всеми молекулами водорода, занимающего при нормальных условиях объем V = 1 мм3.
10.54. В газоразрядной трубке находится неон при температуре T = 300 К и давлении p = 1 Па. Найти число N атомов неона, ударяющихся за время Δt = 1 с о катод, имеющий форму диска площадью S = 1 см2.
10.55. Найти среднюю продолжительность ‹τ› свободного пробега молекул кислорода при температуре T = 250 К и давлении p = 100 Па.
10.56. Найти зависимость средней длины свободного пробега ‹ℓ› молекул идеального газа от давления p при следующих процессах: 1) изохорном; 2) изотермическом. Изобразить эти зависимости на графиках.
10.57. Найти зависимость средней длины свободного пробега ‹ℓ› молекул идеального газа от температуры T при следующих процессах: 1) изохорном; 2) изобарном. Изобразить эти зависимости на графиках.
10.58. Найти зависимость среднего числа столкновений ‹z› молекулы идеального газа в 1 с от давления p при следующих процессах: 1) изохорном; 2) изотермическом. Изобразить эти зависимости на графиках.
10.59. Найти зависимость среднего числа столкновений ‹z› молекулы идеального газа в 1 с от температуры T при следующих процессах: 1) изохорном; 2) изобарном. Изобразить эти зависимости на графиках.
Явления переноса: диффузия, вязкость, теплопроводность
10.60. Средняя длина свободного пробега ‹ℓ› атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.
10.61. Коэффициент диффузии D кислорода при температуре t = 0 ºC равна 0,19 см2/с. Определить среднюю длину свободного пробега ‹ℓ› молекул кислорода.
10.62. Вычислить коэффициент диффузии D азота: 1) при нормальных условиях; 2) при давлении p = 100 Па и температуре T = 300 К.
10.63. Определить, во сколько раз отличается коэффициент диффузии D1 газообразного водорода от коэффициента диффузии D2 газообразного кислорода, если оба газа находятся при одинаковых условиях.
10.64. Определить зависимость коэффициента диффузии D от температуры T при следующих процессах: 1) изобарном; 2) изохорном.
10.65. Определить зависимость коэффициента диффузии D от давления p при следующих процессах: l) изотермическом; 2) изохорном.
10.66. Вычислить динамическую вязкость η кислорода при нормальных условиях.
10.67. Найти среднюю длину свободного пробега ‹ℓ› молекул азота при условии, что его динамическая вязкость η = 17 мкПа·с.
10.68. Найти динамическую вязкость η гелия при нормальных условиях, если коэффициент диффузии D при тех же условиях равен 1,06·10–4 м2/с.
10.69. Определить зависимость динамической вязкости η от температуры T при следующих процессах: 1) изобарном; 2) изохорном. Изобразить эти зависимости на графиках.
10.70. Определить зависимость динамической вязкости η от давления p при следующих процессах: l) изотермическом; 2) изохорном. Изобразить эти зависимости на графиках.
10.71. Цилиндр радиусом R1 = 10 см и длиной ℓ = 30 см расположен внутри цилиндра радиусом R2 = 10,5 см так, что оси обоих цилиндров совпадают. Малый цилиндр неподвижен, большой вращается относительно геометрической оси с частотой n = 15 с–1. Динамическая вязкость η газа, в котором находятся цилиндры, равна 8,5 мкПа·с. Определить вращающий момент M, действующий на поверхность внутреннего цилиндра.
10.72. Два горизонтальных диска радиусами R = 20 см расположены друг над другом так, что оси их совпадают. Расстояние d между плоскостями дисков равно 0,5 см. Верхний диск неподвижен, нижний вращается относительно геометрической оси с частотой n = 10 с–1. Найти вращающий момент M, действующий на верхний диск. Динамическая вязкость η воздуха, в котором находится диски, равна 17,2 мкПа·с.
10.73. В ультраразреженном азоте, находящемся под давлением p = 1 мПа и при температуре T = 300 К, движутся друг относительно друга две параллельные пластины со скоростью u = 1 м/с. Расстояние между пластинами не изменяется и много меньше средней длины свободного пробега молекул. Определить силу F внутреннего трения, действующую на поверхность пластин площадью S = 1 м2.
10.74. Вычислить теплопроводность λ гелия при нормальных условиях.
10.75. В приближенной теории явлений переноса получается соотношение λ/η = cV. Более строгая теория приводит к соотношению λ/η = kcV, здесь k – безразмерный коэффициент, равный: (9γ – 5)/4 (γ – показатель адиабаты). Найти значения k, вычисленные по приведенной формуле и по экспериментальным данным, приведенным в табл. 12, для следующих газов: 1) аргона; 2) водорода; З) кислорода; 4) паров воды.
10.76. При нормальных условиях динамическая вязкость η воздуха равна 17,2 мкПа·с. Найти для тех же условий теплопроводность λ воздуха. Значение k вычислить по формуле, приведенной в задаче 10.75.
10.77. Найти зависимость теплопроводности λ от температуры T при следующих процессах: 1) изобарном; 2) изохорном. Изобразить эти зависимости на графиках.
10.78. Найти зависимость теплопроводности λ от давления p при следующих процессах: 1) изотермическом; 2) изохорном. Изобразить эти зависимости на графиках.
10.79. Пространство между двумя большими параллельными пластинами, расстояние d между которыми равно 5 мм, заполнено гелием. Температура T1 одной пластины поддерживается равной 290 К, другой – T2 = 310 К. Вычислить плотность теплового потока |Q|. Расчеты выполнить для двух случаев, когда давление p гелия равно: 1) 0,1 МПа; 2) 1 мПа.
10.80*. Определить коэффициент теплопроводности λ насыщенного водяного пара, находящегося при температуре T = 373 К (100 ºC). Эффективный диаметр d молекул водяного пара принять равным 0,30 нм.
10.81*. Найти среднее время ‹τ› между соударениями молекул азота, если азот находится под давлением p = 10–5 Па при температуре T = 300 К.
10.82*. Аргон находится при температуре T = 320 К. При каком давлении p один атом аргона будет испытывать в среднем тысячу столкновений.
10.83*. Хлор находится в сосуде при нормальных условиях. Оценить, за какое время τ любая из молекул хлора сместится от своего начального положения на расстояние L = 1 см.
10.84*. Сосуд кубической формы объемом V = 1 л заполнен водой. В сосуд бросили щепотку соли (NaCl). Оценить, какое время τ потребуется для становления практически равномерной концентрации соли в воде (без перемешивания). Среднюю скорость ‹ʋ› теплового движения молекул NaCl принять равной 300 м/с и среднее расстояние d между молекулами воды равным 0,3 нм.
10.85*. Плотность ρ кислорода, находящегося в сосуде, равна 1 нг/м3. Оценить среднее число (z) соударений, которое испытает одна молекула кислорода за время смещения ее от начального положения на расстояние L = 1 мм.
10.86*. Быстрые нейтроны, попав в жидкость, молекулы которых содержат водород, быстро замедляются до тепловых скоростей (ʋ ≈ 300 м/с). Тепловые нейтроны диффундируют в жидкости до тех пор, пока не окажутся захваченными ядрами водорода (протонами). Эффективное сечение σ захвата нейтронов протонами можно принять равным 0,3 барн (1 барн = 10–28 м2). Пренебрегая захватом нейтронов ядрами других атомов, входящих в состав молекул, оценить время τ жизни тепловых нейтронов в следующих жидкостях (в скобках указаны химические формулы соединений и плотности ρ этих соединений в жидком состоянии; плотности выражены в кг/м3) 1) вода (H2O; 103); 2) этанол (C2H6O; 0,81·103); 3) глицерин (C2H8O3; 1,3·103); 4) гексан (C6H14; 0,71·103); 5) октан (C8H18; 0,72·103).
Физические основы термодинамики
