
книги2 / 69
.pdf
31
Амфотерность
Белки - амфотерные электролиты, это объясняется амфотерностью аминокислот. Положительные и отрицательные заряды образуют дипольные ионы, то есть происходит ионизация молекул аминокислот, а с ними и белков.
Ионизация зависит от рН раствора белка. При определенных значениях рН,
ионизация не идет, так как в этом случае молекула становится электронейтральной:
Число положительных и отрицательных зарядов в молекуле аминокислот и в целом белка становится одинаковым - это называется изоэлектрическая точка (ИЭТ). Белки в этой точке теряют вязкость, растворимость и свойство набухать. В ИЭТ белки выпадают в осадок. Эта способность к потере зарядов используется в технологии получения белковых продуктов. Следует иметь ввиду, что каждый белок имеет свою ИЭТ.
Гидрофильность (растворимость) – это способность белков связывать на своей поверхности воду. Гидрофильность представляет собой электростатические силы притяжения между несущими заряд группами белковой глобулы и диполями воды.
Гидрофильность играет важную роль в технологии пищевых продуктов. С
этим свойством связаны такие процессы как набухание, растворимость,
водосвязывающая и жиросвязывающая способность, денатурация белков.
Набухание – это проникновение растворителя в пространство между полимерными цепями белков, приводящее к увеличению объема белковых молекул. В глобулярных белках (альбумины, глобулины яйца) между полипептидными цепями отсутствуют поперечные связи, и поэтому может идти
неограниченное набухание, (растворение) белков. В фибрилярных белках полипептидные цепи которые образуют сетчатую структуру (коллаген мяса)
32
растворение невозможно. Взаимодействие с водой коллагена заканчивается набуханием – то есть ограниченным растворением. Явление набухания широко используется в пищевой промышленности, например - приготовление теста.
Набухшие белки муки глиадин и глютелин, иначе называемые
клейковина, образуют в тесте губчато-сетчатую систему, которая придает тесту упругость и эластичность. При набухании коллагена, основного компонента мясных продуктов, с дальнейшим нагреванием и охлаждением,
образуются студни (холодец). Технологически обработанные коллаген или водоросли, применяются для получения желатина. Желатин в горячей воде легко набухает и растворяется, образуя вязкие растворы, используемые для приготовления заливных, желе.
Денатурация – это разрушение нативной структуры белка с сохранением его первичной структуры. Это сложный процесс, при котором под влиянием температуры, механического или химического воздействия, изменения рН среды и других факторов происходит разрушение вторичной, третичной,
четвертичной структур белковой молекулы и теряются функции данного белка,
в том числе гормональная и ферментативная активность. Пример денатурации – свертывание белка яиц при варке.
При денатурации белок теряет свои физические, химические и биологические свойства. Полипептидная цепь при этом развертывается и превращается в хаотический клубок.
В момент денатурации разрушается гидратная оболочка, предохраняющая белковые молекулы от слипания. После чего молекулы белка, сталкиваясь,
слипаются в виде хлопьев и выпадают в осадок. К денатурации белков может привести ряд факторов. Физические факторы, вызывающие денатурацию белков: нагревание, перемешивание, влияние ультразвука, ультрафиолетовых лучей, ионизации. К химическим факторам относятся – воздействие кислот,
щелочей, солей, тяжелых металлов, мочевины, ТХУ, гуанидина.
33
Самая распространенная – тепловая денатурация. Многие животные белки денатурируют уже при +400. Процесс денатурации белков играет важную роль в технологии получения пищевых продуктов. Выпечка хлеба, бланшировка кипятком перед консервированием овощей и фруктов, кипячение молока,
кулинарная обработка мяса и рыбы – все это связано с тепловой денатурацией белков. Тепловая обработка повышает вкусовые качества и биологическую ценность пищевых продуктов.
Так же используют для денатурации пищевых белков давление (при получении подсолнечного масла), растирание (при изготовлении крема),
воздействие кислот (для маринадов), использование спирта, встряхивание. В
ИЭТ денатурация протекает медленнее и ускоряется в кислых и щелочных растворах.
Коагуляция белков
При нагревании белков полипептидные цепи их денатурированных молекул развертываются. При этом освобождаются сульфгидрильные,
гидроксильные и другие химические группы. При взаимодействии сульфгидрильных (SH) групп денатурированных белков образуются - S – S –
дисульфидные связи, с помощью которых белки слипаются в крупные агрегаты, то есть идет коагуляция – укрупнение белковых глобул. При коагуляции образуется нерастворимый сгусток, наример – образование творога.
Крупные сгустки белка (казеин молока) не удерживаются в растворе и выпадают в осадок, то есть происходит седиментация.
Пенообразование
Белки пищевых продуктов способны к образованию высококонцентрированных систем жидкость – газ, которые называются пены.
Устойчивость пены зависит от природы белка, от его концентрации и от температуры. Белки, как пенообразователи, используются в кондитерской промышленности - получение пастилы, зефира, суфле. Структуру пены имеет хлеб.
34
Не всегда образование пен и пенок желательно. Так, при нагревании молока белки лактальбумины образуют на поверхности пенку, непроницаемую для пара. Поэтому под ней создается избыточное давление, которое помогает
«сбежать» молоку при его кипячении. Пена образуется при варке мяса, рыбы,
гороха и других белоксодержащих продуктов.
Химические свойства белков зависят от свойств аминокислот. Основные свойства аминокислот: образование мочевины, аминирование,
дезаминирование, декарбоксилирование, трансаминирование (эти реакции рассматриваются в курсе биохимии).
Важнейшее химическое свойство белков гидролиз. При гидролизе пептидные связи разрываются под действием воды и образуются свободные аминокислоты. Эта реакция катализируется ферментами класса гидролаз – протеазами.
Гидролиз играет большую роль при переваривании белков в пищеварительном тракте, при созревании мяса, сыра и в кулинарной обработке белков. При денатурации белков увеличивается их способность к гидролизу под действием ферментов, так как действию ферментов оказываются доступны не только внешние, но и внутренние пептидные связи между аминокислотами белков.
В заключение следует отметить, что при выведении из живого организма белков (молоко, мясо, икра) они подвергаются действию микроорганизмов и при хранении быстро загнивают, то есть подвергаются распаду. Поэтому большинство белковых продуктов требуют немедленного потребления.
Продукты должны быть свежими. В таких случаях при краткосрочном хранении, существенных изменений в белках не происходит.

35
3.4 Роль белков и аминокислот в питании человека
Для поддержания жизнедеятельности необходимо постоянное поступление в организм основных питательных веществ в целях обеспечения энергетической потребности, синтеза собственных структур и метаболизма. В
полном рационе человека белкам отводится важная роль. Белки в организме выполняют три основные функции:
1.Служат источником незаменимых и заменимых аминокислот. Аминокислоты используются в качестве строительных блоков при биосинтезе белков организма. Аминокислоты, поступая в организм, служат предшественниками гормонов, ферментов и других биомолекул.
2.Окисление аминокислотных радикалов вносит вклад в суммарный расход
энергии.
3. Белки оказывают непосредственное влияние на постоянство состава внутренней среды человека, то есть на гомеостаз.
Синтез белка из неорганических элементов возможен только в растениях.
В животных организмах белок синтезируется из аминокислот. Аминокислоты,
которые участвуют в синтезе белка организма, называются протеиногенными.
Все протеиногенные аминокислоты подразделяются на три класса:
незаменимые (эссенциальные), полузаменимые, заменимые.
Незаменимые аминокислоты - это такие аминокислоты, которые не могут синтезироваться в организме животных и человека и должны поступать в организм с пищей. В организм человека эти аминокислоты поступают с растительной или животной пищей, а в организм травоядных животных – только с растительным кормом. В молекулах незаменимых аминокислот разветвленная углеводородная цепь.
Абсолютно незаменимых аминокислот восемь:
L - Валин
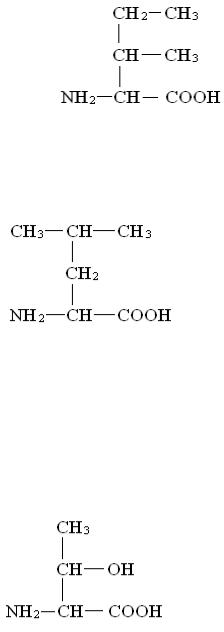
36
Валин влияет на процессы усвоения пищи и на координацию движения.
Содержится в яичном порошке, рыбе скумбрии, сое, сухом молоке, копченой колбасе, сыре, мясе. Потребность для человека в сутки составляет 3,5 – 4г.
L – Изолейцин
Нормализует усвоение пищи и рост организма. Содержится в бобовых,
сыре, копченой колбасе, минтае, фундуке. Потребность в сутки - 3 – 4г.
L – Лейцин
Влияет на процессы роста организма и функции щитовидной железы и почек. Содержится в сое, пшене, твороге, сухом молоке, сыре, мясе кроликов,
копченой колбасе, яичном порошке, рыбе, миндале. Суточная потребность - 4 –
6г.
L – Треонин
Отсутствие треонина вызывает задержку роста, уменьшение массы тела животных, их гибель. Источники: соя, творог, сухое молоко, сыр, телятина,
яичный порошок, рыба. Потребность в сутки - 2 – 3г.

37
L – Фенилаланин
Фенилаланин связан с функцией щитовидной железы и надпочечников, с
синтезом аминокислоты тирозина и гормонов тироксина и адреналина.
Источники: соя, сухое молоко, сыр, треска, яичный порошок. Суточная потребность - 2 – 4г.
Особо важное значение имеет триада аминокислот: лизин*, метионин*,
триптофан*.
L – Лизин*
Участвует в процессах кровообразования, в синтезе эритроцитов и гемоглобина крови, в процессах включения кальция в кости, в функциях печени и легких. Содержится в бобовых, сое, твороге, сухом молоке, сыре, мясе кроликов, колбасе сырокопченой, бройлерах, яичном порошке. Потребность в сутки - 3,5 – 5г.
L – Метионин*
Участвует в реакциях синтеза холина, составной части лецитина,
предупреждающего ожирение печени. Влияет на обмен жиров, фосфолипидов в печени. Играет важную роль в профилактике и лечении атеросклероза, связан с функциями витаминов В12 и фолиевой кислоты. Активирует работу надпочечников, синтез гормона адреналина. Источники: сухое молоко, сыр,

38
мясо говядина, колбаса сырокопченая, яичный порошок, скумбрия, минтай,
миндаль. Потребность в сутки - 2 – 4г.
L – Триптофан*
Триптофан участвует в синтезе сывороточных белков крови и гемоглобина,
в синтезе витамина РР – никотиновой кислоты. Содержится в сыре, горохе,
фасоли, твороге, мясе, бройлеров, яичном порошке, грибах. Суточная потребность – 1г.
Наиболее богаты незаменимыми аминокислотами: бобовые (соя), творог,
молоко (сухое), сыр (голландский), мясо (кроликов), куры, яичный порошок,
рыба (минтай), орехи, грибы.
Полузаменимые аминокислоты
Они синтезируются в организме, но в недостаточном количестве, поэтому дополнительно должны поступать с пищей. К таким аминокислотам относятся
аргинин, тирозин, гистидин.
L – Аргинин
Аргинин азотосодержащая аминокислота. Имеются данные о том, что лимитирующим фактором в белковом питании считается азот, необходимый для обеспечения азотистого баланса. Без аргинина может возникнуть экзема.
Суточная потребность - 6г.
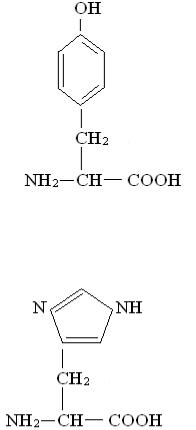
39
L – Тирозин
Тирозин легко образуется из фенил-аланина, но образование фенилаланина не происходит, поэтому при его отсутствии исчезает тирозин и возникает патология щитовидной железы, надпочечников. Суточная потребность - 3 – 4г.
L – Гистидин
Гистидин в значительном количестве содержится в гемоглобине. При недостатке гистидина снижается уровень гистамина. Из гистидина образуется гистамин, который расширяет сосуды и увеличивает проницаемость стенок сосудов. Гистидин нормализует условнорефлекторную деятельность. В организме детей гистидин не синтезируется.
Суточная потребность - 1,5 – 2г.
Заменимые аминокислоты
Эти аминокислоты синтезируются в организме в достаточном количестве из незаменимых аминокислот и других соединений. Организм может находиться без них долгое время, если с пищей постоянно поступают вещества, из которых они могут быть построены. К заменимым аминокислотам относятся остальные девять аминокислот.
3.5 Ценность и потребность белков
Отсутствие в пище хотя бы одной незаменимой аминокислоты вызывает отрицательный азотистый баланс, нарушение функции ЦНС и тяжелые клинические последствия, в том числе авитаминозы. Нехватка одной
40
незаменимой аминокислоты приводит к неполному усвоению и других незаменимых аминокислот. Питательная ценность белков определяется аминокислотным составом белка и степенью усвояемости их организмом. Белки, которые легко и полностью усваиваются организмом человека – это белки животного происхождения: так яйца, молоко и молочные продукты усваиваются на 96%, белки мяса, рыбы - на 93 – 95%. Белки, которые не полностью усваиваются организмом – это белки растительного происхождения (в %) – хлеба – на 62 – 86, овощей – на 80, картофеля и бобовых
– на 70.
Наиболее оправданными для питания являются белки, состав которых близок к аминокислотному составу организма человека. Белки, содержащие в своем составе все незаменимые аминокислоты, называются полноценными - это мясо, рыба, молоко, яйца. На первом месте стоит молоко.
Белки, в которых отсутствует одна или несколько незаменимых аминокислот, называются неполноценные - это белки растительного происхождения: зерно, овощи, фрукты.
Длительное употребление исключительно растительной пищи приводит к дисбалансу аминокислот, что нарушает многие функции организма, в том числе умственную. Особенно чувствительны к недостатку аминокислот дети.
Биологическая ценность белков может быть выражена в виде определенной шкалы. Если белки молока, содержащие все незаменимые аминокислоты принять за 100, то биологическая ценность мяса и рыбы будет 95, картофеля - 80, ржаного хлеба - 75, риса - 58, гороха - 55, пшеницы - 50.
При определении биологической ценности белков используется зависимость функционирования организма от количества незаменимых аминокислот. Для этого используется метод Митчела и Блока – показатель аминокислотного скора (а.с.). Скор выражают в процентном отношении содержания незаменимой аминокислоты в исследуемом белке к ее количеству в эталонном белке (белок молока, куриных яиц). В эталонном (идеальном) белке в 1г содержится в мг лейцина (70), фенилаланина и тирозина (60), лизина (55), валина (50), изолейцина, треонина (40), триптофана (10). Аминокислота, скор
