
Uchebnoe_posobie
.pdfЗанятие 3. Патобиохимия окислительного стресса как типового патологического процесса, значение для клиники
Цель занятия. Познакомить студентов с биохимическими основами окислительного стресса при патологических состояниях, дать представление о воздействии прооксидантных факторов на человека и функционировании антиоксидантной системы в организме, уровнях ее организации, обосновать целесообразность использования различных методов биохимического обследования больных для оценки тяжести окислительного стресса и эффективности антиоксидантной терапии.
I. Внеаудиторная самостоятельная работа студентов
1. Цель самоподготовки. После самостоятельного изучения материала студент должен знать: пути поступления и образования в организме прооксидантных факторов, принципы функционирования и уровни организации антиоксидантной системы, взаимодействие ферментных и неферментных компонентов антиоксидантной защиты, причины развития окислительного стресса, биохимические исследования, позволяющие диагностировать уровень окислительного стресса.
2. Задание для самоподготовки:
А) знать основные нозологические формы, относящиеся к «мембранной патологии».
Б) изучить метаболические основы образования и нейтрализации свободных радикалов и реактивных молекул при критических состояниях и некоторых хронических патологических состояниях.
В) Биохимические методы оценки уровня окислительного стресса и эффективности антиоксидантной терапии.
Г) изучить материалы лекционного курса, основной и дополнительной литературы, уделив особое внимание следующим основным вопросам темы:
знать строение и происхождение первичных и вторичных радикалов, реактивных молекул, иметь представление об их физиологических и патологических эффектах;
иметь четкое понятие об организации антиоксидантной системы в организме;
представлять принципы нейтрализации реактивных молекул ферментными и неферментными компонентами антиоксидантной системы;
представлять патобиохимические процессы, приводящие к формированию «мембранных патологий»;
знать способы диагностики окислительного стресса, применяемые в клинике.
21
3. Содержание практического занятия:
Развитие болезни всегда сопряжено с нарушением функций и/или структуры клеток тех или иных органов и тканей организма. На сегодняшний день имеются достаточно подробные описания того, что происходит при «поломе» в клетке, но далеко не всегда имеется возможность ответить на вопрос, по какой причине это произошло. Вместе с тем, очевидно, что любая клеточная система, хотя и функционирует по собственным законам, при патологии может выходить из-под контроля регулирующих систем организма и усугублять общую картину «полома», формируя таким образом «порочный круг»: повреждение клетки - нарушение регуляторных процессов на уровне организма как целого - повреждение клетки (в случае, если повреждающие силы выражены в большей степени, чем включающиеся параллельно с повреждением клеток противоположно им направленные приспособительные реакции). При этом нарушение функций одних клеток может быть первопричиной развития болезни, тогда как состояние других клеток ставится нарушенным вследствие развития основного патологического процесса.
При болезни клетка, в частности ее плазматическая мембрана, реагирует молекулярными изменениями, носящими как патологический, так и адаптивный характер. В настоящее время можно с убедительностью говорить о том, что произошло гигантское накопление фактических материалов о структурных изменениях клетки при патологии.
Окислительный стресс (ОС), один из наиболее распространенных видов стресса как у про- , так и у эукариот, является реакцией на многие экстремальные факторы, возникает в ответ на воздействие активных форм кислорода, обладающих высокой реакционной способностью, на структурные элементы клеток, характеризуется срывом системы антиоксидантной защиты, интенсификацией процессов свободнорадикального окисления и сопровождается накоплением в органах и тканях токсичных продуктов окислительной модификации биомолекул (белков, жиров, углеводов, нуклеиновых кислот). Продукты окислительной модификации биомолекул в большинстве случаев также обладают цито- и мембранотоксичностью, приводят к углублению повреждений в клеточных структурах и, как следствие, нарушению метаболических процессов и целостности клетки.
Вклад различных реакций свободнорадикального окисления в развитие определенных патологических процессов может существенно отличаться: в одних случаях наиболее важное значение имеют реакции перекисного окисления липидов (например, при атеросклерозе), в других – окислительное повреждение белков (нейродегенеративные заболевания), в третьих – модификация нуклеиновых кислот (опухоли).
Природные активные молекулы и радикалы в организме человека делятся на первичные свободные радикалы (•ОО- , NO•), реактивные молекулы (синглетный кислород, гипохлорит анион, пероксинитрит, гидропероксиды биомолекул) и вторичные свободные радикалы (гидроксильный радикал, алкилы, алкоксилы, пероксилы). Выделяют также третичные радикалы антиоксидантов. Чужеродные радикалы могут образовываться при воздействии на организм ультрафиолетового облучения, радиации, ксенобиотиков и др.
22
Поддержание физиологических концентраций активных форм кислорода и контролируемое течение свободнорадикальных процессов обеспечивается в организме благодаря наличию мощной системы антиоксидантной и антирадикальной защиты. Систему антиоксидантной защиты организма можно разделить на специфическую и неспецифическую. Действие факторов специфической антиоксидантной защиты направлено непосредственно на снижение уровня оксидантов в тканях. За счет неспецифической антиоксидантной защиты создаются условия, при которых снижается возможность их дополнительной генерации.
Многоуровневый характер защиты клеток от повреждающего действия активных форм кислорода обеспечивается за счет: высокой степени упорядоченности и структурированности ферментативных систем в мембранах клеток, утилизирующих кислород как универсальный акцептор электрона; относительно низких значений рО2 в тканях; наличия биоантиоксидантов.
Некоторые авторы выделяют трехступенчатый уровень организации системы антиоксидантной протекции: антикислородный, антирадикальный, антиперекисный.
В многофункциональной структуре антиоксидантной защиты организма аэробных существ отдельно выделяют антиоксидантную систему, в свою очередь, включающую множество различных компонентов. Несмотря на наличие различных вариантов классификации соединений, входящих в ее состав, в целом можно выделить ферментное и неферментное звено антиоксидантной системы. Кроме того, предложено разделять факторы антиоксидантной системы по их локализации и месту действия преимущественно на клеточные и внеклеточные.
Ферментное звено антиоксидантной системы можно представить в виде 3-х линий ферментов антирадикальной защиты (ФАРЗ):
супероксиддисмутаза – 1-я линия ФАРЗ, каталаза и селеновая глутатионпероксидаза - 2-я линия ФАРЗ,
глутатионпероксидаза, глутатионтрансфераза, пероксидаза, цитохромоксидаза, некоторые медьсодержащие оксидазы - 3-я линия ФАРЗ.
Кроме того, можно выделить ферменты прямого антиоксидантного действия (перечисленные выше) и косвенного (НАД- и ФАДзависимые дегидрогеназы). Функционирование всех ферментов взаимосвязано и взаимозависимо – продукты реакции катализируемой ферментом из одной линии антирадикальной защиты, являясь субстратами для ферментов последующих линий, одновременно могут выступать в роли их аллостерических эффекторов, как положительных, так и отрицательных. Так, перекрестная регуляция продуктами реакций характерна между такими ферментами антиоксидантной системы, как супероксиддисмутаза и каталаза. Для каталазы •ОО- является отрицательным эффектором, а Н2О2 - положительным, для супероксиддисмутазы – наоборот.
Заболевания, различные по этиологии, патогенезу и клинической картине, имеют общие проявления, связанные с избыточной продукцией и накоплением
втканях и биологических жидкостях организма различных токсичных веществ,
втом числе и радикальной природы, что становится причиной формирования синдрома эндогенной интоксикации и окислительного стресса. В условиях
23
выраженного окислительного стресса и значительной эндогенной интоксикации возникает напряжение и в определенных условиях дисфункция защитных систем и механизмов. Это, прежде всего, относится к системе иммунной и антиоксидантной защиты организма, резервы которой определяют степень выраженности и последствия различных патологических процессов.
Методы диагностики окислительного стресса.
А) экспресс-метод диагностики окислительного стресса – регистрация спонтанной или индуцированной хемилюминесценции в тканях и/или биологических жидкостях, которая зависит от уровня свободнорадикальных процессов в исследуемом биосубстрате;
Б) определение активности ферментов антиоксидантной защиты (супероксиддисмутаза, каталаза и другие) и неферментных показателей антиоксидантной системы, например тиоловых групп, витаминов Е и С или определение общей антиокислительной емкости крови амперометрическим спобом;
В) определение спектрофотометрически содержания в тканях и биологических жидкостях окисленно-модифицированных продуктов биомолекул, реагирующих с тиобарбитуровой кислотой.
Г) интегральная диагностика с математической обработкой показателей как антиоксидантного звена, так и прооксидантных факторов для комплексной оценки уровня окислительного стресса.
3,5 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
3,3 |
|
|
|
|
|
|
|
|
||
2 |
|
3,1 |
|
|
|
|
|
|
БВХЛ, у.е. |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
1,5 |
|
|
2,2 |
2,2 |
|
|
|
|
|
|
|
|
|
|
|||
1 |
|
|
|
|
|
1,95 |
|
|
|
|
|
|
|
|
|
||
0,5 |
|
|
|
|
1,2 |
|
|
|
|
|
|
|
|
|
|
||
0 |
0,296 |
|
|
|
|
|
|
|
контроль |
СД с кетоацидозом |
ОПН 1 сут |
ОПН 4 сут |
ИФ I |
ИФ II |
ИФ III |
||
|
||||||||
|
|
|
|
БВХЛ |
|
|
|
|
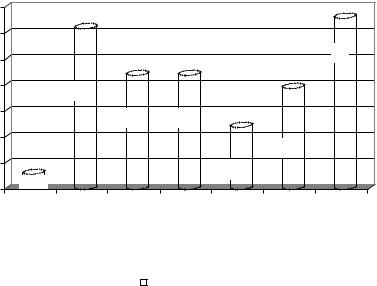
Рис. 3.1. Интенсивность БВХЛ у больных 1-й группы. |
||||||||
Сравнительные представления по наличию и выраженности эндотоксикоза и окислительного стресса можно получить при анализе данных, полученных на кафедре фундаментальной и клинической биохимии КубГМУ на основании разработанных интегральных индексов и коэффициентов. На рис. 3.1. представлены сравнительные данные по интенсивности быстрой вспышки хемилюминесценции (БВХЛ) у больных с острым ЭТ при различных патологических состояниях: сахарным диабетом (СД) 1-го и 2-го типов, острой
24
почечной недостаточностью (ОПН), ожоговой болезнью с индексом Франка (ИФ) различной степени.
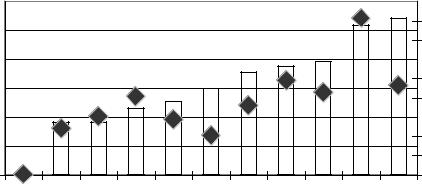
На рис.3.2. представлены данные, полученные на кафедре фундаментальной и клинической биохимии при обследовании больных различных нозологических групп, характеризующие уровень ОС (ХПН - хроническая почечная недостаточность). Полученные данные рассчитаны и представлены как интегральный показатель - коэффициент окислительной модификации биомолекул (КОМБ). Показана их взаимосвязь с индексом эндогенной интоксикации (ИЭИ).
120
100
ИЭИ, 80 % ГК 60
40
20
0
доноры |
СД 1 тип |
ИФ-I |

 Индекс эндогенной интоксикации
Индекс эндогенной интоксикации
18
16
14
12 КОМБэр.,
10 ОЕА
8
6
4
2
0
СД с кетоацидозом |
ОПН 4 сут |
ХПН III |
 Коэффициент окислительной модификации биомолекул
Коэффициент окислительной модификации биомолекул
Рисунок 3.2. Показатели ИЭИ и КОМБэр. у различных категорий больных 1-й и 2-й группы.
4.Ход практического занятия
1)программированный контроль исходного уровня знаний студентами темы занятия путем устного опроса их по вопросам для самоподготовки;
2)разбор с преподавателем сложных вопросов темы, недостаточно усвоенных студентами при самоподготовке;
3)изучение историй болезни пациентов, с диагностированным окислительным стрессом, проверка умения студентами самостоятельно оценивать результаты анализов, позволяющих определить уровень окислительного стресса, разбор клинико-лабораторных задач, изученных в процессе самоподготовки;
4)знать на какие патобиохимические явления и процессы направлена антиоксидантная терапия при различных заболеваниях;
5)изучение организации работы в лаборатории многопрофильной больницы, разбор мероприятий по проведению лабораторных тестов на выявление окислительного стресса у больных с критическими состояниями и хронической патологией;
25
6)заключительный контроль знаний студентов, студент при собеседовании с преподавателем должен понимать цель биохимических исследований, направленных на выявление окислительного стресса, решать задания для заключительного тестового контроля.
5.Клинико-лабораторные задачи
ЗАДАЧА 3.1
Женщина, 49 лет, доставлена в ожоговое отделение, где проведена операция по пересадке кожи.
Биохимические показатели в крови и плазме: быстрой вспышки хемилюминесценции – 2,107 усл. ед., активность каталазы снижена на 10%, активность супероксиддисмутазы снижена на 50 %, уровень SHгрупп снижен на 45 %, коэффициент окислительной модификации эритроцитов равен 7,8 ОЕА.
Имеются ли у больной дисбаланс в системе про-/антиоксиданты ? Насколько выражены процессы свободнорадикального окисления в тканях?
Какому показателю индекса Франка должны соответствовать данные лабораторные изменения?
Какая вспомогательная терапия может быть назначена для ускорения регенерации поврежденных тканей и предупреждения осложнений?
Задача 3.2
В синовиальной жидкости у пациента с ревматоидным артритом выявлено повышение активности супероксиддисмутазы на 58% и снижение активности каталазы на 26%.
Вопрос. Укажите за счет избыточного образования каких свободных радикалов или реактивных молекул возможно прогрессирование указанного заболевания.
Задача 3.3
В результате развития окислительного стресса у больного наблюдается преимущественная окислительная модификация липидов в крови: КОМБэр = 8,1 ОЕА.
Вопрос. Ранее развитие какого заболевания может наблюдаться у пациента с течением времени при отсутствии соответствующей эффективной антиоксидантной терапии.
Задача 3.4
У пациента с хроническим генерализованным пародонтитом средней степени тяжести (с жалобами на кровоточивость десен при чистке зубов, неприятный запах изо рта, подвижность отдельных зубов, появление болезненного ощущения в деснах и их припухлости не менее 2 раз в год) было выявлено на поверхности зубов различное количество мягкого налета и зубного камня.
При биохимическом исследовании смешанной слюны найдено:
26
1)повышение уровня максимальной вспышки хемилюминесценции на 20
%,
2)повышение содержания малонового диальдегида на 135 %,
3)снижение активности супероксиддисмутазы на 55 %
Вопрос. Какие патобиохимические процессы превалируют у данного пациента в системе прооксиданты-антиоксиданты и какие мероприятия необходимо провести для коррекции имеющихся патобиохимическимх нарушений.
Задача 3.5
У пациента с ишемической болезнью сердца наблюдалось увеличение частоты приступов стенокардии, в связи с чем он чаще стал принимать нитраты, через время эффективность проводимой терапии снизилась. В крови выявлено повышенное образование радикальной формы оксида азота (на 29%) и супероксидного анион-радикала (на 62%).
Вопрос. Чем можно объяснить снижение эффективности проводимой терапии нитратами. Назначение препаратов какой группы может нивелировать развившуюся резистентность к нитратам. Образование какого патобиохимического соединения может усугублять течение ишемической болезни сердца.
27
Занятие 4. Патобиохимическая характеристика и лабораторная диагностика сахарного диабета и состояний с нарушенным гомеостазом
глюкозы
Цель занятия. Овладение материалом темы необходимо для правильного понимания патологических биохимических процессов, происходящих в организме и приводящих к развитию различных клинических проявлений и осложнений при сахарном диабете. Полученные знания необходимы в профессиональной подготовке врача для клинической диагностики и лечения заболеваний, проявляющихся нарушенным гомеостазом глюкозы.
I. Внеаудиторная самостоятельная работа студентов.
1. Цель самоподготовки. После самостоятельного изучения материала студент должен знать: биохимические показатели углеводного и липидного обмена в норме и патологические биохимические процессы, происходящие в организме при развитии сахарного диабета и ведущие к возникновению острых и поздних осложнений, алгоритм диагностики сахарного диабета, перечень основных лабораторных анализов.
2. Задание для самоподготовки:
А) знать биохимические показатели углеводного и липидного обмена в норме и при развитии сахарного диабета.
Б) Лабораторный диагностический алгоритм при обследовании больного с сахарным диабетом В) изучить материалы лекционного курса, основной и дополнительной
литературы, уделив особое внимание следующим основным вопросам темы:
1.образование и обмен основных гормонов, регулирующих обмен углеводов в организме человека, патобиохимические процессы, возникающие при нарушении их обмена;
2.определение сахарного диабета, виды его осложнений, ключевые патобиохимические процессы, участвующие в их формировании;
3.основные показатели и методы диагностики возможных нарушений углеводного обмена, возможные ошибки при их определении с помощью лабораторных методов;
4.основные показатели и методы диагностики возможных нарушений липидного обмена при сахарном диабете;
5.основные показатели и методы диагностики возможных нарушений белкового обмена при сахарном диабете;
6.основные показатели и методы диагностики возможных нарушений электролитного обмена при сахарном диабете;
7.структура скринингового обследования на сахарный диабет, алгоритмы диагностики сахарного диабета, ранняя диагностика нарушений гомеостаза глюкозы и осложнений сахарного диабета;
28
8.различия патобиохимических процессов при сахарном диабете 1 и 2 типов, их дифференциальная диагностика с помощью лабораторных методов;
9.патобиохимические процессы при острых осложнениях (комах) сахарного диабета, дифференциальная диагностика коматозных состояний у больных сахарным диабетом с помощью лабораторных методов;
10.перечень основных анализов, необходимых при диагностики сахарного диабета и его осложнений;
11.принципы лечения сахарного диабета в соответствии с патобиохимическими процессами, возникающими при его развитии, лабораторный мониторинг эффективности проводимой терапии, профилактика развития поздних осложнений сахарного диабета;
12.современные тесты ранней лабораторной диагностики сахарного диабета (предибет, латентный диабет), перспективы их использования в клинике;
13.патобиохимические изменения при гипогликемических состояниях, их лабораторная дифференциальная диагностика;
14.принципы коррекции патобиохимических нарушений при наличии нарушений гомеостаза глюкозы.
3. Содержание практического занятия:
Сахарный диабет возникает вследствие абсолютной или относительной недостаточности инсулина. Всемирная организация здравоохранения предложила следующую классификацию сахарного диабета:
1)сахарный диабет типа 1;
2)сахарный диабет типа 2;
3)диабет, связанный с другими патологическими состояниями (заболевания поджелудочной железы, а также заболевания, связанные с избыточной секрецией гормона роста или глюкокортикоидов);
4)диабет беременных.
Инсулин — основной фактор, контролирующий накопление и метаболизм поступающих в организм энергетических субстратов. Секреция инсулина после еды облегчает поглощение, утилизацию и накопление глюкозы, жира и аминокислот. Снижение циркулирующего инсулина приводит к мобилизации эндогенных энергетических субстратов, снижает всасывание пищевых веществ. Действие инсулина касается всех главных энергетических субстратов (углеводы, белки и жиры) и реализуется в основном в печени, мышцах и жировой ткани, оказывая как антикатаболическое, так и анаболическое действие.
Общее количество глюкозы для ннсулинзависимой утилизации на периферии (вне печени) составляет около 15% от поступившего количества. Поглощение глюкозы печенью может подстраиваться к меняющейся концентрации сахара в крови за счет изменения глюкокиназной активности (о ней сказано в предыдущем разделе). Активность этого фермента зависит от присутствия инсулина и содержания углеводов в диете.
Инсулин контролирует и фосфорилирование фруктозо-6-фосфата фосфофруктокиназой. В отсутствие гормона активность этого фермента снижается, что существенно не только для гликолиза, но и для глюконеогенеза
29
(снижение фосфофруктокиназной активности способствует ускорению гликолитических реакций в обратном направлении).
Содержание гликогена в печени больных с диабетическим кетоацидозом значительно снижено, но быстро восстанавливается после введения инсулина. Этот эффект обусловлен активирующим влиянием инсулина на гликогенсинтетазу. Накоплению гликогена способствует также торможение инсулином фосфорилазы. Инсулин тормозит выход глюкозы из печена не только за счет своего влияния на синтез и распад гликогена, но и за счет ингибирования глюконеогенеза. Ключевое промежуточный этап глюконеогенеза — превращение пирувата в фосфоенолпируват — зависит от пируваткарбоксилазы и фосфоенолпируваткарбоксилазы. Последний фермент в присутствии инсулина и глюкозы ингибируется. Активность пируваткарбоксилазы под действием инсулина также снижается (угнетено высвобождение и распад жирных кислот, что ограничивает образование ацетил-КоА — аллостерического активатора пируваткарбоксилазы). Угнетение глюконеогенеза инсулин осуществляет и путем ограничения поступления в печень аминокислот, в первую очередь — аланина (главной аминокислотного предшественника глюкозы).
Действие инсулина на обмен белков сводится к увеличению поглощения аминокислот тканями, стимуляции синтеза белка, торможению распада белка и к снижению окисления аминокислот.
Инсулин стимулирует синтез жирных кислот в печени, что реализуется следующими механизмами: прямая активации ацетил-СоА-карбоксилазы, увеличение потока субстратов по пути гликолнза (то есть уровня ацетил-СоА), стимулирование утилизации глюкозы по пентозному пути, увеличение количества восстановленного НАДФ — источника водорода дли синтеза жирных кислот. Инсулин ускоряет поглощение жировой тканью триглицеридов крови, стимулируя липопротеидлипазу и ингибируя гормонзависимую триацилглицериллипазу жировых клеток. Наконец, эффект инсулина проявляется снижением содержания в печени карнитина необходимого для переноса жирных кислот через митохондриальную мембрану.
Введение инсулина или стимуляция его секреции снижает уровень калия
всыворотке. Этот эффект инсулина обусловлен стимуляцией поглощения калия мышечной и печеночной тканью. Снижение уровня инсулина вызывает рост содержания калия в крови. Влияние инсулина на обмен натрия является следствием изменения секреции катиона в почках: на фоне физиологических концентраций инсулина экскреция натрия с мочой уменьшается, а снижение уровня инсулина сопровождается увеличением экскреции натрия.
Другие гормоны, участвующие в гомеостазе глюкозы. Кроме инсулина в гомеостазе глюкозы участвуют глюкагон, гормон роста, глюкокортикоиды и адреналин. Таким образом, инсулин утилизирует и резервирует глюкозу, снижает содержание а крови глюкозы свободных жирных кислот. Глюкагон, гормон роста, глюкокортикоиды и адреналин, повышая концентрацию глюкозы
вкрови одновременно со свободными жирными кислотами, поставляют последние как альтернативное топливо.
Острые нарушения обмена веществ при сахарном диабете.
30
