
- •Федеральное государственное бюджетное образовательное учреждение высшего образования "Северо-Западный государственный медицинский университет им. И.И.
- •Определение
- •Другие определения
- •ОКС включает в себя следующие понятия:
- •Прочие понятия
- •• Коронарная недостаточность —
- •Механизм
- •Схема патогенеза тромбоформирования в интактных артериях
- •Схема патогенеза тромбоформирования в атеросклеротических артериях
- •Биохимические процессы в миокарде при ОКС
- •Установлено, что оптимальное парциальное давление в коронарных артериях, при котором митохондрии могут выполнять
- •Некоторые закономерности
- •Гибернированный миокард
- •Реперфузионный синдром
- •Скопившиеся в месте повреждения лейкоциты через сдвиги в обмене арахидоновой кислоты и выделение
- •Проявления реперфузионного синдрома:
- •Современная кардиопротекция включает воздействия на отдельные звенья патогенеза, вызывая:
- •Перспективная терапия - СК
- •Спасибо за внимание, передаю слово коллеге
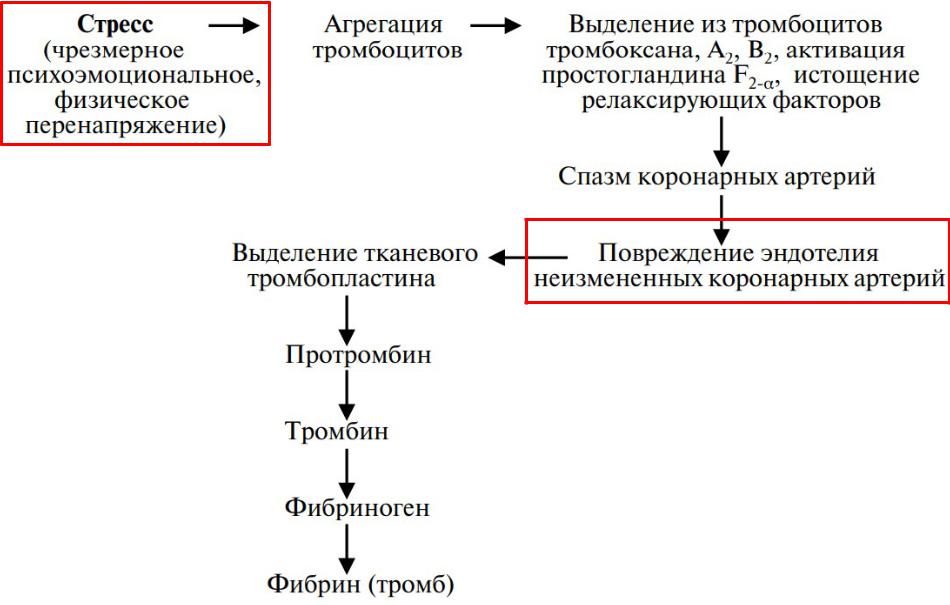
Схема патогенеза тромбоформирования в интактных артериях

Схема патогенеза тромбоформирования в атеросклеротических артериях
Биохимические процессы в миокарде при ОКС
Около 5–10% АТФ, содержащегося в миокарде, может быть израсходовано за одно сердечное сокращение. Однако уровень АТФ, как правило, остается относительно постоянным. Окислительное фосфорилирование регулируется концентрацией АДФ, другими высокоэнергетическими фосфатами и О2. Уровни глюкозы в крови и жирных кислот относительно велики, «захват» О2 миокардом из коронарного русла даже в состоянии покоя
близок к максимальному, поэтому дальнейшее его увеличение ограничено.
Установлено, что оптимальное парциальное давление в коронарных артериях, при котором митохондрии могут выполнять свои функции, — 20 мм рт. ст., при величине 5 мм рт. ст. митохондрии их утрачивают. По этой причине наиболее эффективным и простым способом увеличения продукции АТФ в соответствии с нуждами миокарда является улучшение коронарного кровотока. При дефиците доставки О2, например в случае ишемии сердца, нарушается баланс между продукцией АТФ и его потреблением, происходит сдвиг с аэробного окисления на гликолиз с истощением запаса АТФ в клетке,
нарушением проницаемости мембран, усилением выработки лактата, развитием внутриклеточного ацидоза, возникновением дисфункции ионных каналов, ведущих к увеличению уровней Nа+ и Са2+, и уменьшением К+, которые, с
одной стороны, способствуют образованию свободных радикалов, с другой — повреждению мембраны клеток. Весь комплекс метаболических расстройств, развивающихся в кардиомиоцитах, в итоге приводит к повреждению миокарда.
Некоторые закономерности
•Тромб обычно располагается над разрывом АС бляшки;
•Белый (тромбоцитарный тромб) + вазоспазм → неполная окклюзия КА → повреждение миокарда → нестабильная стенокардия;
•Смешанный (преимущественно красный – фибриновый) тромб → полная окклюзия КА → некроз → ИМ;
•Тромб → источник микроэмболов в мелких сосудах → мелкие очаги некроза → повышение уровня биомаркеров;
Кроме того:
•Полная окклюзия КА → трансмуральный ИМ → подъем ST → Q-инфаркт;
•НЕполная окклюзия КА → НЕ трансмуральный ИМ → БЕЗ подъема ST → НЕ Q-инфаркт;
+ в наше время развития реваскуляризации выделяют прерванный ИМ.
Гибернированный миокард
Транзиторная дисфункция ЛЖ, которая сохраняется после реперфузии, несмотря на отсутствие необратимых повреждений и
восстановление нормального или почти нормального коронарного кровотока, названа «оглушением» миокарда.
Истинные причины развития этого состояния до сих пор окончательно не выяснены. Объяснение причины развития «оглушения» сердца только истощением кардиомиоцитов высокоэнергетическими фосфатами оказалось несостоятельным: стимуляция экзогенными катехоламинами позволяет обнаруживать существенный контрактильный резерв. Не подтвердились предположения о выраженной зависимости сниженной сократительной способности клеток миокарда при «оглушении» от уровня клеточного Са2+. Предполагается, что одними из возможных механизмов развития «оглушения» сердца могут быть
снижение чувствительности кардиомиоцитов к Са2+ и прямое повреждающее действие свободных радикалов кислорода.
Реперфузионный синдром
У части больных вслед за эффективной реперфузией состояние сердца ухудшалось. Появились данные о травмирующем миокард действии реперфузии. Ухудшение выражалось в развитии аритмий, иногда тяжелых, недостаточности сердца,
повторных ишемических эпизодов. Эти явления обозначены как "реперфузионный синдром". Он зависит не только от глубины ишемического поражения миокарда, но и от длительности периода предреперфузионной ишемии.
Скопившиеся в месте повреждения лейкоциты через сдвиги в обмене арахидоновой кислоты и выделение лейкотриенов играют особую роль при реперфузии,
повышая число погибших клеток и вызывая вазоконстрикторные воздействия на микрососуды и неблагоприятно влияя на сохранившиеся миоциты. Большая перегрузка кальцием и выход калия из поврежденных клеток вызывает электрическую нестабильность сердца. Эти механизмы подтверждены положительным действием для профилактики и лечения реперфузионного синдрома антагонистов кальция, "скавендеров" свободных радикалов (каталазы, дисмутазы и др.), ингибицией местной воспалительной реакции (кортикостероиды).
Проявления реперфузионного синдрома:
•Контрактильная дисфункция (гибернированный миокард);
•Повреждение сосудов МЦР и отсутствие восстановления кровотока в них (феномен no- reflow);
•Реперфузионные аритмии (часто ФЖ!) и
необратимые повреждения повреждения.
Нужно понимать, что реперфузионные изменения моделируют то, что происходит при нестабильной стенокардии, когда периодически в достаточно длительные отрезки времени (10— 15 минут) происходит резкое ухудшение, а затем спонтанное восстановление коронарного кровотока.
Современная кардиопротекция включает воздействия на отдельные звенья патогенеза, вызывая:
•в одном случае вазодилатацию,
•в другом — стимуляцию аэробного окисления и увеличение тканевого уровня АТФ,
•в третьем — ингибирование образования свободных нейтрофильных кислородных радикалов и явлений агрегации,
•в четвертом — снижая микроваскулярное повреждение и последствия реперфузии.
