
755
.pdf
Na2O + 2HCl = 2NaCl + H2O |
CO2 + 2NaOH = Na2CO3 + H2O |
ZnO + 2HCl = ZnCl2 + H2O |
||
Na2O + CO2 = Na2CO3 |
CO2 + CaO = CaCO3 |
ZnO + 2NaOH = Na2ZnO2+Н2О |
||
Na2O + H2O = 2NaOH |
CO2 + H2O = H2CO3 |
|
||
|
|
|
Гидроксиды |
|
|
Кислоты |
|
Основания |
Амфотерные |
Реагируют: |
|
Реагируют: |
Реагируют: |
|
1. |
с основаниями |
|
1. с кислотами |
1. с кислотами |
2. |
с основными оксидами |
|
2. с кислотными оксидами**** |
2. со щелочами |
3. |
с солями |
|
3. с солями**** |
|
4. |
с металлами |
|
|
|
Fe(OH)2+ 2HCl = FeCl2+2H2O |
|
Fe(OH)2+2HCl = FeCl2+2H2O |
Zn(OH)2+2HCl=ZnCl2+2H2O |
|
2HNO3+CaO=Ca(NO3)2+2H2O |
|
2NaOH+SO2 = Na2SO3+2H2O |
Zn(OH)2+2NaOH = |
|
BaCl2+Н2SO4=BaSO4 +2НCl |
|
2NaOH+CuCl2=Cu(OH)2 +2NaCl |
= Na2ZnO2 + 2H2O |
|
Zn + H2SO4 = ZnSO4 + H2↑ |
|
|
|
|
|
|
|
Соли |
|
Реагируют: |
|
|
|
|
1. |
с кислотами |
|
|
|
2. |
со щелочами |
|
|
|
3. |
с солями |
|
|
|
|
|
Pb(NO3)2 + 2НCl = PbCl2↓ + 2НNO3 |
|
|
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaOH
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca(HCO3)2(раствор) + Ca(OH)2(насыщ.) = CaCO3↓ + 2H2O
(CuOH)2SO4 + H2SO4 = 2CuSO4 + 2H2O
Примечание:
1.*Таблица с названиями кислот, присущих им кислотных остатков и соответствующих солей представлены в Приложении (табл.1).
2.**С водой взаимодействуют только оксиды щелочных металлов (элементы I группы ПСЭ* - от Li до Fr) и щелочно-земельные (II группа ПСЭ – от Са до Ra).
3.***Щелочи – это растворимые в воде основания, образованные элементами I группы и II группы ПСЭ от Li до Fr от Са до Ra, соответственно.
4.****Этими свойствами обладают только щелочи.
Задачи и упражнения
Пример 1. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С → СO2 → Na2СO3 → СаСO3 → СaO → Сa(OH)2.
Решение: 1) Сначала получаем оксид углерода (IV):
С + O2 = СO2
2) Действуем на полученный оксид щелочью:
СO2 + 2NaOH = Na2СO3 + H2O
* ПСЭ – периодическая система элементов Д.И.Менделеева.
11
3) На соль действуем а) раствором гидроксида кальция:
Na2СO3 + Са(ОН)2 = СаСO3↓ + 2NaОН или б) растворимой солью кальция:
Na2СO3 + СaCl2 =СaСO3↓ + 2NaCl
4)При высоких температурах можно осуществить термическое
разложение полученной соли: tо
СаСО3 = СаО + СО2↑ 5) При взаимодействии оксида кальция с водой можно получить
гидроксид:
СаО + Н2О = Са(ОН)2.
Пример 2. Составить формулы всех возможных солей, образуемых Al(OH)3 и H2SO4. Привести их названия.
Решение: Любая соль состоит из двух остатков (кислотного и основного), поэтому целесообразно написать все остатки кислоты и основания и составить формулы солей с учетом зарядов этих остатков:
Al(OH)3 гидроксид алюминия |
H2SO4 – серная кислота |
основные остатки: |
кислотные остатки: |
[Al(OH)2]+ |
HSO4- |
Al(OH)2+ |
SO42- |
Al3+ |
|
Al2(SO4)3 – сульфат алюминия (средняя соль);
(Al(OH)2)2SO4 – сульфат дигидроксоалюминия (основная соль); Al(OH)SO4 – сульфат гидроксоалюминия (основная соль); Al(НSO4)3 – гидросульфат алюминия (кислая соль).
Вопросы для самопроверки
1.Составить формулы оксидов меди (I), хрома (III), селена (VI).
2.Написать реакцию получения гидроксида алюминия.
3.Написать формулы всех возможных средних, кислых и основных солей, образованных гидроксидом меди (II) и азотной кислотой.
4.Написать ангидриды и кислотные остатки следующих кислот: селеновой, хлорной, ортомышьяковистой.
5.Охарактеризовать химические свойства гидроксида кальция.
6.Составить уравнения реакций, позволяющих осуществить следующие превращения:
Na → NaOH → Cu(OH)2 → CuO → CuSO4.
12

Глава 3. Строение атома. Периодический закон Д.И.Менделеева. Периодическая система химических элементов
Важнейшие понятия
Строение атома: ядро, заряд ядра, электронная оболочка,дуализм электрона. Квантово-механическая модель строения атома. Квантовые числа: главное, орбитальное, магнитное и спиновое. Энергетические уровни и подуровни атома.
Принципы заполнения электронных орбиталей атома в основном состоянии: принцип Паули, правило Хунда, правило Клячковского. Электронные ѐмкости орбиталей, подуровней и уровней атома. Электронные и электронно-графические формулы атома. Характеристика свойств химического элемента и его соединений по электронной структуре атома.
Структура периодической системы: периоды, группы, их физический смысл. Порядковый номер элемента.
Периодический характер изменения химических свойств элементов. Периодический закон Д.И.Менделеева.
При изучении темы необходимо:
-Получить общее представление о строении атома: ядро, состоящее из элементарных частиц (протоны и нейтроны), электроны, а также о корпускулярно-волновом дуализме электрона. Усвоить основные принципы квантово-механической модели строения атома, суть значений квантовых чисел, позволяющих, описать состояние каждого электрона в атоме. Проследить, как происходит заполнение электронами электронных орбиталей, подуровней и уровней в атомах.
-Знать периодический закон Д.И.Менделеева, принципы построения периодической системы элементов. Особое внимание следует обратить на физический смысл порядкового номера элемента, номера периода и номера группы.
-Научиться составлять электронные и электронно-графические формулы атомов элементов, пользуясь периодической системой элементов
-Разобраться в особенностях изменений электронной структуры и свойств элементов в малых и больших периодах, группах и подгруппах. Понять, что различие в свойствах элементов главных и побочных подгрупп, обусловлено различным распределением валентных электронов в их атомах.
-Научиться прогнозировать химические свойства элементов и их соединений, исходя из положения элементов в периодической системе и электронных формул соответствующих атомов.
13
3.1. Элементарное строение атома
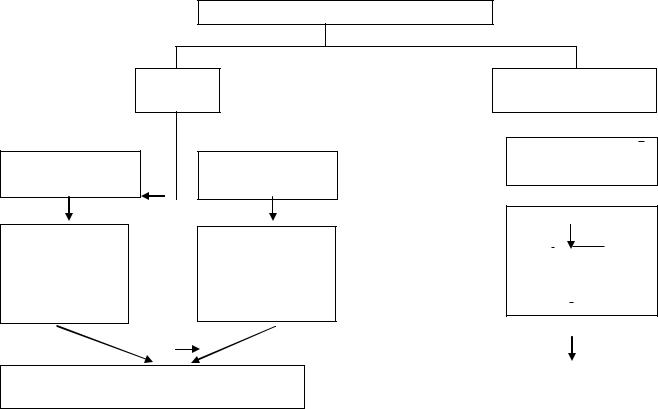
Согласно современным представлениям, атом является сложной системой.
Атом – это наименьшая, химически неделимая частица, являющаяся носителем химических свойств химического элемента. Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов.
Атом – электронейтральная система
Протоны, 1 11 ð
(общее число Z)
масса протона mp = 1a.å.ì .
заряд протона qp 1
Ядро
Нейтроны, 01 n
(общее число N)
масса нейтрона
mn = 1à.å.ì .
заряд нейтрона qn 0
Практически вся масса атома А = Z + N
Схема 3.1. Характеристика строения атома
Электронная
оболочка
Электроны, å
(общее число Э =Z)
масса электрона
me 18381 mp
заряд электрона qe 1
Ядра атомов состоят из элементарных частиц двух видов – протонов и нейтронов.
Протон – стабильная элементарная частица в составе атомного ядра с положительным зарядом, по абсолютной величине равным заряду электрона. Масса протона равна массе ядра атома легкого изотопа водорода 11 H.
Нейтрон – элементарная незаряженная частица в составе ядра атома, по массе равная массе протона.
Таким образом, заряд ядра атома определяется числом находящихся в нѐм протонов (Z). Сумма числа протонов Z и нейтронов N дает массу атома (А):
А = Z + N. (3.1.)
Вокруг ядра имеется электронная оболочка.
Электрон – элементарная отрицательная частица с массой, равной |
1 |
||
|
|
||
1840 |
|||
|
|||
массы протона. |
|
|
|
14
Число электронов в атоме (Э) равно значению положительного заряда ядра (Z), т.е. числу протонов в ядре. Поэтому атом в целом электронейтрален, (Э = Z = порядковый № элемента).
Пользуясь периодической системой Д.И.Менделеева (ПСЭ), можно определить точное число элементарных частиц в атоме. Например, элемент хлор имеет порядковый номер 17. массовое число (атомная масса) 35. Следовательно, в ядре 17 протонов и 18 нейтронов (35 – 17 = 18), вокруг ядра вращается 17 электронов.
В природе встречаются атомы одного химического элемента (с одинаковым зарядом ядра), но отличающиеся массовыми числами. Такие атомы называются изотопами. Изотопы есть почти у всех химических элементов. Массовое число элемента – это средняя величина массовых чисел всех его природных изотопов с учетом их распространенности. Например, элемент хлор имеет 2 изотопа: 1735Cl – 75,43% и 1737Cl – 24,57%. Следовательно, относительная
масса атома хлора, приблизительно, равна:
35·0,7543 + 37·0,2457 = 35,49 а.е.м.
Таким образом, химический элемент – это атомы одного вида с одинаковым положительным зарядом ядра. Положение элемента в периодической системе определяется зарядом ядра его атома. Главной характеристикой атома, а значит, и элемента, является положительный заряд ядра.
3.2.Современная квантово-механическая модель
строения атома
По современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу: проявляет одновременно свойства корпускулы (частицы) и электромагнитной волны. Как частица, электрон имеет массу и заряд. Способность пучка электронов к явлениям дифракции и интерференции свидетельствует о волновой природе электрона.
Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра в «размазанном» состоянии: быстродвижущийся электрон находится «одновременно» в любой части пространства, окружающего ядро, образуя электронное облако с неравномерной плотностью отрицательного заряда. Это можно продемонстрировать на примере модели атома водорода (рис.3.1.).
Вблизи ядра электронная плотность, практически, равна нулю (электрон здесь практически не бывает). По мере удаления от ядра электронная плотность возрастает, достигая максимального значения на расстоянии 0,053 нм, а затем снова падает. Чем прочнее с ядром связан электрон, тем более плотным по распределению заряда и меньшим по размерам будет электронное облако.
15
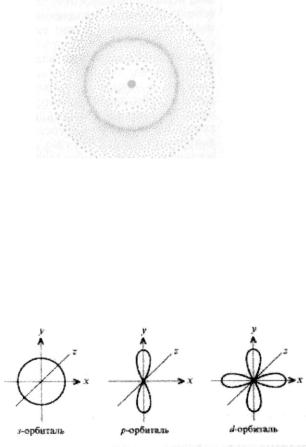
Атомная орбиталь – часть атомного пространства, в котором вероятность пребывания электрона составляет не менее 90% времени, т.е. в этом пространстве заключено 90% электронного облака.
Рис. 3.1. Электронное облако атома водорода с неравномерной плотностью.
Такая модель электронного облака в виде орбитали удобна для наглядного описания распределения электронной плотности в пространстве. Различают четыре типа электронных орбиталей: s, p, d и f. s-орбиталь имеет форму сферы; p–орбиталь – форму гантели; d-орбиталь – четырехлепесткового цветка или удвоенной гантели (рис.3.2.).
Рис. 3.2. Формы s-, p- и d-орбиталей
Электрон в атоме может принимать не любые состояния, а только определенные, в соответствии с их энергией. Электроны, которые движутся в орбиталях близкого размера, образуют энергетические уровни (слои). Последние нумеруются, начиная от ядра: 1, 2, 3, 4, 5, 6, 7.
В свою очередь, в энергетических уровнях электроны, согласно квантовомеханической модели, распределяются по подуровням (подоболочкам): s- подуровень состоит из одной s-орбитали, р-подуровень – из трѐх р-орбиталей, d-подуровень – из пяти d-орбиталей, f-подуровень – из семи f-орбиталей. Схематично распределение электронов в атоме по уровням и подуровням может быть представлено в виде диаграммы (рис.3.3.).
16

E |
|
4p |
|||
|
|
|
|
||
|
|
|
|
4f |
|
|
|
|
|
|
|
|
n=4 |
|
|
4d |
|
|
|
||||
|
n=3 |
|
3d |
|
|
|
|
|
|||
|
|
|
|||
|
|
3p |
|
||
|
|
|
|||
|
|
|
|
4s |
|
|
|
|
|
3s |
|
|
|
|
|
|
|
|
n=2 |
|
|
2p |
|
|
|
|
|||
|
|
|
|
||
|
n=1 |
|
2s |
|
|
|
|
|
|||
|
|
1s |
|
||
|
|
|
|
|
|
Рис. 3.3. Диаграмма электронных энергетических состояний атома
Для полного описания состояния каждого электрона в атоме, согласно квантово-механической модели, рекомендуется использовать четыре параметра n, l, m, S, называемых квантовыми числами.
3.2.1. Квантовые числа
Главное квантовое число (n) характеризует энергию электрона, которая определяет удалѐнность электрона от ядра атома (энергетический уровень). Значение главного квантового числа также указывает на число энергетических уровней в электронной оболочке атома. Параметр n принимает положительные целочисленные значения.
Побочное (орбитальное) квантовое число (l) характеризует энергию подуровня. Наряду с этим, орбитальное квантовое число характеризует форму
атомных орбиталей электрона, |
соответствующих данному |
подуровню. |
Побочное квантовое число в соответствии с соотношением: |
|
|
|
l = n – 1, |
(3.2.) |
принимает значения от 0 до (n – 1) |
всего n значений. |
|
Для электронов, находящихся на энергетическом уровне n, орбитальное квантовое число l может принимать значения 0, 1, 2, 3. Более 4-х подуровней на энергетических уровнях быть не может.
|
|
|
|
|
Таблица 3.1. |
|
Значения орбитального числа |
|
|
||
Численное значение l |
0 |
1 |
|
2 |
3 |
Буквенное обозначение l |
s |
p |
|
d |
f |
17
Магнитное квантовое число (m) определяет ориентацию атомных орбиталей в магнитном поле атома, а также число атомных орбиталей на
энергетическом подуровне. Число значений m: |
|
m = 2l + 1 |
(3.3.) |
Таким образом, с помощью трех квантовых чисел |
n, l, m можно |
полностью описать состояние электрона относительно ядра, т.е. охарактеризовать атомную орбиталь, на которой электрон находится.
Спиновое квантовое число (S) характеризует собственное вращательное движение электрона вокруг своей оси. Этот параметр может принимать только
два значения: |
|
S = ± 1/2. |
(3.4.) |
Значение спинового квантового числа не зависит от значений других квантовых чисел. Электроны, находящиеся на одной орбитали и обладающие противоположно направленными спинами ↑↓ (вращение по и против часовой стрелки), называются спаренными, а одиночный электрон на орбитали называется неспаренным.
3.2.2. Основные принципы (правила) заполнения атомных орбиталей
Принцип Паули (принцип запрета): В атоме не может быть двух электронов, обладающих одинаковыми свойствами (одинаковыми значениями всех четырех квантовых чисел). Следовательно, на одной орбитали могут быть только два электрона с противоположно направленными спинами (↑↓).
Правило Гунда (Хунда): При данном значении l (в пределах одного подуровня) электроны располагаются в соответствии с максимальным суммарным спином.
Принцип наименьшей энергии (правило Клечковского): Электроны в основном состоянии в атоме распределяются по энергетическим уровням и подуровням так, чтобы их суммарная энергия была минимальной.
Энергия электрона, в основном, описывается главным (n) и побочным (l) квантовыми числами, поэтому сначала заполняются те подуровни, для которых сумма (n + l) является минимальной. Например, согласно данным, приведенным табл.3.2., заполнение электронами подуровня 3d начнется только после полного заполнения подуровня 4s, т.к. энергия последнего меньше.
Таблица 3.2.
Характеристика энергии подуровней с помощью квантовых чисел
подуровень |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
n + l |
1+0=1 |
2+0=2 |
2+1=3 |
3+0=3 |
3+1=4 |
3+2=5 |
4+0=4 |
4+1=5 |
При одинаковых значениях суммы (n + l) для двух подуровней сначала идѐт заполнение электронами подуровня с меньшим значением n. Например,
при одинаковых значениях энергий подуровней 3d и 4p (n + l = 5) , в первую очередь заполнится уровень 3d, характеризующийся меньшим значением n (см.
табл. 3.2.).
18

3.2.3.Максимальное количество электронов на орбитали, подуровне и уровне
Максимальное количество электронов на одной орбитали, в соответствии с принципом Паули, равно двум:
|
|
|
|
Nm = 2 å . |
(3.5.) |
||
Максимальное количество электронов |
в подуровне, в соответствии с |
||
принципом Паули и соотношением орбитального и магнитного квантовых чисел, равно:
|
|
|
|
|
|
Nl = 2(2l + 1) å . |
(3.6.) |
||
Таким образом, максимальное число электронов в: |
|
|||
s-подуровне (l = 0) равно 2 (s2); |
|
|||
p-подуровне (l = 1) |
равно 6 (р6); |
|
||
d-подуровне (l = 2) |
равно 10 (d10); |
|
||
f-подуровне (l = 3) равно 14 (f14). |
|
|||
Максимальное количество электронов на каждом энергетическом уровне
может быть рассчитано по формуле, предложенной Паули:
Nn = 2n2 å , (3.7.)
где n – номер энергетического уровня или главное квантовое число. Более 32 электронов на одном уровне ни у одного элемента не известно.
Максимальное количество электронов на последнем (внешнем)
энергетическом уровне равно восьми. На предпоследнем уровне – не может быть больше восемнадцати электронов.
3.2.4. Запись электронной структуры (конфигурации) атомов. Электронная и электронно-графическая формулы
Для записи распределения электронов в атоме по уровням и подуровням (электронная конфигурация) используют электронные или электроннографические формулы.
Электронная формула (а). Цифра показывает номер заполняемого электронного уровня, буква – подуровень, верхний индекс, справа от буквы, соответствует числу электронов на данном подуровне.
Электронно-графическая формула (б). Энергетический уровень также изображается цифрой. Подуровень, в свою очередь, делится на квантовые ячейки (энергетические состояния, определяемые числом возможных значений магнитного квантового числа m (3.3.)). Ячейку принято графически изображать прямоугольником, направление спина электрона – стрелкой. Согласно принципу Паули, в одной такой ячейке не может быть более двух электронов (если два, то они спарены).
Неспаренные (одиночные) электроны называются валентными, они участвуют в образовании химических связей атома элемента с другими атомами.
19
Пример 1. Электронные структуры атомов
водорода:
↑ |
|
|
|
|
а) 1s1; б) 1s |
|
|
|
|
хлора: |
|
|
|
|
↓↑ |
↑↓ ↓↑ |
↑↓ ↑↓ |
↑↓ |
↑↓ ↑↓ ↑ |
а) 1s22s2p63s2p5; б) 1s |
2s |
2p |
3s |
3p |
3.2.5.Семейства химических элементов
Взависимости от того, какой энергетический подуровень в атоме заполняется электронами последним, различают s-, p-, d-, f-элементы (семейства).
s-элементами называются элементы, в атомах которых электронами
заполняется s-подуровень внешнего уровня. Общая электронная формула для элементов этого семейства: ns1-2. На s-подуровне максимально возможно наличие только 2 электронов, поэтому в каждом периоде периодической системы имеется только 2 s-элемента. Эти элементы составляют главные подгруппы I и II групп периодической системы. Всего 14 s-элементов.
р-элементы характеризуются заполнением р-подуровня внешнего уровня. Их общая электронная формула: ns2p1-6. Элементы этого семейства составляют главные подгруппы III – VIII групп и шесть последних элементов каждого со 2-го по 6-ой периоды периодической системы. Всего 30 р- элементов.
d-элементы – это семейство элементов, в атомах которых идѐт
заполнение d-подуровня второго снаружи уровня, при этом на внешнем уровне имеется один (чаще два) электрона. Общая электронная формула: (n-1)d1-10ns1-2. Это семейство составляют элементы побочных подгрупп I – VIII, в больших периодах (с 4-го по 6-ой) находятся по 10 элементов между s- и р-элементами. Известно 38 d-элементов.
f-элементы отличаются тем, что в атомах этих элементов электроны
заполняют f-подуровень третьего снаружи уровня, а на внешнем уровне сохраняется два электрона. Общая электронная формула: (n-2)f1-14ns2. В периодической системе эти элементы выделены в виде самостоятельных рядов: лантаноиды и актиноиды (по 14 элементов). Всего 28 f-элементов.
3.3.Периодический закон и периодическая система элементов Д.И.Менделеева в свете современных представлений о строении
атомов
При рассмотрении электронных конфигураций атомов можно наглядно проследить периодичность изменения свойств химических элементов, открытую впервые Д.И.Менделеевым. Периодическая система элементов
20
