
634
.pdf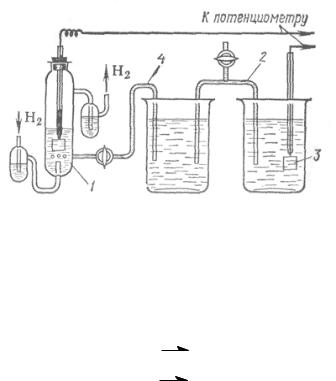
|
0 |
|
0,059 |
|
|
a2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|||
eH eH |
|
|
|
|
lg |
|
|
|
|
|
|
|
|
||||
2 |
|
aH |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
e0 |
|
|
0,059 |
lg a2 |
|
|
0,059 |
lg a |
|
||||||||
|
|
|
H 2 |
||||||||||||||
H |
|
|
|
2 |
|
|
H |
|
|
|
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
lg a2 |
|
2 lg a |
H |
; |
|
lg a |
H 2 |
lg P |
|
||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
H 2 |
||||
( PH 2 - парциальное давление водорода).
|
|
|
e |
|
0,059 lg a |
|
|
|
0,059 |
lg P |
|
|||
|
|
|
H |
H |
|
|
|
|||||||
|
|
|
|
|
|
|
2 |
|
|
H2 |
(7.7) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
При PH |
1ат уравнение (7.7) примет вид: |
|
||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
e |
H |
= 0,059 ∙ lga + |
или |
|
е |
Н |
= − 0,059pH, |
|
||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
||
т.к. |
− lgaH+= pH |
|
|
|
|
|
|
|
|
(7.8) |
||||
Рис. 3. Схема установки для измерения потенциалов:
1 - водородный электрод; 2 - сифон; 3 - металлический
электрод, у которого измеряется потенциал; 4 - сифон.
3. Хлоридсеребряный электрод.
|
|
Ag+ |
|
Cl- - электродные |
|
Ag |
AgCl, KCl |
AgCl |
+ |
||
|
|
|
K+ |
|
Cl- процессы |
eXC |
KCl |
+ |
|||
eXC |
|
eAg0 0,059 lg a |
Ag |
|
(7.9) |
|||
|
|
|
|
|
|
|
|
|
a |
|
|
|
ПРAgCl |
, |
|
|
|
Ag |
|
|
|
|
|
|||
|
|
|
aCl |
|
|
|
||
|
|
|
|
|
|
|
||
81
где |
ПРAgCl |
- |
произведение |
растворимости |
||
малорастворимого электролита AgCl. |
|
|||||
Подставив значение aAg в (7.9), получим: |
||||||
eXC |
e0 |
0,059 lg |
ПРAgCl |
|
|
|
|
|
|||||
|
Ag Ag |
|
|
aCl |
|
|
|
|
|
|
|
||
eAg0 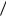 Ag 0,059 lg ПРAgCl
Ag 0,059 lg ПРAgCl
или, учитывая, чтоeAg0 Ag
const eXC0 ,
eXC eXC0 0,059 lg aCl .
0,059 lg aCl ,
0,059 lg ПРAgCl
(7.10)
Потенциал хлоридсеребряного электрода зависит от активности хлорид-ионов, т.е. от активности раствора KCl и температуры. В насыщенном растворе KCl ехс = 0,21В (приложение, табл. 9).
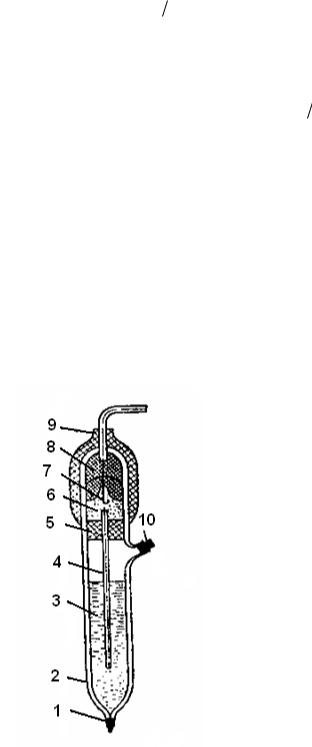
Рис. 4. Схема хлоридсеребряного электрода:
1 − нить асбестовая;
2 − корпус;
3− насыщенный раствор КCl;
4− электролитический ключ; 5, 8 − резиновые пробки;
6− полость;
7− контактный полуэлемент;
9− колпачок;
10− пробка
82

4. Каломельный электрод. Hg│Hg2Cl2, KCl
eкал
Электродные процессы: Hg2Cl2 → Hg22+ + 2Cl−
KCl → K+ +Cl−
e |
|
е0 |
|
0,059 |
lg a2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||||||||
кал |
|
|
|
Hg |
2 |
|
|
Hg 2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
e0 |
|
|
|
0,059 |
lg ПР |
|
|
0,059 |
lg a2 |
|
||||||||
|
|
|
|
|
|
|
||||||||||||
|
Hg |
|
|
|
2 |
|
|
|
|
Hg 2 Cl2 |
2 |
|
Cl |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
e0 |
|
0,059 |
lg ПР |
|
const e0 |
|
|
|||||||||||
|
|
|
|
|||||||||||||||
Hg |
|
|
|
2 |
|
|
|
|
Hg 2 Cl2 |
|
|
|
кал |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
е |
|
е0 |
0,059 lg a . |
(7.11) |
|
|
||||||||||||
кал |
|
|
|
кал |
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
Потенциал |
|
|
каломельного |
|
электрода |
зависит |
от |
|||||||||||
aCl или |
|
от |
|
активной концентрации |
раствора |
KCl |
||||||||||||
(приложение, табл. 9), в насыщенном растворе KCl |
eкал = |
|||||||||||||||||
0,25 В. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
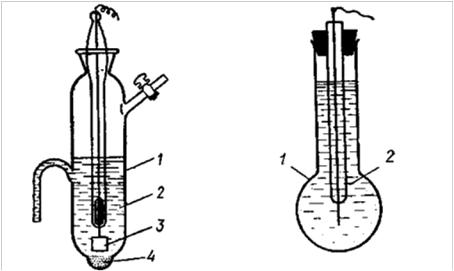
Рис. 5. Конструкции |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
каломельного электрода: |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
– пористая перегородка, |
||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
– платиновый контакт, |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
3 |
– слой ртути, |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
4 |
– каломель, |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
5 |
– |
насыщенный |
раствор |
||||
|
|
|
|
|
|
|
|
|
|
|
KCl, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
– |
|
электролитический |
||||
|
|
|
|
|
|
|
|
|
|
|
ключ. |
|
|
|
|
|
|
|
5. Окислительно-восстановительный электрод.
Pt |
|
aox, ared |
aox + ne |
|
ared - электродный |
|
|||||
|
|
||||
еh |
|
|
процесс. |
||
|
|
|
83 |
|
|
Платина - переносчик электронов от восстановителя к окислителю.
e |
|
e0 |
|
0,059 |
lg |
aox |
, |
|
h |
|
|
|
|||||
|
h |
|
n |
|
ared |
|
||
|
|
|
|
|
(7.12) |
|||
|
|
|
|
|
|
|
|
|
где eh0 - стандартный окислительно-восстановительный потенциал при аох=аred = 1моль/л (приложение, табл. 8).
6. Хингидронный электрод
Хингидронный электрод – состоит из гладкого платинового электрода и находящегося в исследуемом
растворе хингидрона (рис.6).
(Pt) | хг, Н+
Хингидрон (хг) – это эквимолекулярное соединение хинона С6Н4О2 и гидрохинона С6Н4(ОН)2.
C6H4 (OH)2 ↔ C6H4O2 + 2H+ + 2ē – электродный процесс. Константа равновесия (Кр) этого процесса равна:
|
|
|
|
[C H |
O ] [H ]2 |
|
[H ]2 , т.к. |
[C |
H O ] |
1 |
|||||||
|
|
K p |
|
|
6 |
4 2 |
|
|
6 |
4 2 |
|
||||||
|
|
|
|
[C6 H4 (OH)2 |
[C6 H4 (OH)2 ] |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
Уравнение Нернста для хингидронного электрода: |
|||||||||||||||||
e |
|
е0 |
|
|
|
0.059 |
lg [H ]2 |
или |
|
|
|
|
|||||
ХГ |
|
|
|
|
|
|
|
||||||||||
|
ХГ |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
ХГ |
е0 |
|
|
0.059 lg[ H ] , т.к. lg[H ]2 2 lg[ H ] |
(7.13) |
|||||||||||
|
ХГ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Зная, что |
|
pH lg a , уравнение (7.13) принимает вид: |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
е0 |
0.059 рН |
|
|
(7.14) |
||||
|
|
|
|
|
|
|
|
|
ХГ |
ХГ |
|
|
|
|
|
||
где |
|
е0хг |
|
|
– |
стандартный |
потенциал |
хингидронного |
|||||||||
электрода, равный 0,6990 В при 298К (приложение, табл. 9) .
7. Стеклянный электрод
Стеклянный электрод — это стеклянный шарик с толщиной стенок 0,06-0,1 мм., наполненный раствором кислоты или соли, в который для контакта погружена платиновая проволочка (рис.7). Поверхность стекла такого шарика в растворе приобретает потенциал, величина
84
которого зависит от концентрации водородных ионов в растворе. Поэтому в области рН от 2 до 9 стеклянные электроды можно рассматривать как идеальные водородные электроды; его потенциал зависит линейно от рН раствора:
eст = e0ст + 0,059lgaH+ |
(7.15) |
где eст – потенциал стеклянного электрода.
В щелочных средах стеклянный электрод проявляет функции металлического электрода, обратимого по отношению к ионам щелочных металлов. Введение в стекло лития увеличивает область применимости стеклянного электрода до рН = 13.
Со стеклянными электродами можно проводить измерения рН в присутствии окислителей, восстановителей, каталитических ядов, а также в присутствии ионов тяжёлых металлов.
Рис. 6. Схема хингидронного |
Рис.7. Схема стеклянного |
|
|
электрода: |
электрода: |
1. |
стеклянный сосуд |
1. тонкостенный |
2. |
исследуемый раствор |
стеклянный шарик |
3. |
платиновый электрод |
2. раствор с известным |
4. |
хингидрон |
значением рН |
85
Вычисление водородного показателя раствора (рН) потенциометрическим методом (при t = 250)
а) водородо-водородный гальванический элемент
Pt (Н2)│ Н+станд ║KCl║ Н+│(H2) Pt
eН станд eH
eН станд. eН0 0,059 lg aH 0,
т.к. eН0 0, аН 1 моль л , lg aH lg1 0. eH eH0 0,059 lg aH 0 0,059 pH , т.к. lg aH pH .
E eН станд. eН 0 0,059 рН
pH E (7.16) 0,059
б) каломельно-водородный гальванический элемент
Hg│насыщ. Hg2Cl2│насыщ. KCl ║KCl║ H+│(H2) Pt
eкал |
eН |
E eкал eН |
eкал 0,059 рН , |
рН Е eкал , 0,059
eкал.насыщ. = 0,2420В при 250С (приложение, табл. 9), тогда
pH E 0,2420 (7.17) 0,059
в) хингидронно-водородный гальванический элемент
Pt │хингидрон, Н+ ║KCl║ H+│ (H2) Pt
|
eхг |
eН станд |
e0 |
0,6990В при 250 |
С (приложение, табл.9) |
ХГ |
|
|
|
|
86 |

E eХГ |
|
eН ; |
|
|
|
|
|||||
e |
ХГ |
e |
0 |
|
0,059 рН; |
e0 |
0В |
||||
|
|
|
ХГ |
|
|
|
Н |
|
|
||
|
|
|
|
pH |
e0 Е |
|
|
|
|
||
|
|
|
|
ХГ |
(7.18) |
|
|
||||
|
|
|
|
0,059 |
|
|
|||||
рН 0,6990 Е . 0,059
г) хингидронно-каломельный гальванический элемент
Pt│хингидрон,Н+║KCl║насыщ. Hg Cl , насыщ. KCl│Hg |
||
|
2 |
2 |
eхг |
|
eкал. насыщ. |
E eХГ |
eкал. , |
|
eХГ 0,6990 0,059 рН ,
eкал.насыщ. 0,2420В (приложение, табл.9),
Е0,6990 0,059 рН 0,2420
0,4570 0,059 рН ;
pH |
0,4570 E |
(7.19) |
|
0,059 |
|||
|
|
д) хингидронный концентрационный или водородный концентрационный гальванический элемент
Pt│хингидрон,Н + ║KCl║ H +, хингидрон│ Pt |
|||
|
1 |
2 |
|
e1 хг |
|
|
e2 хг |
или |
|
|
|
Pt (H )│H |
+ ║KCl║ H |
+│(H ) Pt |
|
2 |
1 |
2 |
2 |
e1 H |
|
|
e2 H |
В качестве одного из растворов используют буферную смесь (10 см3 0,1н HCl с 90 см 3 0,1н KCl) с рН 2,04 (t = 250C)
или 2,08 (t = 180C).
pH 2,04 |
E |
. (7.20) |
|
||
0,059 |
||
|
|
|
87

Пример 7.1. Вычислить потенциал медного электрода в 200 мл раствора, содержащего 0,16 г CuSO4 при 250С.
Решение
gCuSO 0,16г; |
Vр ра 200мл. |
4 |
|
1. Молярная концентрация раствора CuSO4:
C |
|
|
g 1000 |
|
0,16 1000 |
0,005 моль . |
M |
|
|
||||
|
|
MCuSO V |
|
160 200 |
л |
|
|
|
|
|
|||
|
|
|
4 |
|
|
|
2. Активность ионов меди в растворе:
f = 0,573 (приложение, табл. 10),
aCu 2 f CM 0,573 0,005 0,002865 моль л.
3. Электродный потенциал:
e e0 |
0,059 |
lg a |
|
|
||
|
|
2 |
||||
|
|
n |
Cu |
|
|
|
|
|
|
|
|
||
0,34 |
|
0,059 |
lg 0,002865 0,265B. |
|||
2 |
|
|||||
|
|
|
|
|
||
Пример 7.2. Вычислить электродвижущую силу гальванического элемента при 250С,если:
|
|
|
(C ) |
|
|
0,1 моль |
кг |
; (С |
) |
|
|
0,01 моль |
. |
|||||||||
|
|
|
|
|
m CuSO |
|
|
|
|
m TlCl |
|
|
|
кг |
|
|||||||
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Электродные процессы |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
K Cu+2+2e |
= Cu |
|
1 восстановление |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
K Cu |
|
CuSO4 |
|
KCl |
|
|
TlCl |
|
Tl A |
|
|
А Tl - |
|
|
|
Tl+ |
|
2 окисление |
||||
|
|
|
|
|
|
|
e |
|
|
|
||||||||||||
+ |
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
eCu |
|
|
eTl |
|
|
Сu+2 |
+ 2Tl = Cu0 + 2Tl + |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
окис- |
восста- |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
литель новитель |
|
|
|
|
|||||||
Решение
eCu0 0,34B (приложение, табл.7); eTl0 0,335B;
(Cm )CuSO |
0,1 |
моль |
; (Сm )TlCl |
0,01 |
моль |
. |
4 |
|
кг |
|
|
кг |
|
|
|
|
|
|
|
1. Активность ионов меди в растворе:
aCu 2 f (Cm )Cu 2 0,154 0,1 0,0154 моль кг.
88

2. Активность ионов таллия в растворе:
aTl f (Cm )Tl 0,876 0,01 0,00876 моль кг.
3. Электродный потенциал меди:
e |
e0 |
|
0,059 |
lg a |
|
|
||
|
|
2 |
||||||
Cu |
Cu |
2 |
|
Cu |
|
|
||
|
|
|
|
|
||||
|
|
|
|
|
|
|||
0,34 |
0,059 |
|
lg 0,0154 0,2865B. |
|||||
2 |
|
|||||||
|
|
|
|
|
|
|
||
4. Электродный потенциал таллия: eTl eTl0 0,059 lg aTl
0,335 0,059 lg 0,00876 0,456B.
5.Э.Д.С. гальванического элемента:
E eок евос eCu eTl 0,2865 ( 0,456) 0,743B.
Пример 7.3. Вычислить при 250С Э.Д.С. концентрационной цепи, составленной из серебряных электродов, погруженных в 0,1н и 0,01н раствора AgNO3. При этой температуре эквивалентные электропроводности растворов AgNO3 соответственно равны 9,43 и 10,78
См∙м2/кмоль.
Решение
C1 0,1н; |
С2 0,01н; |
|
|
|
|
|
9,43См м2 |
; |
10,78См м2 |
. |
|
1 |
|
кмоль |
2 |
|
кмоль |
|
|
|
|
||
1. Кажущиеся степени диссоциации растворов AgNO3:
V ;
l Ag lNO3 5,32 6,26 11,58См м2 кмоль;
|
|
|
1 |
|
|
9,43 |
0,814; |
|
|
|
2 |
|
10,78 |
0,931. |
||
1 |
|
|
2 |
|
|
|||||||||||
|
|
|
|
|
11,58 |
|
|
|
|
|
11,58 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. Активность растворов AgNO3:
а1 1 С1 0,814 0,1 0,0814 моль л ; а2 2 С2 0,931 0,01 0,00931 моль л.
89

3. Э.Д.С. концентрационной цепи:
K Ag |
|
AgNO3 0,1н |
|
|
|
KCl |
|
|
|
AgNO3 0,01н |
|
Ag A |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
- |
e1 |
|
||||||||||||
|
|
|
|
|
|
|
|
e2 |
|||||
E e |
e |
|
e0 |
0,059 |
lg a |
|||||||||||
|
|
|
|
|||||||||||||
|
1 |
2 |
|
|
|
Ag |
|
n |
|
|
1 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
e0 |
|
0,059 |
lg a |
|
|
0,059 |
lg |
a1 |
; |
|||||||
|
2 |
|
|
|
||||||||||||
Ag |
|
|
n |
|
|
|
|
|
|
n |
|
a2 |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
E |
0,059 |
lg |
0,0814 |
|
|
0,056B. |
||||||||||
|
1 |
0,00931 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
Пример 7.4. Вычислить произведение растворимости AgJ при 250С, если потенциал серебряного электрода, погруженного в насыщенный раствор AgJ, равен 325 мВ.
Решение
eAg = 325мВ = 0,325В.
1.Активные концентрации ионов Ag+ и J- в насыщенном растворе:
e Ag |
eAg0 |
0,059 lg a |
Ag |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg a |
|
|
|
(eAg eAg0 ) |
|
|
(0,325 0,799) |
|
|
|||||||||
Ag |
|
|
|
|
|
|
0,059 |
|
|
|
0,059 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
8,0339; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
a Ag |
10 8,0339 9,249 10 9 моль л ; |
|
|
|
||||||||||||||
a J |
a Ag 9,249 10 9 |
моль л . |
|
|
|
|
||||||||||||
2. Произведение растворимости AgJ: |
|
|
|
|
||||||||||||||
|
ПР a |
Ag |
a |
J |
(9,249 10 9 )2 8,555 10 17. |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Пример 7.5. Вычислить редокс-потенциал в системе |
||||||||||||||||||
SnCl │SnCl , если |
a 2 |
0,01моль |
л |
, а 4 |
0,001моль |
. |
|
|||||||||||
2 |
|
4 |
|
|
|
|
Sn |
|
|
|
|
|
|
Sn |
л |
|
|
|
90
