
634
.pdf
Решение
a |
|
2 |
0,01 моль |
л |
; |
|
а 4 0,001 моль |
; |
||||||||||
|
Sn |
|
|
|
|
|
|
|
Sn |
л |
|
|||||||
eh |
0,153B (приложение, табл.8). |
|
||||||||||||||||
|
|
|
|
|
Sn+4 + 2e |
|
|
|
|
Sn+2 |
|
|||||||
|
|
|
|
|
ox |
|
|
|
|
|
|
|
|
|
red |
|
||
e |
|
e0 |
|
0,059 |
|
lg |
aox |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||||||
h |
|
h |
|
n |
|
|
|
ared |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
e |
|
0,153 |
0,059 |
lg |
0,001 |
|
0,1235B. |
|||||||||||
|
|
|
|
|
||||||||||||||
h |
|
|
2 |
|
0,01 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
Пример 7.6. Вычислить редокс-потенциал клеточного
сока, если Э.Д.С. цепи:
Pt│aox, ared║KCl║KCl, AgCl│Ag составляет 0,25В.
|
|
Решение |
|
|
E 0,25B; |
eXC 0,21B. |
|
||
E eh eXC eh E eXC |
||||
0,25 0,21 0,36B. |
|
|
||
Пример |
7.7. Вычислить |
термодинамические |
||
характеристики G, ΔS, ΔH, теплоту (qравн.) |
и константу (Ка) |
|||
равновесного |
процесса, |
протекающего |
в |
гальваническом |
элементе:
+ Pt (Cl20) │ HCl aq, AgCl │AgТВ −
Электродвижущая сила гальванического элемента (Е) при 298К составляет 1,0132В, а температурный коэффициент
( dTdE ) P 0,000477 B K .
Решение
1. В гальваническом элементе протекают гальванические реакции:
91

Катод (окисление) |
Agтв + Cl- |
AgClтв + е |
Анод (восстановление) |
(1/2)Cl2 + e |
Cl- |
|
Agтв + (1/2)Cl2 |
= AgClтв |
2. Стандартное изменение изобарно-изотермического потенциала вычисляют по уравнению:
n - число отданных или принятых электронов в электрохимическом процессе.
G n F E, (7.20)
G 1 96500 1,0132 109238 Дж моль.
G < 0, что свидетельствует о самопроизвольном протекании процесса.
3. Стандартное изменение энтропии электрохимического процесса вычисляют по уравнению:
dE |
|
||
S n F |
|
|
. (7.21) |
|
|||
dT P |
|||
S 1 96500 0,000477 46,031 Дж моль К .
4. Стандартное изменение энтальпии электрохимического
процесса вычисляют по уравнению:
H G T S
H 109238 298 46,031 122955,24 Дж моль
H < 0, электрохимический процесс экзотермичен.
5. Константу равновесия электрохимического процесса вычисляют по формуле:
92

lg Ka |
|
G |
|
||||
|
|
|
|||||
2,303 |
R T |
||||||
|
|
|
|
||||
lg Ka |
|
109238 |
|
19,14; |
|||
|
|
|
|
||||
|
8,314 |
|
|||||
|
|
2,303 |
298 |
||||
Ka 1019,14 1,38 1019.
6.Теплоту равновесного процесса образования AgCl при бесконечно малой силе тока (ΔG) вычисляют по формуле:
q0равн T S 298 46,031 13717,24 Дж моль,
где q0равн - теплота, выделяющаяся работающим гальваническим элементом.
7.Теплоту предельно необратимого процесса, протекающего при полном отсутствии полезной работы (Апол), вычисляют по формуле:
qнеобр0 H 129955 Дж моль,
где q0необр - стандартная (табличная) теплота образования AgCl, которую можно либо измерить экспериментально, либо вычислить с помощью закона Гесса по результатам калометрических измерений. Результаты определения q0необр электрохимическим и калометрическим методом
совпадают.
Потенциометрический анализ
Потенциометрический анализ основан на зависимости концентрации анализируемого раствора электролита от
величины электродного потенциала. |
|
|
|
Прямая |
потенциометрия |
применяется |
для |
определения рН, концентрации ионов Na+, K+, Ca+2, Mg+2, Cl-, NO3- и других в почве, клеточном соке, природных водах и других объектах.
93

Метод потенциометрического титрования основан на определении точки эквивалентности и объема титранта по
скачку потенциала.
Е |
|
E/ V |
|
(1/2)E скачок |
|
|
|
|
потенциала |
|
|
Т.Э. |
VT |
Т.Э. |
V |
|
|
|
T |
Рис. 7. Интегральная кривая |
Рис. 8 Дифференциальная |
потенциометрического |
кривая потенциомет- |
титрования |
рического титрования |
Пример 7.8. Определить массу нитрата серебра, содержащегося в 100 мл анализируемого раствора, если при титровании 20 мл этого раствора 0,1н раствором NaCl получены следующие данные:
VNaCl, |
14 |
18 |
19 |
19,5 |
19,9 |
20,0 |
20,1 |
20,5 |
22 |
25 |
мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е, |
520 |
542 |
570 |
589 |
629 |
704 |
737 |
757 |
786 |
791 |
мВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Построить интегральную и дифференциальную кривые титрования.
Гальваническая цепь:
Ag |
|
AgNO3, KNO3 |
|
KCl, Hg2Cl2 |
|
Hg |
|
|
|
||||
|
|
Cx |
|
0,1н |
||
94
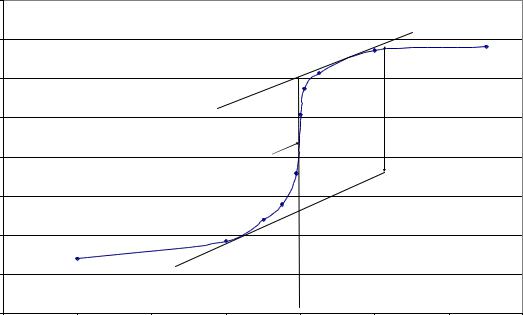
Решение
1.Построить интегральную кривую потенциометрического титрования раствора AgNO3 раствором NaCl по данным,
|
850 |
|
|
|
|
|
|
|
л, м В |
800 |
|
|
|
|
|
|
|
750 |
|
|
|
|
|
|
|
|
и а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
скачок |
|
|
ц |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
потенциала |
|
|
н |
|
|
|
|
|
|
|
|
700 |
|
|
|
|
|
|
|
|
о т е |
|
|
|
|
|
|
|
|
|
|
|
|
|
(1/2)E |
|
|
|
п |
|
|
|
|
Т.Э. |
|
|
|
д н ы й |
650 |
|
|
|
|
|
|
|
600 |
|
|
|
|
|
|
|
|
т р о |
|
|
|
|
|
|
|
|
э л е к |
550 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
500 |
|
|
|
|
|
|
|
|
450 |
|
|
|
|
|
|
|
|
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
|
|
|
|
объем NaCl, мл |
|
|
|
|
приведенным в условии.
Рис. 9. Интегральная кривая титрования
2. Построить дифференциальную кривую титрования. Произведем расчет данных для построения дифференциальной кривой титрования:
|
E |
520 |
542 |
570 |
589 |
629 |
704 |
737 |
757 |
780 |
791 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
- |
22 |
28 |
19 |
40 |
75 |
29 |
20 |
23 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
14,0 |
18,0 |
19 |
19,5 |
19,9 |
20,0 |
20,1 |
20,5 |
22,0 |
25,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
- |
4,0 |
1,0 |
0,5 |
0,4 |
0,1 |
0,1 |
0,4 |
1,5 |
3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
- |
5,5 |
28,0 |
38,0 |
100 |
750 |
290 |
50 |
15,3 |
3,7 |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
95 |
|
|
|
|
|

3. Определить точку эквивалентности по кривым титрования:
Т.Э.= 20 мл.
Рис. 10. Дифференциальная кривая титрования
3. Определить титр NaCl по AgNO3:
T |
|
|
CнNaCl |
ЭAgNO |
|
0,1 169,88 |
0,016988 |
г |
. |
|
|
3 |
|
||||||
|
|
|
|
||||||
|
NaCl |
AgNO3 |
1000 |
|
1000 |
|
мл |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
4.Определить массу AgNO3, содержащегося в 100 мл (0,1 л) анализируемого раствора:
mAgNO TNaCl |
VNaCl |
Vа. р. |
|
|
|
V |
|||||
3 |
AgNO3 |
|
|||
|
|
||||
|
|
пробы |
|
||
mAgNO3 0,016988 20 10020 1,6988г.
Литература: [1], глава X, с. 238 – 266
96

Варианты домашних заданий к теме 7
1.Вычислить при 250С потенциал электрода, состоящего из металла, погруженного в раствор его соли:
№ |
Металл |
Соль |
V раствора, |
Масса |
варианта |
|
|
мл |
соли,г |
|
|
|
|
|
1. |
Zn |
ZnSO4 |
200 |
3,22 |
2. |
Pb |
Pb(NO3)2 |
120 |
0,25 |
3. |
Cd |
CdCl2 |
200 |
3,66 |
4. |
Zn |
ZnCl2 |
250 |
10,46 |
5. |
Cu |
CuSO4 |
300 |
0,48 |
6. |
Cd |
Cd(NO3)2 |
100 |
5,33 |
7. |
Ag |
AgNO3 |
500 |
0,85 |
8. |
Zn |
ZnCl2 |
750 |
1,02 |
9. |
Cd |
Cd(NO3)2 |
840 |
22,18 |
10. |
Zn |
ZnSO4 |
650 |
10,46 |
11. |
Ag |
AgNO3 |
250 |
52,00 |
12. |
Cu |
CuSO4 |
450 |
72,00 |
13. |
Ag |
AgNO3 |
375 |
6,34 |
14. |
Cd |
CdCl2 |
75 |
1,35 |
15. |
Pb |
Pb(NO3)2 |
700 |
2,31 |
2.Вычислить при 250С ЭДС гальванического элемента, составленного из металлических электродов, погруженных в растворы солей. Привести схему гальванического элемента, соответствующие уравнения электродных процессов, указать направление электрического тока.
№ |
Элект- |
Электро- |
См1, |
Элект- |
Электро- |
См2 |
|
род 1 |
лит 1 |
моль/л |
род 2 |
лит 2 |
моль/л |
|
|
|
|
|
|
|
1. |
Ag |
AgNO3 |
0,1 |
Cu |
CuSO4 |
1,0 |
2. |
Cd |
Cd(NO3)2 |
0,1 |
Zn |
ZnSO4 |
0,1 |
3. |
Cd |
CdCl2 |
0,01 |
Zn |
ZnCl2 |
0,1 |
4. |
Cu |
CuSO4 |
0,1 |
Pb |
Pb(NO3)2 |
1,0 |
5. |
Cd |
CdCl2 |
1,0 |
Ag |
AgNO3 |
0,1 |
6. |
Cd |
Cd(NO3)2 |
0,1 |
Pb |
Pb(NO3)2 |
1,0 |
7. |
Zn |
ZnSO4 |
0,1 |
Zn |
ZnSO4 |
0,01 |
8. |
Ag |
AgNO3 |
1,0 |
Ag |
AgNO3 |
0,01 |
9. |
Cu |
CuSO4 |
0,1 |
Cu |
CuSO4 |
1,0 |
10. |
Pt (H2) |
KOH |
0,01 |
Pt (H2) |
KOH |
0,1 |
11. |
Pt (H2) |
H2SO4 |
0,1 |
Pt (H2) |
H2SO4 |
0,01 |
12. |
Cd |
CdCl2 |
0,01 |
Cd |
CdCl2 |
0,1 |
13. |
Pb |
Pb(NO3)2 |
0,1 |
Pb |
Pb(NO3)2 |
1,0 |
14. |
Ag |
AgNO3 |
1,0 |
Pb |
Pb(NO3)2 |
0,1 |
15. |
Zn |
ZnCl2 |
0,01 |
Zn |
ZnSO4 |
0,1 |
|
|
|
97 |
|
|
|
3.Вычислить редокс-потенциал в окислительновосстановительных системах при заданных значениях
активностей окислителя и восстановителя, стандартного редокс-потенциала и температуре 250С.
№ |
Окислительно |
aRed |
aOX |
варианта |
-восстановительная система |
|
|
|
|
|
|
1. |
Fe+3/Fe+2 |
0,01 |
0,01 |
2. |
Hg+2/Hg2+2 |
0,1 |
0,3 |
3. |
Cu+2/Cu+1 |
0,3 |
0,2 |
4. |
Co+3/Co+2 |
0,5 |
1,0 |
5. |
Sn+4/Sn+2 |
0,8 |
0,1 |
6. |
Cr+3/Cr+2 |
0,15 |
0,60 |
7. |
2H+/H2 |
0,2 |
1,0 |
8. |
V+3/V+2 |
1,5 |
0,25 |
9. |
[Fe(CN)6]-3/[Fe(CN)6]- 4 |
0,75 |
0,50 |
10. |
Hg+2/Hg2+2 |
0,75 |
0,15 |
11. |
Mn+3/Mn+2 |
0,25 |
1,0 |
12. |
Fe+3/Fe+2 |
0,50 |
0,25 |
13. |
Cu+2/Cu+1 |
0,35 |
0,10 |
14. |
Sn+4/Sn+2 |
0,01 |
0,15 |
15. |
Cr+3/Cr+2 |
0,60 |
0,01 |
4. Вычислить рН и aH в растворе по данным таблицы:
№ |
|
t0C |
|
рНстанд. |
Вариа |
Гальванический элемент |
E, В |
электро |
|
нта |
|
|
|
да |
1. |
Хингидронно-водородный станд. |
18 |
0,400 |
- |
2. |
Водородно-каломельный насыщ. |
25 |
0,760 |
- |
3. |
Насыщ. каломельно-водородный |
18 |
0,2528 |
- |
4. |
Насыщ. каломельно-хингидронный |
18 |
0,360 |
- |
5. |
Норм. каломельно-водородный |
25 |
0,297 |
- |
6. |
Хингидронно-насыщ. каломельный |
18 |
0,119 |
- |
7. |
Хингидронный концентрационный |
18 |
0,194 |
2,08 |
8. |
Хингидронно-насыщ. каломельный |
18 |
0,337 |
- |
9. |
Насыщ. каломельно-водородный |
25 |
0,434 |
- |
10. |
Хингидронный концентрационный |
18 |
0,260 |
2,08 |
11. |
Водородный концентрационный |
18 |
0,300 |
2,08 |
12. |
Хингидронно-каломельный насыщ. |
18 |
0,337 |
- |
13. |
Насыщ. каломельно-водородный |
18 |
0,410 |
- |
14. |
Хингидронно-каломельный насыщ. |
18 |
0,245 |
- |
15. |
Хингидронно-каломельный насыщ. |
18 |
0,300 |
|
|
98 |
|
|
|

5. Вычислить термодинамические характеристики G, S, H, qравн., константу равновесия Ка, протекающую в элементе химической реакции, которую установить на основе электродных реакций по э.д.с. гальванического элемента (Е),
dE |
||
|
|
. |
|
||
dT P |
||
№ |
|
Т,К |
dE |
4 |
|
|
||
вар. |
Гальванический элемент |
|
|
|
10 |
|
, |
|
|
|
|
||||||
|
dT P |
|
|
|
||||
|
|
|
|
B K |
|
|
E, B |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
1. |
Ag │ нас.AgCl ZnCl2 aq │ Zn |
273 |
|
-2,1 |
|
|
1,0171 |
|
2. |
Ag │ нас.AgBr ZnBr2 aq │ Zn |
273 |
|
+1,06 |
|
|
0,8410 |
|
3. |
Pb │ PbCl2, HCl AgClaq │ Ag |
298 |
|
-1,86 |
|
|
0,4900 |
|
4. |
Pb │ нас.PbJ2 KJ, AgJaq │ Ag |
298 |
|
-1,73 |
|
|
0,2135 |
|
|
|
|
|
|
|
|
|
|
5. |
Ag │ AgCl, HCl Hg2Cl2 aq │ Hg(Pt) |
298 |
|
+3,38 |
|
|
0,0455 |
|
|
|
|
|
|
|
|
|
|
6. |
Zn │ нас.ZnSO4║нас.CuSO4 │ Cu |
288 |
|
-4,29 |
|
|
1,0934 |
|
|
|
|
|
|
|
|
|
|
7. |
(Pt)Hg HgO,KOHaq║нас.KCl,Hg2Cl2 aq │Hg(Pt) |
292 |
|
-3,71 |
|
|
0,1636 |
|
|
|
|
|
|
|
|
|
|
|
CKOH = 0,01н, СKCl = 0,01н |
|
|
|
|
|
|
|
8. |
Zn │ ZnCl2, AgClaq │ Ag |
273 |
|
-4,02 |
|
|
1,015 |
|
|
|
|
|
|
|
|
|
|
|
а = 0,05н |
|
|
|
|
|
|
|
9. |
Pb│Pb(CH3COO)2║Cu(CH3COO)2 │ Cu |
288 |
|
+4,10 |
|
|
0,4764 |
|
10. |
Pb│ PbCl2, HCl Hg2Cl2 aq│ Hg(Pt) |
288 |
|
+1,45 |
|
|
0,5356 |
|
11. |
Ag │ нас.AgCl ZnCl2 aq │Zn |
273 |
|
-2,1 |
|
|
1,0171 |
|
12. |
Zn │ ZnSO4║CuSO4 │ Cu |
288 |
|
-4,25 |
|
|
1,0934 |
|
13. |
Pb │ нас.PbJ2 KJ, AgJ │ Ag |
298 |
|
-1,38 |
|
|
0,2107 |
|
|
a = 1,0н |
|
|
|
|
|
|
|
14. |
Cd│CdCl2∙2,5H2O нас.CdSO4, PbCl2 Pb |
298 |
|
-4,80 |
|
|
0,1880 |
|
|
|
|
|
|
|
|
|
|
15. |
Ag │ AgCl, KCl Hg2Cl2 aq │Hg(Pt) |
343 |
|
-2,37 |
|
|
0,2477 |
|
|
|
|
|
|
|
|
|
|
|
a = 1,0н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
99
6. Определите содержание компонента в г/л, если при потенциометрическом титровании получены данные, указанные в таблице. Постройте дифференциальную и интегральную кривые титрования.
№ |
А.Р./VА.Р, |
Титрант/ СТ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мл |
моль∙экв/л |
|
|
|
|
Экспериментальные данные |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
1. |
NaCl/10 |
AgNO3/0,20 |
|
V |
, мл 20 |
22 |
24 |
24,5 25 |
25,1 25,5 |
|||||||||
|
|
|
|
AgNO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E, мВ 330 340 369 387 515 604 641 |
||||||||||||||
|
|
|
|
|
|
|||||||||||||
2. |
NaOH/10 |
HCl/0,21 |
|
VHCl, мл |
12,0 14,0 14,5 15,0 15,5 16,0 |
|||||||||||||
|
|
|
|
pH |
|
|
|
10,0 |
9,58 |
9,20 |
5,80 |
2,45 |
2,15 |
|||||
3. |
HCl/20 |
NaOH/0,11 |
|
VNaOH, мл 18,0 |
19,0 20,0 20,1 21,0 |
|
22,0 |
|||||||||||
|
|
|
|
pH |
|
|
|
2,28 |
|
2,69 |
7,00 |
|
10,6 |
11,4 |
|
11,6 |
||
|
|
|
|
|
|
|||||||||||||
4. |
AgNO3/20 |
NaCl/0,12 |
|
VNaCl, мл 18,0 19,0 19,5 20,0 |
20,1 22,0 |
|||||||||||||
|
|
|
|
E, мВ |
|
|
670 |
652 |
|
634 |
518 |
441 |
383 |
|||||
|
|
|
|
|
|
|
|
|
|
|||||||||
5. |
KCl/20 |
AgNO3/0,20 |
|
V |
, мл 20,0 22,0 |
24,0 24,5 |
25,0 |
|
25,5 |
|||||||||
|
|
|
|
AgNO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E, мВ |
|
|
328 |
|
342 |
370 |
|
388 |
517 |
|
646 |
|||
6. |
NaCl/10 |
Hg(NO3)2/0,05 |
|
VHg ( NO ) |
, мл |
15,0 17,0 17,5 18,0 18,5 19,0 |
||||||||||||
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E, мВ |
|
|
|
411 442 457 613 700 709 |
||||||||||
|
|
|
|
|
|
|
|
|||||||||||
7. |
KCl/20 |
Hg(NO3)2/0,11 |
|
VHg ( NO ) |
, мл |
18,0 |
19,0 19,5 20,0 20,5 22,0 |
|||||||||||
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E, мВ |
|
|
|
552 |
570 589 704 737 797 |
|||||||||
8. |
CH3COOH/ |
KOH/0,10 |
|
VKOH , мл 18,0 19,0 19,5 20,0 20,5 21,0 |
||||||||||||||
|
20 |
|
|
pH |
|
|
|
5,71 |
6,04 |
6,35 |
8,79 11,22 11,51 |
|||||||
|
|
|
|
|
|
|
||||||||||||
9. |
KOH/10 |
HCl/0,20 |
|
VHCl , мл 12,0 |
14,0 |
14,5 15,0 15,5 16,0 |
||||||||||||
|
|
|
|
pH |
|
|
|
10,12 |
|
9,56 |
9,28 5,90 |
2,55 |
|
2,25 |
||||
|
|
|
|
|
|
|||||||||||||
10. |
CH3COOH/ |
NaOH/0,01 |
|
VNaOH ,мл 16,0 |
17,0 17,5 18,0 18,5 19,0 |
|||||||||||||
|
25 |
|
|
pH |
|
|
|
5,60 |
|
5,85 |
6,10 |
|
6,50 |
9,70 |
|
10,3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
11. |
HCl/20 |
NaOH/1,00 |
|
VNaOH ,мл 0,5 |
|
0,9 |
|
1,0 |
|
1,1 |
1,5 |
|
2,0 |
|||||
|
|
|
|
E, мВ |
|
|
416 |
|
457 |
693 |
|
929 |
970 |
|
988 |
|||
|
|
|
|
|
|
|
|
|
|
|
||||||||
12. |
AgNO3/15 |
KCl/0,10 |
|
VKCl , мл 5,0 |
|
6,0 |
|
7,0 |
8,0 |
9,0 10,0 |
||||||||
|
|
|
|
E, мВ |
|
|
406 |
382 |
|
181 |
128 |
106 |
97 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
13. |
H2SO4/10 |
KOH/0,10 |
|
VKOH , мл 0,0 |
|
0,5 |
|
1,0 |
1,5 |
2,0 |
2,5 |
|||||||
|
|
|
|
E, мВ |
|
|
398 |
420 |
|
700 |
970 |
988 |
|
995 |
||||
14. |
KOH/20 |
HCl/0,21 |
|
VHCl , мл 10,0 12,0 14,0 |
15,0 |
15,5 |
|
16,0 |
||||||||||
|
|
|
|
pH |
|
|
|
10,2 |
10,0 |
9,58 |
5,80 |
2,45 |
2,15 |
|||||
|
|
|
|
|
|
|
|
|
||||||||||
15. |
HCl/20 |
Hg(NO3)2/0,11 |
|
VHg ( NO ) |
|
, мл 10,0 |
18,0 19,0 |
20,0 20,5 21,0 |
||||||||||
|
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E, мВ |
|
|
314 |
552 570 |
704 757 |
790 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
