
2946
.pdf11
Лабораторная работа № 1 РАСПОЗНАВАНИЕ МИНЕРАЛЬНЫХ УДОБРЕНИЙ
Цель работы. Используя качественные химические реакции, идентифицировать вещества в предложенных образцах минеральных удобрений.
Приборы и посуда.
Стеклянные пробирки или стеклянные колбы на 30-50 см3. Стеклянные палочки.
Воронка. Часовое стекло. Водяная баня. Плитка.
Фильтровальная бумага. Универсальная индикаторная бумага. Фенолфталеиновая бумага. Промывалка с дистиллированной водой.
Реактивы.
Хлористоводородная кислота, раствор (1:1). Азотная кислота, раствор (1:1).
Оксалат аммония, 2,0% раствор. Гидроксид натрия, 2,0% раствор. Серная кислота (конц.).
Дифениламин кристаллический. Нитрат серебра, 0,05 М раствор. Ацетат натрия, 2,0 М раствор.
Гексанитрокобальтата (III) натрия (Na[Co(NO2)6]), 2,0 М раствор свежеприготовленный.
Ход определения. Образцы удобрений находятся в отдельных банках под номерами. Состав содержимого банок известен преподавателям.
1.Около 0,1 г полученного образца перенесите в пробирку или колбу на 30-50 см3, добавьте 10 см3 дистиллированной воды, тщательно перемешайте. Если образец полностью растворится, это могут быть: KNO3, KCl, NH4NO3, (NH4)2SO4, NH4H2PO4, Ca(H2PO4)2. Дальнейшую идентификацию этих веществ проведите, как изложено в пунктах 3-9.
2. Если на дне пробирки останется осадок, это, возможно, карбонат кальция. Раствор слейте с осадка, к осадку добавьте по каплям раствор НСl
. Если в осадке – карбонаты, то происходит вспенивание вследствие выделения СО2:
СаСО3 + 2НСl = СаСl2 + Н2О + СО2−
В растворе можно обнаружить ионы Са2+. Если к его отдельной порции добавить раствор оксалата аммония, то выпадает белый кристаллический осадок:
Са2+ + С2О42- = ↓ СаС2О4

12
3.Если образец полностью растворится в воде, то к его отдельной порции сначала добавьте раствор NaОН и нагрейте до 30-50оС. Если при этом появляется запах аммиака и «синеет» универсальная индикаторная бумага, смоченная в воде, или становится малиновой фенолфталеиновая
бумага, то это могут быть или NH4NO3, или (NH4)2SO4, или NH4H2PO4. Для идентификации каждого вещества необходимо установить, какой анион присутствует в растворе, выполняя качественные реакции.
4.Реакция на ион NO3-.
На часовое стекло поместите 1-2 капли исследуемого раствора, рядом каплю концентрированной серной кислоты, дифениламин. При соединении капель в случае присутствия NO3- возникает синее окрашивание.
|
H |
+ H++ NO3- |
|
|
|
2 |
N |
N |
N |
+ H2O |
|
|
дифениламин |
|
дифенилбензидин |
|
|
|
|
|
|
(синяя окраска) |
|
5. Реакция на ион SO42-.
1 см3 исследуемого раствора поместите в пробирку, добавьте раствор хлорида бария, затем раствор соляной кислоты. При наличии сульфат-ионов выпадает белый осадок сульфата бария, не растворяющейся при добавлении раствора соляной кислоты.
SO42- + Bа2+ = BaSO4↓
6. Реакция на ион Н2РО4-.
1 см3 исследуемого раствора поместите в пробирку и добавьте раствор нитрата серебра. При наличии ионов Н2РО4- выпадает бурый осадок.
Н2РО4- + АgNO3 = ↓AgH2PO4
7.Если ионов аммония в растворе нет, то исследуемый образец – или
KNO3, или KCl, или Ca(H2PO4)2. Для идентификации надо установить качественными реакциями, какие ионы присутствуют в растворе.
8.Реакция на ион К+.
Для обнаружения ионов калия к 1 см3 раствора добавьте 0,5 см3 раствора ацетата натрия, 0,5 см3 раствора гексанитрокобальтата (III) натрия, постоянно помешивая стеклянной палочкой. Для образования кристаллического ярко-желтого осадка смесь нагрейте до 500С.
2K+ + Na 3[Cо(NO2)6] = ↓K2Na[Cо(NO2)6] + 2Na+
9. Реакция на ион Сl-.
Для обнаружения Сl- к отдельной порции раствора добавьте раствор нитрата серебра и несколько капель раствора азотной кислоты. Если выпадает белый осадок, то образец содержит хлорид калия.
Ag+ + Cl– = ↓AgCl

13
На свету со временем осадок становиться фиолетовым или даже черне-
ет:
hν
2AgCl = ↓2 Ag + Cl2 −
В разбавленных растворах кислот (HNO3, H2SO4) AgCl не растворим, но легко растворим в растворе аммиака NH3·Н2O:
↓AgCl + 2 NH4 OH = [Ag(NH3 )2 ]Cl + 2H2 O
10.Реакция на ион H2PO4-.
Если при добавлении нитрата серебра выпадает бурый осадок, то образец,
вероятно, Ca(H2PO4)2.
H2PO4- + AgNO3 = ↓AgH2PO4
11.Реакция на ион Са2+.
Наличие ионов кальция в растворе докажите качественной реакцией с оксалатом аммония
Са2+ + С2О42- = ↓ СаС2О4 белый осадок
12.Если раствор не взаимодействует с нитратом серебра, то, вероятно, образец содержит КNO3. Докажите наличие ионов NO3-, как изложено в пунктах 4.
На основе проведённых качественных реакций сделайте вывод о составе образцов.
4. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ НЕКОТОРЫХ УДОБРЕНИЙ В ПОЧВЕ
4.1. Методы количественного анализа
Цель количественного анализа - установить концентрацию компонентов в анализируемом объекте.
Методы количественного анализа можно разделить на химические, физико-химические и физические (инструментальные).
В любом методе количественного анализа можно выделить следующие основные этапы: планирование анализа; отбор пробы; измерение массы или объема образца; растворение твердого образца; отделение веществ, мешающих обнаружению определяемого компонента; определение концентрации компонента; вычисления и оценка результатов анализа.
В химических методах количественного анализа используют аналитическую реакцию определяемого компонента (X) с выбранным реактивом (R): ZXX + ZRR = ZPP. Аналитические реакции, как правило, проводят в растворах. В зависимости от типа реакции и способа её проведения выде-
14
ляют два химических метода количественного анализа: весовой анализ (гравиметрия) и объемный анализ (титриметрия).
В гравиметрическом анализе определяемое вещество (Х) отделяют от других компонентов анализируемого объекта осаждением подходящим реактивом (R), и, в конце концов, получают в виде чистого труднорастворимого соединения известного состава (ХR). Массу осадка (mXR) определяют взвешиванием и используют для вычисления массы определяемого компонента (mx):
ZXX + ZRR = ZXR XR
По закону эквивалентов mXR / mx = ЭXR/ ЭX. Отсюда
mX = mXR· ЭX / ЭXR
В объемном анализе к раствору определяемого компонента (Х) до-
бавляют раствор реагента (R) с точно известной концентрацией (рабочий раствор или титрант).
ZXX + ZRR =ZPP
Чтобы рассчитать количество Х, надо знать концентрацию раствора реагента и уметь зафиксировать тот момент, когда он будет добавлен в стехиометрическом (эквивалентном) отношении (точка эквивалентности).
Так как оба вещества находятся в растворе, то удобнее производить расчет по измеренным объемам раствора реактива (VR) и анализируемого раствора (VX).
По закону эквивалентов в аналитической форме: объёмы взаимодействующих друг с другом веществ реагируют в эквивалентных количествах.
VR·HR = VX·HX.
Отсюда
HX= VR·HR / VX
Так как
НХ = mX· 1000 / ЭХ · VX, то
mX = VR·HR ·ЭХ /1000, где
VR – объём реагента, HR – эквивалентная концентрация реагента, ЭХ – эквивалентная масса исследуемого вещества Х по реакции с реагентом R.
Физико – химические и физические методы анализа отличаются большей чувствительностью и экспрессностью. В анализе этими методами, как правило, требуется незначительное количество анализируемого вещества, и содержание определяемого элемента в образце может быть чрезвычайно мало. Физико – хи-
15
мические методы анализа подразделяются на следующие группы: электрохимические, оптические, хроматографические. К физическим методам анализа относятся радиофизические, радиометрические, масс – спектрометрические.
Потенциометрия объединяет методы определения веществ и различных физико-химических величин, основанные на измерении электродвижущих сил (ЭДС) обратимых электрохимических цепей. Электрохимическая цепь (электрохимическая ячейка) включает в себя два правильно подобранных электрода, погруженных в исследуемый раствор. Один электрод – индикаторный. Величина потенциала индикаторного электрода – функция концентрации (точнее активности) определяемых ионов в растворе. Второй электрод – электрод сравнения. Величина его потенциала в процессе всех измерений остается постоянной, так как не зависит от концентрации определяемых ионов. Следовательно, ЭДС электрохимической ячейки также является функцией от концентрации определяемых ионов.
Впотенциометрии используют два основных класса индикаторных электродов. Электроды, на межфазных границах которых протекают реакции с участием электронов, называют электроннообменными. К ним относятся металлические и окисли- тельно-восстановительные электроды. Электроды, на межфазных границах которых протекают ионообменные реакции, называют мембранными или ионообменными, ионоселективными. К ним относятся электроды: стеклянные, жидкостные на основе ионных ассоциатов, газовые, твердые с гомогенной или гетерогенной мембраной, а также электроды для измерения активности биологических веществ.
Воснове расчетов в потенциометрическом анализе лежит уравнение Нернста:
ϕ = const + 0,059/n ·lg ai, где
n – заряд потенциалопределяющего иона или число электронов, участвующих в реакции,
аi – активность потенциалопределяющих ионов, для электроннообменных электродов отношение активностей окисленной и восстановленной форм вещества.
В прямой потенциометрии или ионометрии концентрацию ионов в растворе определяют непосредственно по величине ЭДС электрохимической ячейки.
16
Оптические методы основаны на измерении эффектов взаимодействия веществ с электромагнитными волнами оптического диапазона. Оптический диапазон – область электромагнитных волн с длиной волн (λ) от 100 до 100000 нм (1нм = 10-9 м). Оптический диапазон подразделяют на ультрафиолетовую область (100 – 380 нм); видимую область (380 – 760 нм); инфракрасную область (760 – 10 5нм).
Вещества, или их растворы, поглощающие излучение в видимой области, характеризуются собственной окраской. Методы анализа, основанные на измерении интенсивности светопоглощения окрашенного раствора, называют фотометрическими. В зависимости от длины волны, ширины полосы поглощения и способа измерения интенсивности светового потока различают фотометрию (измерение интенсивности светопоглощения с применением светофильтров и призм в ближней ультрафиолетовой и видимой областях); спектрофотометрию (измерение интенсивности светопоглощения с применением призм и дифракционных решеток в диапазоне ультрафиолетовой, видимой и ближней инфракрасной областях).
Основной закон светопоглощения – это закон Бера: светопоглощение окрашенного раствора прямо пропорционально концентрации раствора и толщине поглощающего слоя:
А= ε С l, где
С– концентрация определяемого компонента, моль/л; l – толщина слоя раствора, равная длине кюветы, см;
ε - молярный коэффициент светопоглощения.
Если С=1 моль/л, l=1 см, то А=ε – оптическая плотность такого раствора называется молярным коэффициентом светопоглощения.
Любое фотометрическое определение концентрации вещества включает следующие этапы: подготовку пробы и перевод определяемого компонента в раствор; перевод определяемого компонента в форму, поглощающую свет; регистрацию сигнала при оптимальных условиях; расчеты по результатам измерений.
4.2 Подготовка почвы к химическому анализу
4.2.1 Первоначальная обработка образца
17
Подготовка почвы к химическому анализу заключается в придании взятому в поле образцу однородности с тем, чтобы каждая отобранная для анализа проба в полной мере отражала состав всего образца (была репрезентативной).
Однородность образца достигается его тщательным перемешиванием, измельчением структурных частей, составляющих твердую фазу почвы, удалением макроскопических включений органического и минерального происхождения, а также новообразований. Включения и новообразования размещены в почвенной массе неравномерно, поэтому их целесообразно отделить от вмещающей их массы и исследовать отдельно.
Отобранные в поле образцы почв подвергаются предварительному высушиванию до воздушно-сухого состояния с целью прекращения в них микробиологических процессов и связанных с ними биохимических изменений. Высушивание необходимо еще и потому, что воздушно-сухую почву легко просеивать через сито при подготовке её к анализу и можно хорошо перемешать при взятии средней пробы. Не подвергаются сушке лишь те образцы, которые предназначены для определения быстро изменяющихся показателей во влажной почве: нитратов, биологической активности почв.
Высушивают образцы почвы в хорошо проветриваемом помещении, свободном от лабораторных газов (хлороводорода, аммиака и др.). Почву распределяют по листу плотной оберточной бумаги ровным слоем толщиной не более 2 см, измельчая крупные комья до размеров 1,5 – 2 см и удаляя при этом включения и новообразования. Последние взвешивают и сохраняют для анализа. Очень важно по возможности полнее выбрать корни и другие растительные остатки из свежего образца. Высохнув вместе с почвой, эти остатки становятся хрупкими, легко крошатся. И их полное удаление становится невозможным, особенно в случае сильно затвердевающих почв тяжелого гранулометрического состава. Проверив, на месте ли этикетка, образец почвы прикрывают бумагой от пыли и оставляют в таком состоянии на несколько дней, периодически перемешивая почву до тех пор, пока она не высохнет.
Весь высушенный образец почвы (рис.1,а), обычно 600 –800 грамм, размещают на листе чистой бумаги (б), тщательно удаляют из него крупные корни, включения и новообразования, если
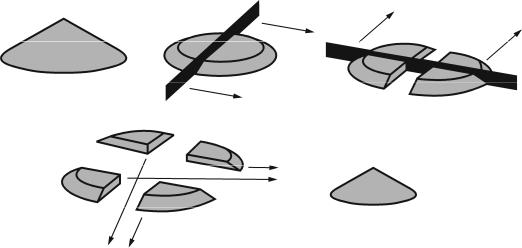
18
они остались после разборки свежего образца. Включения и новообразование собирают в пакетик (в) и сохраняют для анализа. Дернину отряхивают от комочков почвы. Комки почвы разламывают руками, а при большой твердости размельчают в фарфоровой ступке до небольших комочков (5-7 мм) с целью получения более однородного образца. Затем разделяют образец на рабочий и запасной. Для этого, перемешав, располагают его на бумаге ровным слоем в виде квадрата или прямоугольника и делят шпателем по диагоналям на четыре равные части, или, как это принято называть, выполняют квартование. Две противоположные части, т.е. половину образца, упаковывают и хранят для последующих дополнительных определений, снабдив дубликатом этикетки
(г).
Рисунок 1. Подготовка почвы к химическому анализу.
Оставшуюся на бумаге вторую половину образца подвергают дальнейшему перемешиванию и измельчению, для чего его вновь распределяют на бумаге ровным слоем (0,5 см) в виде прямоугольника (д, который делят шпателем продольными и поперечными линиями на квадраты или прямоугольники площадью 3×3 (3×4) см (е). Составляют среднюю пробу (з), т.е. из каждого квадрата ложкой или шпателем отбирают небольшое количество почвы, захватывая её на всю глубину слоя. Если за один прием не удается набрать необходимое для анализа количество почвы (5- 10 грамм), образец снова перемешивают, распределяют на листе бумаги, снова делят на квадраты и опять берут из них понемногу.
19
Составленную таким способом среднюю пробу подготавливают для валового анализа почв, а из оставшегося на бумаге основного объема образца готовят так называемый коробочный образец мелкозема для различных вытяжек.
4.2.2. Приготовление водной вытяжки
Основная масса твердого вещества почвы представлена соединениями, которые не растворяются в воде, кислотах, щелочах, органических растворителях. Однако во всех почвах имеется некоторое количество легко- и среднерастворимых (извлекаемых водой) соединений. Обычно содержание их невелико (от нескольких сотых до двух-трех десятых процента от массы почвы), но в почвах, формирующихся на засоленных породах или при участии засоленных грунтовых вод, оно может составлять целые проценты. Среди водорастворимых веществ в этом случае преобладают различные соли.
Таблица 1 Количество водорастворимых веществ в различных типах
почв (по К. К. Гедройцу)
Соотношение |
Чернозём |
Натриевый |
Гипсовый |
почва : вода |
|
солончак |
солончак |
1:1 |
0,019/0,019* |
3,70/3,70 |
0,19/0,19 |
1:2 |
0,011/0,022 |
1,85/3,70 |
0,19/0,38 |
1:5 |
0,006/0,030 |
0,74/3,70 |
0,19/0,95 |
1:10 |
0,004/0,040 |
0,37/3,70 |
0,19/1,93 |
1:20 |
0,002/0,040 |
0,18/3,70 |
0,19/3,86 |
*Числитель – масса веществ, перешедших в раствор, г/100 см3 вытяжки; знаменатель – масса в г/ 100 г почвы.
Для изучения водорастворимых веществ почв используют как природные почвенные растворы, выделенные разными способами (отпрессовывание, вытеснение другими жидкостями, улавливание с помощью специальных устройств – лизиметров), так и искусственно приготовленные водные вытяжки из почв. Метод водных вытяжек отличается простотой и быстротой выполнения анализа, дает хороший сравнительный материал, позволяющий ответить на ряд вопросов, имеющих практическое значение. Однако по ряду причин водная вытяжка существенно
20
отличается от почвенных растворов, как по количеству, так и по составу растворенных веществ.
Для получения сравнимых результатов все условия получения водной вытяжки должны быть стандартизированы. Это относится к соотношению масс «почва : вода», к времени взаимодействия, степени измельчения почвенных образцов, температуре, качеству используемой для приготовления вытяжки воды. Чем больше в вытяжке объём воды, чем тоньше измельчена почва, тем больше веществ переходит в вытяжку. Наибольшие различия наблюдаются при малом содержании солей (менее 0,3%), с увеличением засоления эти различия уменьшаются.
Условия приготовления обычной водной вытяжки: соотношения масс почва : вода составляет 1:5, время взаимодействия 3 минуты, температура воды 200С. Особые требования предъявляются к качеству дистиллированной (бидистиллированной) воды. Она должна быть свободной от углекислого газа, так как в присутствии СО2 происходит растворение карбонатов кальция и магния с образованием гидрокарбонатов, сухой остаток и общая щелочность вытяжки получаются завышенными. Для этого дистиллированную воду кипятят полчаса или до 2/3 первоначального объёма. Воду хранят в бутылке или колбе, закрытой пробкой с сифоном и хлоркальциевой трубкой, заполненной аскаритом или натронной известью. Дистиллированная вода должна быть свободна от примесей, образующихся при поглощении лабораторных паров и газов (хлороводород, аммиак, диоксид азота и др.). Вода для приготовления вытяжки должна иметь рН 6,6 – 6,8.
Кроме обычной водной вытяжки, приготовляемой в условиях, перечисленных выше, может быть применена декантационная водная вытяжка. Это многократная обработка почвы водой до отрицательной реакции на сульфат - и хлорид – ионы. Такая вытяжка позволяет более полно определить запасы водорастворимых солей в засоленных почвах.
Приготовление водной вытяжки. На технических весах берут навеску, соответствующую 50 грамм сухой почвы, помещают в сухую колбу емкостью 500 см3 и приливают 200 см3 дистиллированной воды, не содержащей углекислоту. Колбу закрывают резиновой пробкой и встряхивают 2-3 минут, после чего вытяжку пропускают через сухой беззольный складчатый фильтр. Фильтрование следует производить в комнате, свободной от паров ки-
