
книги / Химические реакторы
..pdf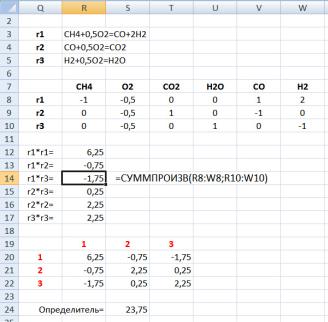
Рис. 2.
Как видно по результатам расчетов, определитель Грама составил 23,75 (по модулю 23,75), что значительно больше нуля, следовательно, линейно-зависимыхуравненийреакцийвмеханизменет.
Необходимо отметить, что в некоторых случаях возможно составление двух и большего количества альтернативных вариантов протекания процесса до одинаковых продуктов, и в этом случае выбор того или иного механизма будет дополнительно определяться соотношением между реагентами. Более подробно материал по этому вопросу будет рассмотрен на лекциях.
Составление отчета
При составлении отчета студент должен показать (с иллюстрациями, фрагментами копии экрана компьютера), что задание выполнено, механизм процесса, состоящий из линейно-неза- висимых реакций, определен.
11
Задание № 2
Расчет и анализ результатов расчета материального баланса при различных степенях превращения по ключевым компонентам
Цель работы – проведение расчета и анализа результатов расчета материального баланса при заданных степенях превращения по ключевым компонентам и механизму процесса, определенному при выполнении задания № 1.
Описание задания
Для подаваемой в процесс 1000 нм3/ч смеси, содержащей 98 %об. углеводорода и 2 %об.N2, рассчитать материальный баланс процесса горения углеводородов по уточненному механизму (химизму) процесса, определенного вариантом по заданию № 1. Все расчеты проводить в Excel.
В ходе выполнения работы:
•рассчитать состав и степень изменения объема (объемного расхода продуктов процесса) для разных степеней превращения углеводорода (не менее 5 точек в пределах от 0 до 1, например: 0,0; 0,2; 0,4; 0,6; 0,8 и 1,0);
•произвести проверку произведенных расчетов по массе;
•в связи с тем что по заданию коэффициент избытка воздуха (α) больше единицы, при выполнении расчетов необходимо учитывать,
что промежуточные продукты (CH4, CO и Н2) догорают полностью, т.е. степенипревращенияподаннымкомпонентамравны1;
•коэффициент избытка воздуха (α), равный отношению реально подаваемого на сжигание заданного количества топлива расхода воздуха и расхода воздуха, необходимого для сжигания этого количества топлива по стехиометрии, т.е. без избытка
= |
V возд. подаваемого реально |
, |
задается вариантом |
V возд.необходимого по стехиометрии |
|||
задания с учетом подгруппы; |
|
|
|
12 |
|
|
|

• считать, что воздух содержит 21 %об.О2 и 79 %об.N2. Результаты расчетов свести в отчет, проиллюстрировать
графиками и сделать выводы (табл. 1).
|
|
|
|
|
|
Таблица 1 |
|
|
|
Величина коэффициента избытка воздуха (α) |
|
|
|||
Номер |
|
|
|
||||
варианта |
п/г 1 |
|
п/г 2 |
п/г 3 |
п/г 4 |
|
п/г 5 |
1 |
1,10 |
|
1,60 |
2,10 |
2,60 |
|
1,55 |
2 |
1,15 |
|
1,65 |
2,15 |
2,65 |
|
2,00 |
3 |
1,20 |
|
1,70 |
2,20 |
2,70 |
|
2,45 |
4 |
1,25 |
|
1,75 |
2,25 |
2,75 |
|
2,90 |
5 |
1,30 |
|
1,80 |
2,30 |
2,80 |
|
2,35 |
6 |
1,35 |
|
1,85 |
2,35 |
2,85 |
|
1,80 |
7 |
1,40 |
|
1,90 |
2,40 |
2,90 |
|
1,25 |
8 |
1,45 |
|
1,95 |
2,45 |
2,95 |
|
1,70 |
9 |
1,50 |
|
2,00 |
2,50 |
3,00 |
|
2,15 |
10 |
1,55 |
|
2,05 |
2,55 |
3,05 |
|
2,60 |
Пример проведения расчетов
Алгоритм проведения расчетов рассмотрим на примере горения метана, в данном случае будем считать, что это «углеводород» из задания, механизм горения которого из линейно-независимых реакций былопределен напримере выполнениязадания №1.
CH4 + 0,5O2 = CO + 2H2 CO + 0,5O2 = CO2
H2 + 0,5O2 = H2O
Расчеты будем производить при коэффициенте избытка воз-
духа, α = 1,5.
Так как количество воздуха для полного сгорания углеводорода неизвестно, то в первую очередь необходимо провести этот расчет с заданным избытком воздуха.
Этап 1: Расчет необходимого количества воздуха. По расходу 1000 нм3/ч и составу 98 %об.СН4 и 2 %об.N2 считаем
VCH 4 = 1000·0,98 = 980 нм3/ч
VN 2 = 1000·0,02 = 20 нм3/ч
13
Для полного сгорания VCH 4 до СО и Н2 необходимо: VО2 =
= 0,5·980 = 490 нм3/ч О2, и при этом образуется 980 нм3/ч СО и 1960 нм3/ч Н2.
Для полного сгорания образовавшихся промежуточных компонентов до СО2 и Н2О потребуется О2: 490 нм3/ч для СО и
980 нм3/ч для Н2.
Таким образом, для полного сгорания углеводорода и промежуточных продуктов потребуется О2: 490 + 490 + 980 = 1960 нм3/ч
или 1960/0,21 = 9333 нм3/ч воздуха.
При α = 1,5 количество воздуха будет 9333·1,5 = 14 000 нм3/ч, который состоитиз2940 нм3/ч О2 и11060 нм3/ч N2.
Таким образом, расход газа на входе будет равен: 1000 +
14000 = 15000 нм3/ч, и будет включать: |
|
|
V |
= 980 нм3/ч |
980/15000 = 6,53 % |
CH 4 |
|
|
V |
= 2940 нм3/ч |
2940/15000 = 19,60 % |
O 2 |
|
|
V |
= 20 + 11060 = 11080 нм3/ч |
11080/15000 = 73,87 % |
N 2 |
|
|
Этап 2. Расчет материального баланса при различных степенях превращения по углеводороду. Например, для ХСН4 = 0,5 при
ХСО = 1 и ХН2 = 1, т.е. при 50 % превращении метана из исходной
смеси и100 % превращенииобразовавшихсяприэтомСО иН2. VCH4 (на хим. реакцию) = 980·0,5 = 490 нм3/ч, для которых
потребуется VO2 = 245 нм3/ч. При этом останется 490 нм3/ч СН4.
При этом образуется:
VCO = 490 нм3/ч, для окисления которого потребуется VO2 =
= 245 нм3/ч, и образуется 490 нм3/ч СО2.
VH 2 = 980 нм3/ч, для окисления которого потребуется VO2 =
= 490 нм3/ч и образуется 980 нм3/ч Н2О.
Таким образом, расход газа на выходе будет равен:
490 (СН4) + (2940 – 245 – 245 – 490 = 1960 О2) + 11080(N2) + + 490 (СО2) + 980(Н2О) = 15000 нм3/ч и будет включать:
14
V |
4 |
|
= 490 нм3/ч |
3,27 % |
CH |
= 1960 нм3/ч |
|
||
V |
|
13,07 % |
||
O 2 |
|
= 11080 нм3/ч |
|
|
V |
|
73,87 % |
||
N 2 |
|
|
= 490 нм3/ч |
|
V |
|
|
3,27 % |
|
СО2 |
|
= 980 нм3/ч |
|
|
V |
|
|
6,54 % |
|
H 2 O |
|
|
||
Необходимо отметить, что согласно химизму процесса горение метана идет без изменения объема, однако для большинства веществ по заданию объем реакционной смеси будет изменяться.
Этап 3. Проверка правильности расчета МБ по массе. Считаем плотности веществ через молекулярную массу вещества (г/моль) и объем 1 моли при Н.У. (нормальных условиях) = 22,4 л/моль или
0,0224 нм3/моль
ρCH4 = 16/0,0224 = 714,3 г/нм3 = 0,7143 кг/нм3
ρO2 = 32/0,0224 = 1428,6 г/нм3 = 1,4286 кг/нм3 ρN2 = 28/0,0224 = 1250 г/нм3 = 1,25 кг/нм3
ρCO2 = 44/0,0224 = 1964,3 г/нм3 = 1,9643 кг/нм3
ρH2O = 18/0,0224 = 803,6 г/нм3 = 0,8036 кг/нм3
Расчеты проводим в Excel (без округлений) и сводим результаты расчета в таблицу (табл. 2).
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
Вещество |
Приход |
|
Расход |
|
||
нм3/ч |
|
кг/ч |
нм3/ч |
|
кг/ч |
|
СН4 |
980 |
|
700,014 |
490 |
|
350,007 |
О2 |
2940 |
|
4200,084 |
1960 |
|
2800,056 |
N2 |
11080 |
|
13850,000 |
11080 |
|
13850,000 |
CO2 |
|
|
|
490 |
|
962,507 |
H2O |
|
|
|
980 |
|
787,528 |
ИТОГО |
15000 |
|
18750,098 |
15000 |
|
18750,098 |
Как видно по результатам расчетов по массе, дебаланс отсутствует, т.е. расчеты проведены правильно.
Поводим с помощью Excel расчеты для других степеней превращения и сводим результаты в таблицу (табл. 3).
15

|
|
|
|
|
|
Таблица 3 |
|
|
|
|
|
% N2 |
|
|
|
ХУВ |
Расход, нм3/ч |
% СН4 |
% O2 |
% CO2 |
|
% H2O |
|
0 |
15000 |
6,53 |
19,60 |
73,87 |
0 |
|
0 |
0,1 |
|
|
|
|
|
|
|
0,3 |
|
|
|
73,87 |
|
|
|
0,5 |
15000 |
3,27 |
13,07 |
3,27 |
|
6,54 |
|
0,7 |
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|
|
Пример проведения расчетов с использованием Excel представлен на рисунке.
Рис. 1
16
Составление отчета
Результаты расчетов при различных степенях превращения по углеводороду иллюстрируются графиками, делаются выводы и составляется отчет о работе. При составлении отчета студент должен показать, что задание выполнено, а расчет материального баланса при различных степенях превращения по ключевым компонентам сходится, а дебаланс отсутствует.
17
ЗАДАНИЕ № 3
Расчет и анализ результатов расчета теплового баланса при различных степенях превращения по ключевым компонентам
Цель работы – проведение расчета и анализа результатов расчета теплового баланса при заданных степенях превращения по ключевым компонентам.
Описание задания
На основании результатов расчета материального баланса горения углеводородов (задание № 2) составить тепловой баланс адиабатного процесса горения и рассчитать параметры потока, связанные с повышениемеготемпературы. ВсерасчетыпроводитьвExcel.
В ходе выполнения работы:
•рассчитать тепловые эффекты химических реакций;
•определить температуру дымовых газов при проведении процесса до СО2 и Н2О с учетом 3 % потерь теплоты;
•считать, что температура исходной смеси (углеводород + азот) и температура воздуха равны 25 °С;
•при расчете теплоты потока дымовых газов использовать теплоемкости газов при высоких температурах;
•определить коэффициент объемного температурного расширения и реальный расход дымовых газов (м3/ч) при рассчитанной температуре дымовых газов и при давлениях 1; 5 и 10 атм;
•построить графики зависимостей: концентраций веществ, температуры реакционной смеси и расходов (нм3/ч и м3/ч при заданном давлении и рассчитанной температуры потока) от степени превращения углеводородов;
•рассчитать время пребывания в реакторе объемом 1,5 м3 при разных степенях превращения углеводородов и связать данное время с различными условиями проведения процесса, т.е. при разном давлении и степени превращения углеводородов, постро-
18

ить графики и сделать выводы о зависимости времени пребывания от параметров процесса.
Результаты расчетов свести в таблицу, построить графики, сделать выводы.
Расчеты производить в том же файле Excel, где производился расчет материального баланса, но на отдельном листе. При этом необходимые для расчета теплового баланса данные должны браться с листа с расчетами материального баланса посредст-
вом присвоения ячеек, т.е. листы расчета материального баланса и теплового баланса в Excel должны быть «связаны», и при изменении значений на листе материального баланса данные значения, используемые для расчета теплового баланса (на листе теплового баланса), будут меняться автоматически.
Справочные значения теплоемкости приведены в табл. 1, 2.
Таблица 1
Мольная изобарная теплоемкость газов и энтальпия их образования СP = a + bT + cT 2 + dT 3, кал/(моль К)
Газ |
а |
b |
с |
d |
∆Н298, |
|
ккал/моль |
||||||
|
4,598 |
|
|
|
||
СН4 |
1,245E-2 |
2,860Е-6 |
–2,703E-9 |
–17,895 |
||
С2Н6 |
1,292 |
4,254E-2 |
–1,657E-5 |
2,081Е-9 |
–20,236 |
|
СЗН8 |
–1,009 |
7,315E-2 |
–3,789E-5 |
7,678E-9 |
–24,820 |
|
С4Н10 |
2,266 |
7,913Е-2 |
–2,647Е-5 |
–0,674Е-9 |
–30,120 |
|
С5Н12 |
–0,866 |
1,164Е-1 |
–6,163Е-5 |
1,267Е-8 |
–35,000 |
|
СО |
7,373 |
–0,307E-2 |
6,662E-6 |
–3,037E-9 |
–26,416 |
|
N2 |
7,440 |
–0,324E-2 |
6,400E-6 |
–2,790E-9 |
– |
|
Н2 |
6,483 |
2,215E-3 |
–3,298E-6 |
1,826E-9 |
– |
|
CО2 |
4,728 |
1,754E-2 |
–1,338E-5 |
4,097E-9 |
–94,050 |
|
Н2О |
7,701 |
4,595E-4 |
2,521E-6 |
–0,859E-9 |
–57,796 |
|
О2 |
6,713 |
–0,879E-6 |
4,170E-6 |
–2,544E-9 |
– |
|
С2Н4 |
0,909 |
3,740E-2 |
–1,994E-5 |
4,192E-9 |
12,496 |
|
С2Н2 |
6,406 |
1,810Е-2 |
–1,196E-5 |
3,373E-9 |
54,194 |
Примечание: в данной таблице значения коэффициентов b, c и d приведены в экспоненциальномформате, т.е., например, число1,245E-2 будетравно1,245.10–2.
19
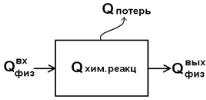
Таблица 2
Мольная изобарная теплоемкость газов при высоких температурах, Дж/(моль К)
Газ |
Тmax, К |
Уравнение зависимости СР = f(T) |
H2O |
2500 |
30,02 + 10,72 10-3 Т + 0,33 105/Т2 |
CO2 |
2500 |
44,17 + 9,04 10-3 Т – 8,54 105/Т2 |
O2 |
3000 |
29,98 + 4,187 10-3 Т – 1,675 105/Т2 |
N2 |
2500 |
27,88 + 4,27 10-3 Т |
Пример проведения расчетов
Алгоритм проведения расчетов рассмотрим на примере горения метана, пример расчета материального баланса, который рассматривался в задании № 2.
CH4 + 0,5O2 = CO + 2H2 CO + 0,5O2 = CO2
H2 + 0,5O2 = H2O
Расчеты теплового баланса будут производиться в несколько этапов.
В ходе выполнения расчетов для определения статей прихода и расходатепла в тепловомбалансе изображаем схему потоков тепла:
где Qфизвых и Qфизвх – физическое количество теплоты, идущее с ма-
териальным потоком на выходе и входе; Qхр – теплота химиче-
ских реакций; Qпотерь – величина потерь теплоты.
При этом на основании данной схемы можно составить таблицу теплового баланса (табл. 3).
20
