
книги / Химия водных растворов, природных и сточных вод
..pdfМинистерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Пермский национальный исследовательский политехнический университет»
Кафедра охраны окружающей среды
И.С. Глушанкова, Л.В. Рудакова, А.А. Кетов
ХИМИЯ ВОДНЫХ РАСТВОРОВ, ПРИРОДНЫХ И СТОЧНЫХ ВОД
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Издательство Пермского национального исследовательского
политехнического университета
2019
УДК 628.2/3 (075.8) Г55
Рецензенты:
д-р биол. наук, проф. Уланова Т.С. (Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения); канд. хим. наук, доцентФарбероваЕ.А. (Пермскийнациональныйисследовательский политехническийуниверситет)
Глушанкова, И.С.
Г55 Химия водных растворов, природных и сточных вод : учеб. пособие / И.С. Глушанкова, Л.В. Рудакова, А.А. Кетов. – Пермь : Изд-во Перм. нац. исслед. политехн. ун-та, 2019. –
140с.
ISBN 978-5-398-02043-4
Приведены теоретические сведения об основных химических и физико-химических свойствах воды, даны характеристики природных и сточных вод, проанализированы показатели качества воды
иусловия сброса в водоем. Предложены вопросы к самостоятельной работе и индивидуальные многовариантные практические задания.
Пособие предназначено для проведения аудиторных занятий по курсам «Химия воды и основы очистки природных и сточных вод физико-химическими методами» и «Химия и технология очистки воды» для обучающихся по направлениям 20.03.01, 20.04.01 «Техносферная безопасность (профиль программы магистратуры «Инженерная защита объектов гидросферы») и по направлению 08.03.01 Строительство (профиль программы бакалавриата «Водоснабжение
иводоотведение») очной и заочной форм обучения.
УДК 628.2/3 (075.8)
ISBN 978-5-398-02043-4 |
© ПНИПУ, 2019 |
Оглавление |
|
ПРЕДИСЛОВИЕ.................................................................................................. |
5 |
1. СТРОЕНИЕ И ОСНОВНЫЕ ФИЗИКО-ХИМИЧЕСКИЕ |
|
И ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ............................................................ |
6 |
1.1. Строение молекул воды...................................................................... |
6 |
1.2. Физические свойства воды и их влияние на устойчивость |
|
биосферы..................................................................................................... |
8 |
1.3. Основные химические свойства воды............................................. |
13 |
2. СВОЙСТВА ВОДНЫХ РАСТВОРОВ........................................................ |
17 |
2.1. Основные теоретические аспекты процесса растворения............. |
17 |
2.2. Способы выражения концентрации растворов............................... |
19 |
2.3. Растворение газов в воде .................................................................. |
22 |
2.4. Основные физико-химические свойства растворов |
|
неэлектролитов......................................................................................... |
26 |
2.5. Свойства растворов электролитов................................................... |
32 |
2.5.1. Электролитическая диссоциация. Степень диссоциации......... |
32 |
2.5.2. Ионное произведение воды. Водородный показатель рН........ |
38 |
2.5.3. Физико-химические свойства растворов электролитов............ |
42 |
2.6. Буферные растворы........................................................................... |
47 |
3. ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ....................................................... |
51 |
3.1. Реакции ионного обмена в водных растворах................................ |
51 |
3.2. Гидролиз солей.................................................................................. |
51 |
3.3. Диссоциация малорастворимых электролитов. |
|
Произведение растворимости ................................................................. |
57 |
3.4. Комплексообразование в растворах электролитов......................... |
63 |
4. ОСОБЕННОСТИ СВОЙСТВ КОЛЛОИДНЫХ РАСТВОРОВ |
|
И РАСТВОРОВ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ................. |
70 |
4.1. Строение коллоидных систем и их свойства.................................. |
70 |
4.2. Особенности свойств растворов высокомолекулярных |
|
соединений и поверхностно-активных веществ.................................... |
79 |
5. ХАРАКТЕРИСТИКА ПРИРОДНЫХ И СТОЧНЫХ ВОД. |
|
ОСНОВНЫЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ........................................ |
88 |
5.1. Характеристика состава природных вод. Основные показатели |
|
качества природных вод. ......................................................................... |
88 |
5.2. Характеристика состава сточных вод.............................................. |
94 |
5.3. Основные показатели качества воды............................................... |
99 |
|
3 |
5.3.1. Характеристики качества воды по химическим |
|
и физико-химическим показателям (общесанитарные |
|
показатели качества воды). Интегральные показатели |
|
загрязнения сточных вод .................................................................... |
100 |
5.3.2. Основные показатели санитарной оценки качества воды ..... |
104 |
5.4. Классификация методов очистки природных и сточных вод..... |
112 |
5.4.1. Системы водоотведения городских и промышленных |
|
сточных вод.......................................................................................... |
112 |
5.4.2. Условия сброса сточных вод в водоемы.................................. |
113 |
5.4.3. Классификация методов очистки сточных вод. Выбор |
|
технологий очистки сточных вод и состава очистных |
|
сооружений.......................................................................................... |
117 |
СПИСОК ЛИТЕРАТУРЫ.............................................................................. |
120 |
Приложение 1.................................................................................................. |
121 |
Приложение 2.................................................................................................. |
123 |
Приложение 3.................................................................................................. |
127 |
Приложение 4.................................................................................................. |
130 |
Приложение 5.................................................................................................. |
139 |
4
ПРЕДИСЛОВИЕ
Изучение современных технологий очистки сточных вод, водоподготовки, глубокой доочистки воды до соответствия требованиям природоохранного законодательства основано на знании химических и физико-химических свойств воды, водных растворов, природных и сточных вод, которые рассматриваются в курсах «Химия воды и основы очистки природных и сточных вод физикохимическими методами» и «Химия и технология очистки воды» для обучающихся по направлениям 20.03.01, 20.04.01 «Техносферная безопасность (профиль программы магистратуры «Инженерная защита объектов гидросферы») и по направлению 08.03.01 Строительство (профиль программы бакалавриата «Водоснабжение и водоотведение»).
В учебном пособии представлены сведения об основных свойствах воды, особенностях свойств растворов неэлектролитов, электролитов, высокомолекулярных соединений и поверхностно-ак- тивных веществ, а также основные характеристики природных и сточных вод, показатели качества воды, санитарные требования к сбросу очищенных вод в водоемы и классификация методов очистки сточных вод.
Учебной программой дисциплин предусмотрено проведение практических занятий, и в пособии приведены вопросы для самостоятельной работы обучающихся и многовариантные индивидуальные практические задания.
При написании пособия использованы материалы курса лекций и методические пособия, апробированные авторами в ПНИПУ в 2010–2017 гг.
5

1.СТРОЕНИЕ И ОСНОВНЫЕ ФИЗИКО-ХИМИЧЕСКИЕ
ИХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
1.1. Строение молекул воды
Уникальные физические и химические свойства воды обусловлены химическим строением молекул воды.
С позиций метода валентных связей атом кислорода в молекуле воды Н2О находится в состоянии sp3Е2-гибридизации (рис. 1.1). Две гибридные орбитали атома кислорода перекрываются s-орби- талями двух атомов водорода, две другие гибридные орбитали атома кислорода содержат неподеленные электронные пары. В результате отталкивания электронных пар валентный угол в молекуле воды составляет 104,5°.
Связи О-Н в молекуле воды полярны, и электронная плотность атома Н смещена в сторону наиболее электроотрицательного элемента – О (электроотрицательность атома О – 3,5, электроотрицательность атома Н – 2,1).
Молекула воды имеет угловое строение, вследствие несимметричного строения молекулы воды полярны и обладают высоким дипольным моментом (1,84 Д), или 5,52·10–3 Кл·м.
Рис. 1.1. Строение молекулы воды
Наличие неподеленных электронных пар атома кислорода и его высокая электроотрицательность способствуют образованию
6

водородных связей между молекулами воды по донорно-акцептор- ному механизму (рис. 1.2.)
Энергия водородных связей в воде составляет 29 кДж/моль. Молекула Н2О может образовать 4 водородные связи между поляризованными атомами водорода и кислорода соседних молекул, как это показано на рис. 1.2.
Рис. 1.2. Образование водородных связей между молекулами воды
Водородные связи между молекулами обусловливают жидкое состояние воды в интервале температур 273–373К, а также ее высокую температуру кипения.
Наличие неподеленных электронных пар атомов кислорода позволяет молекулам воды образовывать координационные комплексные соединения с ионами металлов по донорно-акцепторному механизму, например [Cu(H2O)5]2+.
Вследствие высокой электроотрицательности атома кислорода в молекуле происходит разделение положительного и отрицательного зарядов, т.е. молекулу воды можно представить в виде диполя (дипольный момент связи в молекуле воды – 1,84 D)
Особенности химического строения обусловливают аномальные физические свойства и высокую химическую активность воды.
7
1.2. Физические свойства воды и их влияние на устойчивость биосферы
Изотопный состав воды
Изотопы – разновидности атомов одного элемента, различающиеся молекулярной массой. Изотопы содержат в ядре одинаковое число протонов, но различаются содержанием нейтронов.
Водород имеет три изотопа – 11Н, 21Н (дейтерий), 31Н (тритий), кислород – три устойчивых изотопа – 168O, 17 8O и 188O. Комбинации изотопов водорода и кислорода образуют восемнадцать изотопных разновидностей воды.
Природная вода представляет смесь изотопов. 99,72 % из общей массы воды составляет легкая вода – 11Н2168O.
Тяжелая вода, образованная дейтерием D2O, отличается от легкой воды некоторыми физическими свойствами, имеет более высокую плотность, более высокие температуры кипения 101,4 °С и замерзания +3,74 °С.
Агрегатное состояние воды
Вода в зависимости от температуры и давления может находитьсявтрехагрегатныхсостояниях: твердом, жидкомигазообразном.
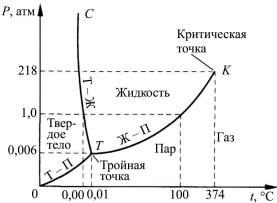
На рис. 1.3 представлена диаграмма состояния воды, отражающая равновесное состояние различных фаз воды в зависимости от температуры и давления. Кривая ОТ характеризует равновесие двух фаз – лед-пар, кривая ТС – равновесие фаз – жидкость-лед, и каждая точка на кривой показывает температуру плавления или замерзания воды при заданном давлении. Кривая ТК отражает равновесие фаз – жидкость-пар. Т – тройная точка (температура 0,01 °С (273,01К), давление 0,006 атм или 611,73 Па), в которой вода может одновременно находиться в жидком, твердом и газообразном состоянии.
Жидкое состояние воды
При атмосферном давлении в интервале температур 0–100 °С вода находится в жидком состоянии. Благодаря наличию водородных связей между молекулами воды считается, что в воде присутствуют ассоциаты и свободные молекулы воды, т.е. структура воды
8
неоднородна. В воде также частично сохраняется и структура, характерная для льда.
Рис. 1.3. Диаграмма состояния воды
Твердое состояние воды. Лед
Лед представляет собой кристаллическое вещество, в узлах кристаллической решетки которого содержатся полярные молекулы воды. Молекулы воды способны образовывать четыре водородные связи с другими молекулами воды, направленные к вершинам тетраэдра, форма тетраэдра сохраняется при замерзании воды. Тетраэдрические ассоциаты формируют кристаллическую структуру льда. Известно более 10 модификаций льда с разной кристаллической структурой: гексагональной, кубической, тетрагональной и другими, зависящей от условий кристаллизации (Т, Р).
Наиболее изучен лед, имеющий гексагональную (шестиугольную) структуру, и именно в этой форме существуют материковый лед, снег, иней, плавающий лед (рис. 1.4). При формировании гексагональной кристаллической структуры льда образуются пустоты, размеры которых больше размера молекул воды, т.е. при кристаллизации происходит увеличение объема воды (на 11 %) и снижение плотности льда по сравнению с жидкой водой. Плотность льда, имеющего гексагональную структуру, составляет 931 кг/м3.
9

Рис. 1.4. Строение льда гексагональной структуры
Каркас из водородных связей располагает молекулы воды в состоянии льда в виде сетки, по структуре напоминающей соты. При плавлении льда молекулы воды встраиваются в пустоты сетчатой структуры льда, в результате повышается плотность упаковки и, соответственно, плотность жидкой воды.
Свойства льда значительно отличаются от свойств жидкой воды. Например, лед характеризуется очень низкой растворяющей способностью, поэтому лед всегда чище жидкой воды. При замерзании растворов в структуру льда входят именно молекулы воды, а примеси концентрируются в жидкой фазе. Таким образом, при замерзании природных вод происходит естественное их очищение.
Общие запасы льда на Земле составляют более 30 млн км3. Больше всего льда сосредоточено в Антарктиде, где толщина его слоя достигает 4 км.
Газообразное состояние воды. Пар
При температуре более 100 °С и атмосферном давлении вода находится в виде пара. В газообразном состоянии разрушаются водородные связи между молекулами воды, и в водяном паре вода находится в виде одиночных молекул. Количество водяного пара в воздухе изменяется; наибольшее его содержание составляет 4 %.
10
