
книги / Химия водных растворов, природных и сточных вод
..pdfПримеры расчета концентрации растворов
Пример 2.1
В 450 г воды растворили 50 г медного купороса (CuSO4·5H2O). Вычислить массовую долю сульфата меди и молярную концентра-
цию полученного раствора. Плотность раствора принять равной
1,2 г/см3.
Решение
Общая масса раствора составляет 500 г.
Объем раствора V m 500 416,7 см3.
1,2
Для определения массовой доли сульфата меди в растворе рассчитаем содержание сульфата меди в 50 г медного купороса.
Для этого определим соотношение молярных масс:
M (CuSO4) / M (CuSO4·5H2O) = 160/250 = 0,64,
M(CuSO4·5H2O) = 250 г/моль, M (CuSO4) = 160 г/моль.
Сучетом полученного соотношения содержание сульфата меди в 50 г медного купороса составит 32 г.
Определим массовую долю сульфата меди в полученном растворе:
ω |
mв ва |
100% |
32 |
100% 6,4%. |
|
450 50 |
|||||
|
m |
|
|
||
|
р ра |
|
|
|
Определим молярную концентрацию раствора:
СМ nB |
mB |
|
32 |
0,48М. |
|
M BV |
160 0,417 |
||||
V |
|
|
Пример 2.2
Какую массу воды нужно прибавить к 200 мл 30%-ного раствора NaOH (ρ = 1,33 г/мл) для получения 10%-ного раствора щелочи? Определить моляльность полученного раствора.
21

Решение
1. По соотношению (2.2) определим массу NaOH в исходном растворе с массовой долей, равной 0,3.
mB ω V ρ 0,3 200 1,33 79,8 .
2. Масса исходного раствора
m0 V ρ 200 1,33 266 г.
3. По соотношению (2.1) определим массу раствора (m1) с массовой долей, равной 0,1.
m1 mωB 79,80,1 798 г.
4. Определим массу добавленной воды – mA1. mA1 m1 m0 798 266 532 г.
5. Определим моляльность полученного раствора по соотно-
шению (2.5).
Масса воды в полученном растворе составляет mA m1 mВ 798 79,8 718,2 г.
Моляльность раствора
Cm |
nB |
|
mB |
1000 |
79.8 |
1000 2,78 моль/кг. |
mA |
|
40 718,2 |
||||
|
|
M B mA |
|
|||
Молярная масса NaOH – 40 г/моль.
2.3. Растворение газов в воде
Процесс растворения газа в жидкости может быть описан уравнением фазового равновесия: Вг ↔ Вж и характеризуется константой фазового равновесия Кф,
Kф |
XB |
, |
(2.7) |
|
|||
|
PB |
|
|
22

где ХВ – мольная доля газа в жидкости; РВ – равновесное парциальное давление газа (Па или атм.).
В практических расчетах растворимость газа выражают через молярную концентрацию вещества в растворе СМ (В). При этом константа равновесия растворения газа в жидкости примет вид
Kр |
CМ |
B |
. |
(2.8) |
Р |
|
|||
|
B |
|
|
|
Константы равновесия процесса растворения газов воде при температуре 298 К:
Газ |
O2 |
N2 |
CO2 |
CH4 |
Кр, моль/дм3·атм |
1,28·10–3 |
6,4·10–4 |
3,38·10–2 |
1,34·10–3 |
Зависимость растворимости газа (ХВ) от парциального давления газа над раствором (РВ) описывается уравнением Генри
PB KГ ХВ, |
(2.9) |
где КГ – константа Генри – константа растворимости.
Уравнение Генри выполнимо при достаточно низких парциальных давлениях газа.
Константа Генри зависит от природы газа и растворителя,
атакже температуры.
Всоответствии с уравнениями (2.7) и (2.9) она определяется
соотношением КГ = 1 .
Кф
В практических расчетах пользуются коэффициентом растворимости, под которым понимают объем газа (м3) в пересчете на нормальные условия (0°C и 101,325 кПа), поглощаемый 1 м3 воды при парциальном давлении газа 1 атм.
Процесс растворения сопровождается выделением тепла, значительным снижением объема газа, и в соответствии с принципом подвижного равновесия Ле-Шателье растворимость газа в воде будет понижаться с повышением температуры и увеличиваться с повышением давления газа.
В табл. 2.1 представлены коэффициенты растворимости некоторых газов в воде при различных температурах.
23

Таблица 2.1
Коэффициенты растворимости (м3/м3) некоторых газов в воде при различных температурах
Газ |
|
Температура, °С |
|
|
0 |
20 |
40 |
Азот |
0,0293 |
0,0164 |
0,0118 |
Аргон |
0,058 |
0,037 |
0,027 |
Кислород |
0,049 |
0,031 |
0,023 |
Углекислый газ |
1,713 |
0,878 |
0,53 |
Хлористый водород |
506 |
442 |
386 |
Хлор |
4,6 |
2,299 |
1,438 |
Сероводород |
4.670 |
2.582 |
1,66 |
Аммиак |
1300 |
710 |
560 |
В воде как полярном растворителе лучше растворяются полярные молекулы газов (хлороводород, сероводород и др.), растворение газообразных кислотных оксидов (SO2, SO3,NO2,N2O3 и др.) сопровождается химическим взаимодействием молекул газа с водой с образованием кислот. Аммиак растворяется в воде с образованием гидроксида аммония.
Растворение газов в воде влияет на формирование природных вод и жизнь водоемов, на протекание биохимических процессов, а также процессов самоочищения водоемов.
Пример 2.3
Определите растворимость кислорода О2 (моль/дм3, мг/дм3) в воде при Т = 298 К.
Решение
Концентрация О2 в сухом воздухе составляет 21 %, при давлении Р = 1 атм парциальное давление кислорода в воздухе
рО2 робщ ХО2 0,21 атм.
Определим растворимость кислорода в воде по формуле (2.8):
СМ О2 Кр рО2 1,28 10 3 0,21 2,68 10 4 мольл ,
24
СО2 СМ МО2 1000 2,68 10 4 32 1000 8,6мг/л.
Вопросы для самоконтроля
1.Рассмотрите основные теоретические аспекты химической теории растворов.
2.Как определяется моляльность раствора?
3.Как определяется молярная масса эквивалента соли?
4.Как влияет температура на растворимость газов в воде? Объясните это явление.
5.Какова зависимость растворимости газа в воде от давления?
Многовариантные индивидуальные задания
1.Какой объем раствора серной кислоты с массовой долей 96 % (плотность – 1,835 г/см3) нужно взять для приготовления 5 л 0,5 Н раствора серной кислоты?
2.В какой массе воды следует растворить 28 г оксида кальция для получения раствора, в котором массовая доля оксида кальция составляет 10 %? Определите молярность полученного раствора.
3.Определите массовую долю растворенного вещества и мо-
лярность раствора, полученного при сливании 200 г 10%-ного и 150 г – 5%-ного растворов карбоната натрия (плотность полученного раствора 1,1 г/см3).
4.Определите молярную концентрацию раствора, в 200 мл которого содержится 1,6 г гидроксида натрия.
5.К 200 мл 0,1 М раствора серной кислоты (плотность раствора 1,0051 г/см3) прилили 300 мл 0,5 М раствора серной кислоты (плотность 1,03 г/см3). Определите концентрацию полученного раствора.
6.В какой массе воды следует растворить 28 г оксида кальция для получения раствора, в котором массовая доля оксида кальция составляет 10 %? Определите молярность полученного раствора.
7.Какой объем раствора серной кислоты с массовой долей 96 % (плотность – 1,835 г/см3) нужно взять для приготовления 5 л 0,5 Н раствора серной кислоты?
25
8.Определите растворимость азота в воде при температуре
298 К и Р 1 атм.
9.Определите растворимость хлороводорода в воде при температуре 273 К и Р 1 атм и массовую долю НСl в полученном растворе. Коэффициент растворимости НСl при заданных условиях составляет 506.
10.Каково парциальное давление сероводорода в газе, если при 273 К массовая доля сероводорода в водном растворе составляет
3,4 %.
2.4. Основные физико-химические свойства растворов неэлектролитов
Неэлектролитами называются вещества, водные растворы которых не проводят электрический ток. Например, сахар, глюкоза, бензол и др. Неэлектролиты при растворении в воде образуют гидратированные молекулы.
Разбавленные растворы неэлектролитов по своим свойствам приближаются к свойствам идеальных растворов, т.е. растворов, в которых отсутствует взаимодействие между их компонентами и их свойства не зависят от природы компонентов и определяются главным образом числом частиц в растворе. Свойства растворов, зависящие только от количества частиц в растворе, называют также кол-
лигативными свойствами.
Рассмотрим основные коллигативные свойства разбавленных растворов неэлектролитов, к которым относятся:
–понижение давления пара над раствором;
–понижение температуры замерзания и повышение температуры кипения растворов по сравнению с растворителем;
–возникновение осмотического давления раствора.
Понижение давления пара над раствором. Закон Рауля
При данной температуре давление насыщенного пара над
жидкостью при заданной температуре является постоянной величиной. При растворении вещества в жидкости давление насыщенного пара растворителя над раствором понижается. Это явление описыва-
26
ется законом Рауля: давление пара растворителя над раствором меньше, чем давление пара над чистым растворителем, и пропорционально мольной доле растворителя в растворе:
РA РA0 X A , |
(2.10) |
где РА, РA0 – давление паров растворителя над раствором и чистым
растворителем соответственно; ХА – мольная доля растворителя. Концентрацию раствора обычно выражают через количество
или массу растворенного вещества. Осуществив преобразования
РA РA0 |
1 ХB , |
(2.11) |
|||||||
получим следующее выражение: |
|
|
|
|
|
|
|
||
Х |
|
|
Р0 |
|
Р |
A |
. |
(2.12) |
|
B |
|
A |
|
|
|||||
|
|
РA0 |
|
|
|||||
|
|
|
|
|
|
|
|
||
Относительное понижение давления паров растворителя над растворомравно мольнойдолерастворенного вещества врастворе.
Важными следствиями из закона Рауля являются понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем.
Повышение температуры кипения раствора по сравнению с чистым растворителем
Температура кипения Ткип0 – температура, при которой давле-
ние паров над раствором равно атмосферному давлению. В соответствии с законом Рауля давление паров растворителя над раствором будет равным атмосферному при более высокой температуре, чем давление паров над чистым растворителем (рис. 2.1), т.е. раствор будет закипать при более высокой температуре.
При этом повышение температуры кипения раствора будет зависеть от его моляльной концентрации:
Т E Cm , |
(2.13) |
27
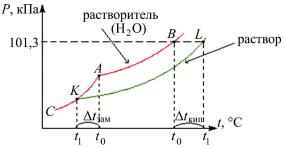
где T – повышение температуры кипения раствора; E – эбуллиоскопическая постоянная растворителя; Cm – моляльная концентрация раствора.
Эбуллиоскопическая постоянная воды 0,52 К.
Рис. 2.1. Зависимость температуры кипения и замерзания воды и водных растворов от давления
Понижение температуры замерзания раствора по сравнению с чистым растворителем
Температура замерзания – это температура, при которой давление пара надо льдом равно внешнему давлению. В соответствии с законом Рауля для растворов давление паров растворителя над твердой фазой (льдом) будет равным внешнему при более низкой температуре (см. рис. 2.1), т.е. раствор будет замерзать при более низкой температуре.
Понижение температуры замерзания пропорционально моляльной концентрации раствора:
Tзам К Cm , |
(2.14) |
где Tзам – понижение температуры замерзания раствора; К – криоскопическая постоянная растворителя; Cm – моляльная концентрация раствора.
Криоскопическая постоянная воды 1,86 К.
28

Осмотическое давление раствора
Возникновение осмотического давления растворов можно объяснить процессами диффузии молекул через полупроницаемую мембрану, т.е. мембрану, проницаемую только для мелких молекул,
например молекул растворителя. Суть явления |
|
||
может быть пояснена следующим примером. |
|
||
Возьмем сосуд, разделенный на две части полу- |
|
||
проницаемой мембраной |
(рис. 2.2). |
В одну |
|
часть сосуда поместим раствор, а в другую – |
|
||
растворитель – воду. При этом будет происхо- |
|
||
дить самопроизвольный |
процесс диффузии |
|
|
молекул воды через полупроницаемую мем- |
|
||
брану в раствор, разбавляя его и создавая дав- |
|
||
ление на мембрану. Этот процесс называется |
Рис. 2.2. Осмос |
||
осмосом. Давление, которое надо приложить |
и осмотическое |
||
к раствору, чтобы осмос прекратился, |
назвали |
давление |
|
осмотическим давлением. Осмотическое дав-
ление зависит от концентрации раствора.
При малых концентрациях растворенного вещества (условиях, близких к идеальным растворам) осмотическое давление (π) опреде-
ляется уравнением Вант-Гоффа |
|
СМ RT, |
(2.15) |
где π – осмотическое давление (Па); CМ – молярная концентрация раствора (моль/м3); R – универсальная газовая постоянная (R = = 8,314 кДж/моль К); T – температура, К.
Осмос играет огромную роль в природных, химических и биологических процессах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается явление осмоса. Растворы, характеризующиеся одинаковым осмотическим давлением, называют изотоническими. При помещении кле-
29
ток в изотонический раствор они сохраняют свой размер и нормально функционируют.
Перенос питательных веществ в высоких стволах деревьев осуществляется за счет осмоса.
Пример 2.4
В 250 мл раствора содержится 2,3 г растворенного вещества, осмотическое давление раствора при 27 °С равно 249 кПа. Вычислить молярную массу вещества.
Решение
1. Определим молярную концентрацию раствора по соотно-
шению (2.9):
СМ |
|
|
|
|
249 |
|
0,1 моль/л. |
||||||
|
|
8,31 300 |
|||||||||||
|
|
|
|
RT |
|
|
|
|
|||||
2. По соотношению (2.4) определим молярную массу раство- |
|||||||||||||
ренного вещества: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СМ nB |
mB |
|
, |
||||||
|
|
|
|
M BV |
|
||||||||
|
|
|
|
|
|
|
|
V |
|
|
|||
M |
B |
|
|
mB |
|
2,3 |
|
|
|
92 г/моль. |
|||
|
|
0,1 0,25 |
|||||||||||
|
|
СМV |
|
|
|
|
|||||||
Пример 2.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
При 25 °С давление |
насыщенного пара воды составляет |
||||||||||||
3,166 кПа. Найти при той же температуре давление насыщенного пара над 8%-ным водным раствором уксусной кислоты CH3COOH.
Решение
1. Определим мольную долю растворенного вещества ХВ в 8%- ном водном растворе уксусной кислоты CH3COOH.
В 100 г раствора содержится 8 г уксусной кислоты (МВ =
= 60 г/моль) и 92 г воды (МА =18 г/моль).
Количества воды и кислоты соответственно равны: nА = 92/18 = 5,11 моль
nВ = 8/60 = 0,13 моль.
30
