
книги / Новые композиционные и керамические материалы
..pdfской реакции должна быть сопоставима с энергией активации поверхностной диффузии атомов реагирующих компонентов (T ≈ 0,3 Тпл), которая в полтора-два раза меньше, чем объемной
(T ≥ 0,5Тпл) [47–50].
Бытующее в литературе мнение, что энергия активации твердофазной химической реакции обычно большая, чем объемной диффузии (см., например, [46, 51]), является следствием неоправданного распространения закономерностей, установленных для газофазных реакций (где это положение справедливо), на твердофазные процессы. Как было показано еще В.И. Архаровым [52], аррениусовский формализм, разработанный для оценки энергии активации реакций в газовой фазе, использовать при изучении твердофазных химических реакций некорректно.
Первичным продуктом взаимодействия ТФВ с переходными металлами IV-VI групп является фаза с минимальным в данных условиях содержанием легкого элемента. Этот результат также не является неожиданным. Он согласуется с известным правилом ступеней Оствальда [53], уточненным позднее Н.В.Танцовым [54–56] (принцип минимального изменения энтропии).
2.1.2. Корреляция реакционной способности ТВФ со степенью их ионности
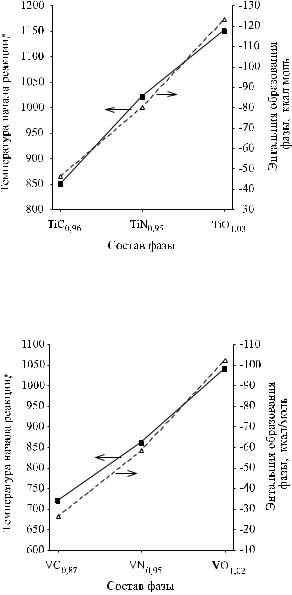
Важным результатом проведенного исследования является обнаружение взаимосвязи между температурой начала взаимодействия ТФВ с переходными металлами IV,V групп и степенью ионности ТФВ, оцениваемой по энтальпии их образования (рис. 8–11).
Действительно, в рядах TiC-TiN-TiO или VC-VN-VO температуры начала взаимодействия ТФВ с одноименными металлами или цирконием увеличиваются. При этом наблюдается четкая корреляция с энтальпией образования ТФВ: чем она больше по абсолютной величине (чем выше степень ионности ТФВ), тем выше температура начала реакции.
Наличие подобных корреляций свидетельствует о том, что вклад ионной составляющей в энергию решетки ТФВ весьма значителен. Согласуются с таким заключением и относительно высокие (по абсолютной величине) энтальпии образования
41

ТФВ. Например, для TiC, TiN и TiO они равны соответственно
–46, –80 и –124 ккал/моль [57], что сопоставимо с величиной стандартной энтальпии образования изоструктурного им хлорида натрия (–98 ккал/моль [58]).
С |
1200 |
|
-130 |
|
|
|
-120 |
|
|
Температура начала реакции, |
1150 |
|
|
|
|
|
|
||
1100 |
|
-110 |
Энтальпия образования фазы, ккал/моль |
|
|
-100 |
|||
|
|
|||
1050 |
|
-90 |
||
|
|
|||
1000 |
|
-80 |
||
950 |
|
-70 |
||
|
|
|||
900 |
|
-60 |
||
|
-50 |
|||
|
|
|||
850 |
|
-40 |
||
|
|
|
|
|
|
800 |
|
-30 |
|
|
TiC0,96 |
TiN0,95 |
TiO1,03 |
|
|
|
Состав фазы |
|
|
Рис. 8. Зависимость температуры начала реакции TiC,TiN и TiO с титаном от энтальпии образования ТФВ
С
Рис. 9. Зависимость температуры начала реакции VC,VN и VO с ванадием от энтальпии образования ТФВ
42
С
Рис. 10. Зависимость температуры начала реакции TiC,TiN и TiO с цирконием от энтальпии образования ТФВ
С
Рис. 11. Зависимость температуры начала реакции VC,VN и VO с цирконием от энтальпии образования ТФВ
43
Выявленные выше закономерности имеют, по-видимому, достаточно общий характер. Об этом свидетельствуют, в частности:
– результаты работы [59], в которой изучались реакции
карбидов Me(IV)C с металлами платиновой группы: |
|
ZrCx + Pt → Pt3Zr + C |
(23) |
ZrCx + Ir → Ir3Zr + C |
(24) |
HfCx + Pt → Pt3Hf + C |
(25) |
HfCx + Ir → Ir3Hf + C |
(26) |
– результаты работ [60,61], в которых исследовались особенности взаимодействия карбидов циркония и ниобия с бериллием:
ZrC0,98 |
+ Be → Be2C + ZrC0,98-x |
(27) |
NbC0,92 |
+ Be → Be2C + NbC0,92-x |
(28) |
NbC0,78 + Be → NbBe12 + (C) |
(29) |
|
– результаты исследования [62], в котором изучалась реакция карбида титана с твердым алюминием:
TiC0,97 + Al → Al4C3 + TiC0,97-x |
(30) |
2.2. Кинетика и механизм взаимодействия
ТВФ с никелем
Никель является одним из ведущих конструкционных материалов современного химического машиностроения. С целью модифицирования свойств никеля и сплавов на его основе в их состав часто вводят дисперсные добавки ТФВ [63]. Очевидно,
44
что без знания механизма взаимодействия ТФВ с никелем практически невозможно получить композиционный материал с желаемым сочетанием свойств.
2.2.1. Закономерности проявления фазовой нестабильности ТФВ в смесях с никелем
В данном разделе излагаются результаты исследования кинетики и механизма диффузионного взаимодействия порошкообразных (крупность 50÷63 мкм) препаратов ТФВ с никелем [64,65].
Брикетированные смеси исходных компонентов, содержащие 5, 20, 50 и 80 % никеля, отжигались в атмосфере чистого аргона при 1150°С в течение 1÷100 часов и анализировались методами РФА и РСМА. Для уточнения промежуточных составов тугоплавкой и металлической фаз проводилась процедура фазового разделения реагентов с последующим химическим анализом ТФВ и раствора. Металлическая фаза образца отделялась от тугоплавкой путем ее растворения в горячей соляной кислоте.
Выяснению подлежали следующие вопросы.
1.Являются ли системы ТФВ – никельквазибинарными?
Влитературе на этот счет можно встретить самые разнообразные мнения – квазибинарные, частично квазибинарные, неквазибинарные.
2.Каков характер растворения ТФВ в никеле – конгруэнтный или инконгруэнтный? Какова относительная скорость растворения ТФВ в никеле и чем она определяется?
3.Какова растворимость никеля в ТФВ? Зависит ли она от состава ТФВ?
45

4. Влияет ли никель на структурную стабильность ТФВ, их склонность к упорядочению?
Обобщенные результаты исследования приведены ниже в виде соответствующих кинетических зависимостей (рис. 12–17) и химических уравнений (31)–(58).
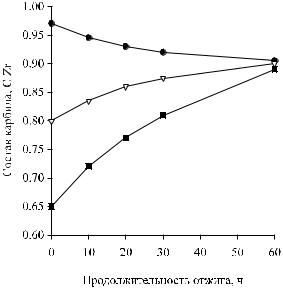
Рис. 12. Кинетика изменения состава карбидной фазы в смесях TiCx – 80 %Ni
Химизм взаимодействия
60 ч |
|
TiC0,97 + 80 % Ni TiC0,92 + Ni (3,5 %Ti) |
(31) |
60 ч |
|
TiC0,80 + 80 % Ni TiC0,92 + Ni (4,5 %Ti) |
(32) |
60 ч |
|
TiC0,52 + 80 % Ni TiC0,91 + Ni (6,0 %Ti) |
(33) |
60 ч
TiC0,97 + 20 %Ni TiC0,96 (0,2 %Ni) + Ni (ss) + 0,6 %C (34)
46
60 ч
TiC0,52 + 20 %Ni TiC0,60 (0,5 %Ni) + Ni (ss) + Ni3Ti (35)
Рис. 13. Кинетика изменения состава карбидной фазы в смесях ZrCx – 80%Ni
Химизм взаимодействия
|
60 ч |
|
ZrC0,97 + 80 % Ni ZrC0,90 + Ni (0,3 %Zr) |
(36) |
|
|
60 ч |
|
ZrC0,80 |
+ 80 %Ni ZrC0,90 + Ni (0,5 %Zr) |
(37) |
|
60 ч |
|
ZrC0,65 |
+ 80 %Ni ZrC0,89 + Ni (0,9 %Zr) |
(38) |
30 ч
ZrC0,97 + 20 % Ni ZrC0,96 (0,2 %Ni) + Ni (ss) + 0,7%C (39)
30 ч
ZrC0,65 + 20 %Ni ZrC0,70 (0,4 %Ni) + Ni (ss) + Ni5Zr (40)
47
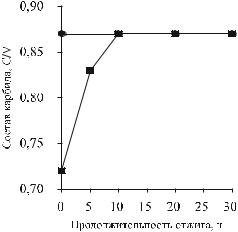
Рис. 14. Кинетика изменения состава карбидной фазы в смесях VCx – 80%Ni
Химизм взаимодействия
30 ч
VC0,87 + 80 %Ni VC0,87** (1,3 %Ni)+ Ni (6,0%V) (41)
10 ч
VC0,72 + 80 %Ni VC0,87* (0,5 %Ni) +
30ч
+Ni (3,5 %V) VC0,87* (0,9 %Ni) + Ni (7,0 %V)(42)
30 ч
VC0,87 + 20%Ni VC0,87** (1,5 %Ni) + Ni (ss) + 0,9%C (43)
30 ч
VC0,72 + 20%Ni VC0,82** (2,0%Ni) + Ni (ss) + NimVn (44)
*Фазовый переход порядок–беспорядок при 1140 ± 20°C.
**По данным ДТА, фазовый переход типа порядок–беспорядок в области температур 900–1350°C отсутствует.
48

Рис.15. Кинетика изменения состава карбидной фазы в смесях NbCx – 80%Ni
Химизм взаимодействия
30 ч
NbC096 + 80 %Ni NbC0,94 (0,8 %Ni) + Ni (1,9 %Nb)(45)
10 ч
NbC0,74 + 80 %Ni NbC0,90 (0,5 %Ni) +
30 ч
+ Ni (2,0 %Nb) NbC0,94 (1,2 %Ni) + Ni (5,2 %Nb) (46)
30 ч
NbC0,96 + 20%Ni NbC0,95 (1,8 %Ni) + Ni (ss) + 0,4 %C(47)
30 ч
NbC0,74 + 20%Ni NbC0,81* (2,5 %Ni) + Ni (ss) + Ni3Nb(48)
* По данным ДТА, фазовый переход типа беспорядок–порядок в области температур 800–1300°C отсутствует.
49
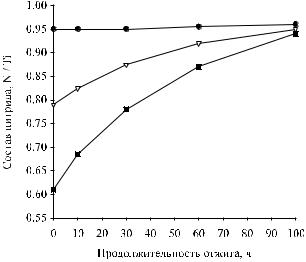
Рис. 16. Кинетика изменения состава нитридной фазы в смесях TiNx – 80%Ni
Химизм взаимодействия
|
100 ч |
|
TiN0,95 + 80 %Ni TiN0,96 + Ni (4,0 %Ti) + N2↑ |
(49) |
|
|
100 ч |
|
TiN0,79 |
+ 80 %Ni TiN0,95 + Ni (5,0 %Ti) |
(50) |
|
100 ч |
|
TiN0,61 |
+ 80 %Ni TiN0,94 + Ni (7,5 %Ti) |
(51) |
60 ч
TiN0,95 + 20 %Ni TiN0,95 (0,1 %Ni) + Ni (ss) + N2↑ (52)
60 ч
TiN0,61 + 20 %Ni TiN0,68 (0,4 %Ni) + Ni (ss) + Ni3Ti (53)
50
