
книги / Общая химическая технология. Лабораторный практикум
.pdf6. По полученным данным построить график зависимости степени разложения ( ) от температуры или от других факто-
ров (по заданию преподавателя).
7. Сделать вывод о влиянии температуры или других факторов по степени разложения карбоната кальция.
Контрольные вопросы
1.Перечислите факторы, влияющие на скорость и степень разложения известняка.
2.Дайтеопределения понятия «лимитирующие стадии процесса».
3.Чем объясняется выбор температурного режима обжига известника?
4.Опишите процесс обжига известняка как пример гетерогенного процесса в системе «газ – твердое».
5.Какова энергия активации реакции и влияние температуры на скорость химической реакции. Опишите способы изменения скорости химической реакции.
Список литературы
1.Шокин И.Н., Крашенинников С.А. Технология соды. – М.:
Химия, 1975. – 286 с.
2.Руководство к практическим занятиям по технологии неорганических веществ / М.Е. Позин [и др.]. – М.: Химия, 1986. – 368 с.
11
Лабораторная работа № 2
ОБЖИГ СЕРОСОДЕРЖАЩЕГО СЫРЬЯ
1. Цель работы
Экспериментальное исследование влияния режимных факторов (температуры, состава газа, содержания серы в сырье, размера частиц) на скорость обжига, т.е. на изменение концентрации SO2 в получающемся газе во времени. В лабораторной установке моделируется процесс обжига колчедана в неподвижном (стационарном) слое.
2. Теоретические сведения
Обжиг серосодержащего сырья является типовым процессом, применяемым в цветной металлургии в качестве первой стадии переработки концентрата цветного металла, в производстве серной кислоты при получении двуокиси серы и т.д. Закономерности, лежащие в основе этого процесса, справедливы для обжига любого сульфидного сырья: пирита FeS2, пирротина FenSn+1, халькопирита CuFeS2, медного блеска Cu2S, цинковой обманки ZnS и т.п. Скорость гетерогенного процесса, каким является обжиг сульфидных руд, зависит как от истинной скорости химической реакции на поверхности раздела фаз, так и от скорости подвода к поверхности и внутрь пор молекул кислорода и отвода газообразных продуктов обжига (внешняя и внутренняя диффузия). Суммарная скорость процесса определяется наиболее медленной стадией.
Многочисленными исследованиями установлено, что механизм процесса горения колчедана в значительной степени зависит от температуры его взаимодействия с кислородом. При
12
низких температурах (до 300 °С) возможно протекание реакции с образованием сульфата железа:
FeS2 3O2 FeSO4 SO2. |
(1) |
При более высоких температурах (более 300 °С) окисление пирита (основной составляющей серного колчедана) идет с воспламенением и преимущественно с образованием окислов железа.
В этом случае первой стадией горения пирита является его термическая диссоциация с образованием сульфида железа и парообразной серы:
FeS |
2 |
FeS 1S |
2 |
Q. |
(2) |
|
2 |
|
|
||
Сера сгорает с образованием сернистого ангидрида: |
|
||||
S2 2O2 2SO2 |
Q. |
(3) |
|||
Взаимодействие односернистого железа с кислородом протекает с образованием в конечных твердых продуктах окиси и окиси-закиси железа по следующим уравнениям:
4FeS 7O2 |
2Fe2O3 4SO2 Q, |
(4) |
3FeS 5O2 |
Fe3O4 3SO2 Q. |
(5) |
Одновременно процесс обжига следует рассматривать как ряд сложных кристаллохимических превращений, совершающихся в окислительной среде.
Проведем термодинамический анализ реакций (4) и (5). В справочной литературе находим значение энтальпии образования веществ, стандартные энтропии для веществ, участвующих в реакциях (табл. 1).
13
Таблица 1
Энтальпии образования веществ, стандартные энтропии для веществ, участвующих в реакциях
Вещество |
H2980 , кДж/моль |
S, Дж/(моль·К) |
FeS (тв) |
–100,4 |
60,29 |
O2 (газ) |
0 |
205,04 |
Fe2O3 (тв) |
–821,32 |
89,96 |
SO2 (газ) |
–296,9 |
248,10 |
Fe3O4(тв) |
–1117,71 |
151,46 |
Рассчитываем значение теплового эффекта по формуле:
H2980 v ( H2980 )продуктов v ( H2980 )реагентов,
где H2980 – это стандартная энтальпия веществ, участвующих в реакции при стандартных условиях; – стехиометрический коэффициент вещества в уравнении реакции.
–для реакции (3):
H2980 хим.р ((2 ( 821,32) 4 ( 296,9)) (4 ( 100,4)
2428,64кДж;
–для реакции (4):
H2980 хим.р (( 1117,71) 3 ( 296,9)) (3 ( 100,4)
1722,21кДж.
Рассчитаем значение энтропии для реакций по формуле:
S2980 v ( S2980 )продуктов v ( S2980 )реагентов,
где S2980 – стандартная энтропия веществ, участвующих в реакции при стандартных условиях; – стехиометрический коэффициент вещества в уравнении реакции:
14
–для реакции (3):
S2980 хим.р (2 89,96 4 248,1) (4 60,29 7 205,04)
504,12 Дж;
–для реакции (4):
S2980 хим.р (151,46 3 248,1) (3 60,29 5 205,04)
333,41Дж.
Рассчитаем величины стандартного потенциала реакций при температуре 298 °С по формуле:
G2980 H2980 T S2980 ,
где Т – температура реакции, К:
– для реакции (3):
G2980 2428,64 298 ( 504,12) 0,001 2278,41 кДж;
– для реакции (4):
G2980 1722,21 298 ( 333,41) 0,001 1623,43 кДж.
Таким образом, полученный результат говорит о необратимости реакций (3) и (4), следовательно, в этом случае полнота выгорания серы из колчедана будет зависеть исключительно от скорости процесса.
Исследования кинетики горения пирита показали, что при низких температурах скорость химической реакции меньше скорости диффузии. При этом скорость подвода молекул кислорода из газовой фазы к поверхности раздела фаз не тормозит процесс окисления. Следовательно, процесс протекает в кинетической области. При высоких температурах скорость химической реакции становится больше скорости диффузии. Поэтому подвод молекул кислорода к поверхности начинает определять суммарную скорость реакции.
15
Таким образом, процесс горения колчедана является сложным гетерогенным химическим процессом, протекающим в системе «твердое тело – газ». Скорость этого процесса является функцией температуры (Т), размера реакционной поверхности (F) и концентрации кислорода в зоне горения СО2 :
f T ,F,CO2 .
Скорость химической реакции зависит от энергии ее активации. Эта энергия необходима для эффективного соударения молекул (частиц), приводящего к их взаимодействию, т.е. энергия активации – минимальное количество энергии, которое требуется сообщить системе, чтобы произошла химическая реакция. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
|
k |
|
|
Ea R T ln |
|
|
, |
|
|||
|
A |
|
|
где k – константа скорости реакции; А – фактор частоты для реакции; R – универсальная газовая постоянная, значение которой составляет 8,31 Дж/(моль·К); T – температура, К.
Печи для обжига колчедана по конструктивным особенностям подразделяются на следующие типы: механические полочные; с кипящим слоем; комбинированные (с верхней подачей колчедана и кипящим слоем). Все печи являются аппаратами непрерывного действия, по тепловому эффекту – экзотермическими реакторами. Выделяющееся тепло перекрывает собственную потребность, поэтому его необходимо отводить.
Наибольшее промышленное применение для обжига серного колчедана получили печи с кипящим слоем. В этих печах достигается максимальная интенсивность обжига и наиболее высокая концентрация SO2 в обжиговом газе (до 15 %). Обжиг
16
серосодержащего сырья в кипящем слое имеет следующие преимущества:
1)высокая дисперсность обжигаемого материала, что резко уменьшает внутридиффузионное сопротивление и обеспечивает развитие поверхности соприкосновения фаз (F);
2)турбулентное омывание всех частиц потоком воздуха;
3)возможность снижения избытка воздуха, в результате чего повышается концентрация SO2 в газе;
4)высокая теплопроводность взвешенного слоя (тепло передается с большой скоростью – конвективным движением частиц) позволяет регулировать температуру размещением непосредственно в слое теплоотводящих элементов;
5)подвижность и текучесть материала во взвешенном слое, что облегчает выгрузку огарка из печи.
Процесс обжига в печах взвешенного слоя легко регулируется и может быть полностью автоматизирован. Основным не-
достатком печей кипящего слоя является большой пылеунос и, следовательно, высокая запыленность печного газа (до 300 г/м3), что сильно усложняет аппаратуру для очистки газа от пыли.
3.Экспериментальная часть Химические реактивы
1.Навеска серосодержащего сырья массой 0,8 г.
2.3%-ный раствор Н2О2.
3.0,1 н раствор NaOH.
Описание установки и методика проведения работы
Лабораторная установка состоит из трубчатой печи (в которой в фарфоровой лодочке стоит образец серосодержащего сырья), поглотительной склянки, бюретки с раствором гидроксида натрия, реометра, воздуходувки, осушителя воздуха.
17
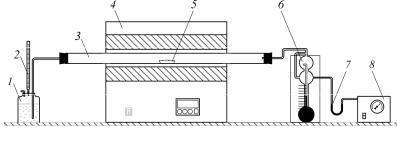
Воздух для обжига руды поступает в систему из воздуходувки 8, пройдя предварительно через поглотитель влаги 7, заполненный селикагелем или безводным хлоридом кальция. Осушенный воздух с заданной скоростью, измеряемой реометром 6, подается в трубчатую горизонтальную печь 4. Выходящий из печи газ поступает в поглотительную склянку 1, заполненную 3%-ным раствором перекиси водорода и снабженную бюреткой для непрерывного титрования 5. Объем перекиси водорода в поглотительной склянке составляет 70 мл.
Рис. 1. Схема лабораторной установки, исследования кинетики разложения серосодержащего сырья: 1 – поглотительная склянка; 2 – бюретка с раствором гидроксида натрия; 3 – реакционная трубка; 4 – трубчатая печь; 5 – фарфоровая лодочка с образцом; 6 – реометр; 7 – осушитель воздуха; 8 – воздуходувка
При взаимодействии диоксида серы с раствором перекиси водорода образуется серная кислота по реакции:
H2O2 SO2 H2SO4.
При образовании серной кислоты окраска метилоранжа меняется с оранжевой (нейтральная среда перекиси водорода) на розовую (кислая среда серной кислоты).
Титрование проводят 0,1 н раствором едкого натрия или калия в присутствии индикатора метилрота или метилоранжа.
18
Порядок выполнения работы
Студенты получают разрешение на проведение работы после того, как ознакомятся с методическими указаниями по выполнению лабораторной работы, рекомендуемой литературой, и после беседы с преподавателем.
Перед выполнением работы необходимо проверить лабораторную установку на герметичность. Для этого зажимами закрывают трубку на входе воздуха в систему, к шлангу на выходе подключают аспиратор и открывают кран на выходе воды из него. Если установка герметична, то через некоторое время вытекание воды из аспиратора прекратится. Если вода продолжает вытекать, это значит, что в системе присутствуют неплотности, для обнаружения которых поочередно проверяют каждую часть установки.
После проверки установки на герметичность ее продувают потоком воздуха. Устанавливают на терморегуляторе печи заданную преподавателем температуру, после чего печь включают в электросеть и доводят до заданной температуры. При достижении заданной температуры лодочку с навеской помещают в центральную зону печи и подают заданный расход воздуха или газовой смеси. Расход газа контролируют по реометру и поддерживают постоянным в течение всего эксперимента.
При барботировании обжигового газа через поглотитель окраска индикатора изменяется. Через заданные промежутки времени, определяемые по секундомеру, производится оттитровывание раствора в поглотительной склянке до достижения точки эквивалентности. Опыт продолжают до истечения заданного времени либо до полного выгорания серы из исходного сырья.
По завершении эксперимента лодочку с огарком удаляют из печи и помещают для охлаждения на керамическую или асбестовую подставку. Затем, изменяя начальные условия (температуру, крупность частиц или состав газовой смеси), эксперимент повторяют.
19

4. Обработка результатов
Обработка результатов лабораторных исследований
1. Результаты опытов выражают графически в виде кинематических кривых зависимости количества выгоревшей серы от времени при различных условиях. По полученным результатам производят расчеты количества выгоревшей серы за промежутки времени по формуле
GSO2 0,0032 VNaOH K,
где VNaOH – количество 0,1 н раствора щелочи, пошедшего на
титрование, см3; K – поправочный коэффициент к нормальности раствора едкого натрия (для 0,1 н раствора NaOH, поправочный коэффициент составляет 1,5); 0,0032 – количество серы (г), соответствующее 1 см3 0,1 н раствора щелочи по реакции:
SO3 2NaOH Na2SO4 H2O.
2. Зная количество серы в навеске колчедана заданного состава, рассчитывают процентное содержание выгоревшей серы за каждый промежуток времени к общему ее количеству, т.е. определяют коэффициент использования серы. По опытным данным рассчитывают также коэффициент избытка воздуха (А) по отношению практического количества к теоретическому по формуле
АGпракт . G теор
Практическое количество воздуха (Gпракт ) определяют по
опытным данным, зная объемную скорость воздуха и общее время опыта. Теоретическое количество воздуха (Gтеор), тре-
буемое для полного выгорания серы из навески колчедана дан-
20
