
книги / Физическая и коллоидная химия. Дисперсные системы
.pdfК ультрамикрогетерогенным системам относятся золи, к микрогетерогенным – пены, эмульсии, суспензии. Наиболее распространенными грубодисперсными системами являются системы «твердое – газ», например песок, щебень.
Истинные (молекулярные и ионные) растворы имеют размер частиц менее 10–7 см. Здесь уже нет поверхности раздела фаз, и их не относят к дисперсным системам.
Ниже приведены некоторые примеры дисперсных систем с указанием наибольшего размера частиц дисперсной фазы:
Дисперсная система |
Размер частиц |
|
Грунты песчаные |
>50 мкм |
|
Грунты пылеватые |
1–50 мкм |
|
Эритроциты крови человека |
7 |
мкм |
Кишечная палочка |
3 |
мкм |
Вирус гриппа |
100 нм |
|
Золь Au (синий) |
50 нм |
|
Муть в природных водах |
10–100 нм |
|
Дым (древесный уголь) |
30–40 нм |
|
Золь Au (красный) |
20 нм |
|
Вирус ящера |
10 нм |
|
Молекула гликогена |
10 нм |
|
Золь Au (зародышевый) |
3 |
нм |
Тонкие поры угля |
1–10 нм |
|
Связнодисперсные системы (пористые тела) по классификации IUPAC подразделяют на микро-, мезо- и макропористые:
Связнодисперсные системы |
Диаметр пор, нм |
Микропористые |
Менее 2 |
Мезопористые |
2–50 |
Макропористые |
Более 50 |
11
2.5. Классификация по фазовой различимости
По фазовой различимости выделяют:
1)суспензоиды – системы, к частицам в которых применимо термодинамическое понятие фазы (микрокристаллики, капли жидкости, аморфные образования);
2)молекулярные коллоиды – растворы ВМС. Это истинные (молекулярные) растворы, гомогенные системы. Однако они обладают многими признаками коллоидного состояния благодаря большому размеру макромолекул (имеют малую скорость диффузии, не проходят через ультрафильтры, обладают светорассеянием, имеют слабо выраженные коллигативные свойства);
3)ассоциированные коллоиды – системы, частицы в которых представляют собой ассоциаты молекул (или ионов), находящиеся в термодинамическом равновесии с молекулярно растворенной частью вещества (мыла, многие красители). Степень ассоциации обычно невелика (десятки или несколько сотен молекул), к таким частицам не может быть в полной мере применимо термодинамическое определение понятия фазы.
2.6.Классификация по топографическому признаку
(форме частиц)
Различают ДС:
1)корпускулярные (частицы малы во всех измерениях);
2)фибриллярные (волокнистые – частицы малы по двум измерениям);
3)ламинарные (пленочные – малой является только толщина).
3.МЕТОДЫ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ
Для приготовления коллоидных растворов необходимо обеспе-
чить степень диспергирования 10–5–10–7 см; подобрать дисперсионную среду, в которой не растворяется вещество дисперсной фазы, обеспечить устойчивость системы введением в нее стабилизаторов.
12
Существуют две группы методов получения коллоидных систем: диспергирование и конденсация.
Для получения коллоидных систем диспергированием необходимо затратить внешнюю механическую энергию на преодоление межмолекулярных сил и увеличение свободной поверхностной энергии вещества.
Технически это осуществляется дроблением, измельчением, растиранием на дробилках, в жерновах, шаровых мельницах, вальцах и др. Раздробление до размеров 1·10–7 м достигается в специальных коллоидных мельницах, в которых диспергируемое вещество находится в узком зазоре между быстро вращающимся ротором (10–20 тыс. об/мин) и неподвижным корпусом.
Жидкости распыляются и разбрызгиваются с помощью форсунок, волчков, вращающихся дисков, центрифуг. Диспергирование газов осуществляют главным образом с помощью барботирования их через жидкость. В пенополимерах, пенобетоне, пеногипсе газы получают с помощью веществ, выделяющих газ при повышенной температуре или в химических реакциях.
Диспергирование обычно ведут, добавляя стабилизирующие вещества, препятствующие слипанию раздробленных частиц.
В последнее время широкое применение находит ультразвуковой метод, в котором диспергирование происходит также за счет разрывающих усилий. Резкие локальные изменения давления (порядка тысяч атмосфер), происходящие за промежутки времени порядка 10–4–10–5 с, приводят к разрыву не только жидкостей, но и твердых тел. Таким способом получают органозоли хрупких металлов и сплавов, гидрозоли серы, гипса, графита и т.д.
Электрический метод основан на образовании вольтовой дуги между электродами из диспергируемого металла, помещенными в воду. Сущность метода состоит в первоначальном распылении металла электрода дуги (диспергирование) с последующей конденсацией атомов металла и образованием агрегатов коллоидных размеров. Поэтому он соединяет в себе черты диспергационных и конденсационных методов.
13
При конденсации происходит образование гетерогенной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Конденсация обусловлена действием сил притяжения между частицами.
Возможна физическая конденсация – образование золя из пересыщенного пара в результате уменьшения температуры смеси или увеличения ее давления.
Так, к физической конденсации относится конденсация водяного пара на поверхности находящихся в воздухе твердых или жидких частиц, ионов или заряженных молекул (туман, смог).
К физической конденсации относится и метод замены растворителя. Он основан на том, что раствор вещества прибавляют понемногу к жидкости, которая хорошо смешивается с растворителем, но в которой растворенное вещество настолько мало растворимо, что выделяется в виде высокодисперсной фазы. Примером может служить получение гидрозолей серы, холестерина или канифоли, получаемых вливанием спиртовых растворов этих веществ в воду.
При химической конденсации образование дисперсной системы происходит с химической реакцией. Обычно используют методы осаждения: гидролиз, окисление, восстановление, обмен.
Приведем несколько примеров реакций различных типов, в результате которых при соответствующих условиях могут образоваться вещества в коллоидном состоянии:
CaCl2 + 2AgNO3 =2 AgCl + Ca(NO3)2 (реакция обмена); 2H2S + O2 = 2H2O + 2S (реакция окисления-восстановления); Fe(OH)2Cl + H2O = Fe(OH)3 + HCl (реакция гидролиза).
Дисперсные системы можно также получить методом пептиза-
ции.
Пептизация – это перевод рыхлого осадка, полученного в результате коагуляции, снова в коллоидный раствор путем промывания осадка растворителем с целью вымывания избытка коагулирующих ионов. Из осадка удаляются коагулирующие ионы, обра-
14
зуются двойные электрические слои и сольватные оболочки вокруг коллоидных частиц. Пептизация – процесс, обратный коагуляции.
Различают следующие виды пептизации:
–пептизация осадка электролитом (адсорбционная пептизация). Отталкивание частиц осадка друг от друга вызывается двойными ионными слоями, образованными на поверхности частиц за счет адсорбции ионов добавляемого электролита-пептизатора;
–пептизация путем поверхностной диссоциации. Двойной ионный слой образуется за счет диссоциации молекул на поверхности твердой фазы (например, образование растворимых соединений);
–пептизация путем промывания осадка. Применяется в случае высокой концентрации электролита, когда на поверхности частиц осадка есть двойные ионные слои, но они сжаты. Промывание водой уменьшает концентрацию электролита, что приводит к увеличению двойного ионного слоя и силы электростатического отталкивания и вызывает коллоидное растворение осадка.
Пептизацию используют для получения жидких дисперсных систем из порошков или паст в химической и пищевой технологии. Иногда пептизация вредна, например при водоочистке, осветлении вин и др.
Несмотря на широкое применение диспергационных методов, они не могут быть применимы для получения дисперсных систем с размером частиц менее 100 нм. Такие системы получают конденсационными методами.
4. СТРОЕНИЕ МИЦЕЛЛЫ ГИДРОЗОЛЯ
Коллоидная частица имеет сложное строение. Характерной особенностью является наличие на ее поверхности заряда, обусловленного адсорбцией ионов. Основную часть мицеллы составляет агрегат, состоящий из большого числа атомов или молекул нерастворимого в воде вещества. На поверхности агрегата фиксируются потенциалопределяющие ионы. Эта часть мицеллы называется
15

ядром. Вокруг ядра располагаются противоионы адсорбционного слоя. Ядро вместе с адсорбционным слоем противоионов образует коллоидную частицу. Она всегда имеет заряд, соответствующий знаку заряда потенциалопределяющих ионов. Остальные противоионы образуют диффузионный слой мицеллы.
Рассмотрим строение мицеллы йодида серебра (рис. 2), которая образуется в реакции
AgNO3 + KI = KNO3 + AgI.
а |
б |
Рис. 2. Строение мицеллы иодида серебра
Возможны два варианта образования мицеллы:
1. В растворе есть избыток йодид-анионов (т.е. к раствору KI по каплям добавляют раствор нитрата серебра) (рис. 2, а). Ядро мицеллы образуется из золя малорастворимого йодида серебра AgI. На его поверхности в соответствии с правилом избирательной адсорбции начинают сорбироваться йодид-ионы (I–), которые находятся в избытке и могут пойти на достройку ядра. Они образуют отрицательный заряд ядра и являются потенциалопределяющими. К этому слою присоединяются положительно заряженные ионы калия (K+), которые образуют адсорбционный слой противоионов. Часть ионов калия слабо связана с ядром и может диссоциировать, формируя диффузионный слой ионов. Строение мицеллы будет следующим:
{[(AgI)m · nI–](n – x)K+}x– · xK+.
16
PNRPU
Агрегат (AgI)m и потенциалопределяющие ионы nI–образуют ядро мицеллы [(AgI)m·nI–]. В свою очередь, ядро и противоионы адсорбционного слоя (n – x)K+ составляют заряженную частицу {[(AgI)m · nI–](n – x)K+}x–, нейтрализация которой идет за счет диффузионного слоя ионов xK+, поэтому мицелла в целом электронейтральна.
2. В растворе избыток ионов серебра (к раствору нитрата серебра добавляют по каплям раствор йодида калия) (рис. 2, б). В этом случае образуется мицелла с противоположным знаком потенциалопределяющих ионов:
{[(AgI)m · nAg+] (n – x)NO3–}x+ · xNO3–.
5. ОПТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ
Исторически сложилось так, что при изучении дисперсных систем в первую очередь обратили внимание на их оптические свойства. Большой вклад в изучение этих свойств внесли М. Фарадей, Дж. Тиндаль, Дж. У. Рэлей и др.
Дисперсные системы характеризуются особыми оптическими свойствами, которые обусловлены их главными признаками: дисперсностью и гетерогенностью.
На оптические свойства дисперсных систем в значительной степени влияют размер и форма частиц. Прохождение света через коллоидный раствор сопровождается такими явлениями, как поглощение, отражение, преломление и рассеяние света.
Преобладание какого-либо из этих явлений определяется соотношением между размером частиц дисперсной фазы и длиной волны падающего света. В грубодисперсных системах в основном наблюдается отражение света от поверхности частиц. В коллоидных растворах размеры частиц сравнимы с длиной волны видимого света, что предопределяет рассеяние света за счет дифракции световых волн.
17

Светорассеяние в коллоидных растворах проявляется в виде опалесценции – матового свечения (обычно голубоватых оттенков), которое хорошо заметно на темном фоне при боковом освещении золя. Причиной опалесценции является рассеяние света на коллоидных частицах. С опалесценцией связано характерное для коллоидных систем явление – эффект Тиндаля: при пропускании пучка света через коллоидный раствор с направлений, перпендикулярных лучу, наблюдается образование в растворе светящегося конуса
(рис. 3).
Сосуд с коллоидным раствором
Источник |
|
|
света |
Линзы |
Матовое свечение |
|
Рис. 3. Конус Тиндаля
Процесс дифракционного светорассеяния на частицах, размер которых значительно меньше длины волны, описывается уравнением Рэлея, связывающим интенсивность рассеянного единицей объема света Iр с числом частиц в единице объема ν, объемом частицы V, длиной волны λ, интенсивностью I0 падающего излучения и показателями преломления дисперсной фазы и дисперсионной сре-
ды n1 и n0.
Формула Рэлея для сферических частиц имеет вид:
Ip = |
24π3V 2ν |
|
n2 |
−n2 |
|
|
|
|
|
4 |
|
1 |
0 |
|
I0. |
(3) |
|
λ |
2 |
2 |
||||||
|
|
n1 |
+2n0 |
|
|
|
||
Из уравнения (3) видно, что чем меньше длина волны падающего излучения, тем больше будет рассеяние. Следовательно, если
18
на частицу падает белый свет, наибольшее рассеяние будут испытывать синие и фиолетовые компоненты.
На явлении светорассеяния основан метод определения концентрации и степени дисперсности коллоидных систем – нефело-
метрия.
Интенсивность рассеянного света определяется уравнением Рэлея (3). Если взять два золя, у которых различаются только концентрации (С1 и С2), а все остальные величины одинаковы, то при освещении золя пучком света одинаковой интенсивности получим:
I1 |
= C1 . |
(4) |
|
I2 |
|||
C2 |
|
Интенсивность рассеянного света прямо пропорциональна концентрации частиц, а следовательно (при равных степенях дисперсности), и массовой концентрации дисперсной фазы. Поэтому, зная концентрацию одного из золей С1 (стандартный золь известной концентрации), можно легко определить концентрацию второго золя:
C |
2 |
= |
C1 I2 |
. |
(5) |
|
|||||
|
|
I1 |
|
||
|
|
|
|
||
В свою очередь, при равной концентрации стандартного и исследуемого золей можно определить размеры частиц золя, зная размер частиц стандартного золя:
I |
1 |
= |
V |
= |
d 3 |
|
|
1 |
1 . |
(6) |
|||
I |
|
V |
||||
2 |
|
|
d 3 |
|
||
|
|
2 |
|
2 |
|
Приборы для изучения рассеяния света дисперсными системами (рис. 4) делятся на нефелометры, турбидиметры и микроскопы. В нефелометрии измеряется интенсивность света, рассеянного дисперсной системой. В турбидиметрии измеряют интенсивность света, прошедшего через стандартную и исследуемую дисперсные системы.
Спомощью нефелометрии можно определить концентрацию
иразмер частиц в соответствии с уравнениями (4) и (6).
19
а |
б |
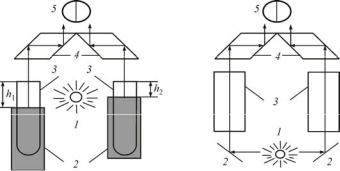
Рис. 4. Схемы приборов для изучения рассеяния света дисперсными системами: а – нефелометра: 1 – источник света; 2 – подвижные экраны; 3 – кюветы с исследуемым и стандартным золем; 4 – призмы; 5 – окуляр; б – турбидиметра: 1 – источник света; 2 – зеркала; 3 – кюветы с исследуемым и стандартным золем; 4 – призмы; 5 – окуляр
Поскольку размер коллоидных частиц не позволяет наблюдать их при помощи обычного микроскопа, то их наблюдают в ультрамикроскопе.
В обычном микроскопе объект наблюдают в проходящем свете, поэтому поле зрения освещено ярче изображения объекта. В ультрамикроскопе применяют боковое освещение. При этом свет не попадает в объектив микроскопа и в глаз наблюдателя, поэтому фон поля зрения микроскопа темный. На общем темном фоне становится заметным слабый свет, рассеиваемый коллоидными частицами. Они представляются наблюдателю в виде отдельных светящихся точек.
Ультрамикроскопия позволяет наблюдать броуновское движение частиц. По количеству светящихся точек можно подсчитать количество частиц в единице объема (частичную концентрацию). Зная общую массу диспергированного вещества и найдя число частиц во всем объеме, можно вычислить массу одной частицы, а по массе, учтя плотность диспергированного вещества, определить объем и размер частиц.
20
