
Порядок выполнения лабораторной работы:
Используя программу Microsoft Exсel, произвели расчет эффективных коэффициентов диффузии реагента реакции при различных температурах. Результаты расчетов приведены в таблице 2.
Таблица 2 – Результаты расчета эффективных коэффициентов диффузии при различных температурах
Температура, К |
Эффективный коэффициент диффузии Dэфф, м2/с |
803 |
4,05∙10-9 |
813 |
4,07∙10-9 |
823 |
4,10∙10-9 |
833 |
4,12∙10-9 |
843 |
4,15∙10-9 |
Также по уравнению Аррениуса произвели расчет констант скорости химической реакции при различных температурах протекания химической реакции. Результаты приведены в таблице 3.
Таблица 3 – Результаты расчета констант скорости химической реакции при различных температурах протекания химической реакции
Температура, К |
803 |
813 |
823 |
833 |
843 |
k, с-1 |
3,85 |
4,74 |
5,81 |
7,08 |
8,60 |
По формуле 1 рассчитали значение параметра Тиле используя исходные данные (таблица 1). Также произвели расчет параметра, варьируя температуру и радиус зерна катализатора. Результаты приведены на рисунках 1 и 2, соответственно.

Рисунок 1 – График зависимости значения параметра Тиле от температуры
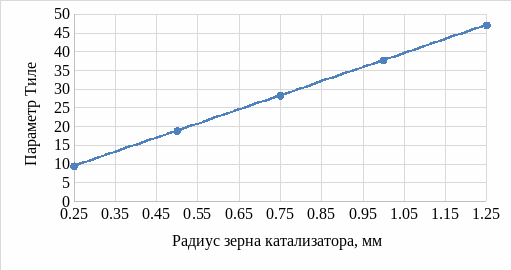
Рисунок 2 – График зависимости значения параметра Тиле от радиуса зерна катализатора
По формуле 2 рассчитали значение фактора эффективности используя полученные значения параметра Тиле. Результаты приведены на рисунках: 3 – для различных температур проведения процесса, 4 – для различных значений радиуса зерна катализатора.

Рисунок 3 – График зависимости значения фактора эффективности от температуры
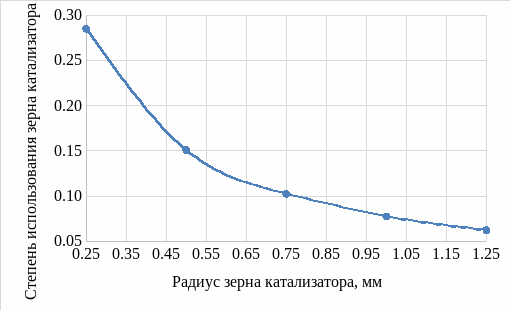
Рисунок 4 – График зависимости значения фактора эффективности от радиуса зерна катализатора
Варьируя значения расстояния от центра зерна катализатора до его поверхности от 0,05 до 0,5 мм, рассчитали безразмерный радиус. Полученные значения безразмерного радиуса, а также значение параметра Тиле при температуре 823 К подставили в формулу 3, приняв концентрацию на поверхности зерна катализатора равной 1 моль/л. Произвели расчет концентрации реагента в определенных точках внутренней поверхности катализатора (на расстоянии от центра катализатора). Результаты приведены на рисунке 5.
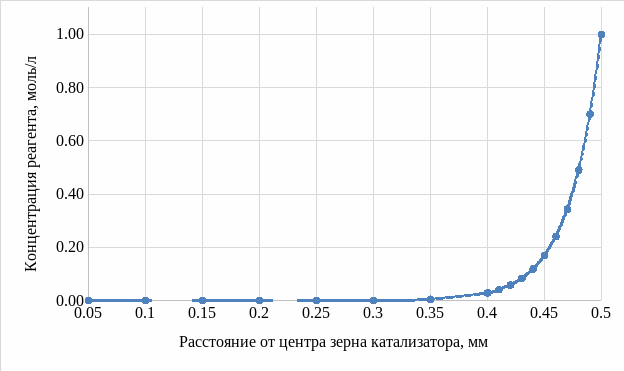
Рисунок 5 – Распределение концентрации реагента по внутренней поверхности зерна катализатора
Вывод:
В ходе лабораторной работы ознакомились с методикой построения математических моделей процессов, протекающих в зерне катализатора сферической формы; рассчитали макрокинетические параметры: фактор эффективности и параметр Тиле. Исследовали зависимость данных факторов от температуры проведения процесса и от радиуса зерна катализатора (рисунки 1, 2, 3, 4).
Исходя из полученных графических зависимостей, с ростом температуры проведения процесса значение параметра Тиле увеличивается, следовательно, фактор эффективности стремится к нулю, по причине увеличения константы скорости химической реакции, т.е. увеличения скорости химической реакции на поверхности зерна катализатора. Это означает, что данный гетерогенный процесс проходит в диффузионной области, то есть наблюдаемая скорость процесса будет всецело определяться скоростью диффузии. Управляющим параметром данного процесса является скорость подачи реагента.
При увеличении значения радиуса зерна катализатора значение параметра Тиле линейно растет, и степень использования зерна катализатора также уменьшается.
Исследовали изменение концентрации реагента в зерне катализатора (рисунок 5). Результат исследования говорит о том, что большая часть зерна катализатора используется неэффективно, следовательно, целесообразно уменьшать размер зерна.
