
- •Лекция № 2 Химия белков
- •Лекция №3 Физико – химическое свойства белков
- •Лекция №4 Классификация белков. Простые и сложные белки. Нуклеопротеиды. Хромопротеиды.
- •Свойства днк
- •Лекция №5 Сложные белки. Гликопротеиды (углеводнобелковые комплексы), липопротеды (липид-белковые комплексы) и фосфопротеиды.
- •Гликолипиды
- •Строение мембран
- •Белки мембран
- •Общие свойства мембран
- •Функция мембран
- •Лекция 6: Ферменты, их роль в обмене веществ
- •Лекция№7 Механизм ферментативного катализа.
- •Лекция 8 Витамины – как коферменты
- •Лекция 9
- •Лекция 10:
- •Гипофиз,
- •Эндокринные железы
- •Лекция № 12. Биологическое окисление.
- •Лекция 13 Окислительное фосфорилирование. Хемиоосмотическая теория окислительного фосфорилирования
- •Лекция №14 Обмен и функции углеводов. Общая схема источников и путей расходования глюкозы. Анаэробный распад углеводов, судьба молочной кислоты
- •3 Фаза обмена углеводов- Метаболизм.
- •Лекция №15
- •Синтез гликогена
- •Лекция № 16 Прямое окисление углеводов. Нарушения углеводного обмена. Сахарный диабет. Гликогенозы
Лекция№7 Механизм ферментативного катализа.
План лекции:
1.Регуляция действия ферментов(по типу обратной связи, аллостерический механизм).
2. Ингибиторы ферментов.
3. Энзимопатии
Цель лекции:
Для того чтобы могла осуществляться химическая реакция, молекулы должны обладать определенной энергией, необходимой для преодоления энергетического барьера. Этот барьер определен силами отталкивания между молекулами. Энергия, которую необходимо сообщить молекулам, чтобы между ними произошло взаимодействие – называется энергией активации. Активировать молекулы можно различными способами (нагреванием, облучением, с помощью катализаторов). Катализаторы снижают энергию активации. В присутствии катализатора реакция идет обходным путем, за счет образования промежуточных соединений. Показано, что происходит адсорбция субстрата на активном центре фермента , образуется фермент-субстратный комплекс.
За счет, каких связей удерживается этот комплекс?
За счет электростатического взаимодействия, если субстрат имеет заряженные группы.
За счет водородных связей.
За счет гидрофобного взаимодействия.
Итак три вида связей , которые удерживают фермент-субстратный комплекс.
Под действием фермента в субстрате происходит деформация молекулы субстрата, расшатывания связей , разрыв связей, которые приводят к образованию продукта реакции, которые удаляются с активного центра.
Е +S →ES →E + P
Амилаза+крахмал→амилазокрахмал→амилаза+глюкоза


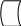

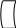

 →
→ +
→
→ +
Все изменения происходят с субстратом, фермент остается без изменения и поэтому незначительное количество фермента способно катализировать большое количество субстрата. Реакция идет быстро.
Классификация ферментов.
Название ферментов происходит от названия субстрата, на который он действует, при этом прибавляя окончание АЗА.
Например, мальтоза – мальтаза, сахароза – сахараза, либо по типу реакции гидролазы, дегидрогеназы и т.д.
Современная классификация была применена в 1961 году на Всемирном конгрессе биохимиков.
Все ферменты делятся на 6 классов:
Оксидоредуктазы Гидролазы
Лиазы
Изомеразы
Лигазы
Оксидоредуктазы участвуют в окислительно-восстановительных реакциях, Трансферразы – участвуют в реакциях транспорта различных групп, гидролазы – в реакция гидролиза, лиазы - в реакциях расщепления без участия воды, Изомеразы – участвуют в реакциях образования изомеров, и лигазы участвуют в реакциях синтеза.
Каждый фермент имеет кодовый номер, состоящих из 4 цифр, разделенных точками. Первая цифра указывает на класс фермента, на порядковый номер. Пример щелочная фосфотаза – 3.1.3.1
Топография, локализация фермента
Клетка состоит из ядра, в которой содержится наименьшее количество ферментов: ДНКаза, АТФаза, ЛДГ.
Митохондрии - энергетические станции организма, где располагаются ферменты дегидрогеназы, участвующие в окислительно-восстановительных реакциях.
Микросомы :щелочная РНКаза гл. 6 фосфатаза, цитохром С.
Лизосомы : гидролитические ферменты , кислая РНКаза, кислая фосфатаза, катенеины.
Каждая структура имеет свои специфические ферменты. Только при повреждении клетки эти ферменты выходят из клеток и попадают в кровь. Активность ферментов в крови незначительна, и повышается при нарушении проницаемости клеточных мембран, т.е. при патологических процессах.
Максимум активности зависит от локализации фермента и от молекулярного веса. Чем меньше молекулярный вес, тем быстрее они появляются в крови и активность увеличивается. Наибольшая активность ферментов в печени, мышцах, почках. Определение активности ферментов используют для диагностики различных заболеваний.
Например: трансаминаза, участвующая в реакциях трансаминирования, т. е. переносе NН2 группы с одной аминокислоты на кетокислоту используют для ранней диагностики заболеваний печени.
АлТ-аланинтрансаминаза – максимум активности при вирусном гепатите, в инкубационном периоде, при безжелтушных формах гепотита, при стертых формах болезни Боткина. Норма – 0.1 – 0,68 ммоль/л.
АсТ – аспартаттрансаминаза в норме в крови 0,1 – 0,45 ммоль\л, повышается при инфаркте миокарда в первые часы и достигает максимума через 10-12 часов от начала инфаркта.
Креатинфосфокиназа участвует в расщеплении креатинфосфата, увеличивается при инфаркте миокарда, уменьшается при дистрофии мышц.
Изменения, связанные с нарушением активности ферментов, называются энзимопатии. Они бывают врожденные и приобретенные. Все ферменты являются набором генов. Каждый ген обусловливает появление того или иного белка-фермента. Если происходит мутация генов, нарушается последовательность аминокислот, и появляются аномальные ферменты.
Если аминокислота стоит далеко от активного центра, то это не приводит к патологии. В противном случае происходит блокирование синтеза того или иного фермента.
Врожденные нарушения превращения фенилаланина в тирозин, приводит к появлению фенилпирувата, уменьшение тироксина приводит к врожденному кретинизму, а меланина к альбинизму.
При отсутствии фермента гидроксилазы из фенилаланина тирозин не образуется, а образуется фенилпируват, который выделяется с мочой. Фенилпируват имеет кетогруппу, которая действует на ЦНС и это приводит к олигофрении. ЦНС развивается в течение 3-х лет, если у ребенка исключить из рациона фенилаланин, то такого ребенка можно вылечить.
Тирозин в щитовидной железе превращается в гормон тироксин. При отсутствии фермента,участвующего в этой реакции развивается кретинизм. Из тирозина образуется пигмент меланин, при отсутствии фермента развивается альбинизм.
Эндокринные заболевания можно рассматривать как энзимопатии. Многие инфекционные заболевания выделяют токсины, которые блокирует активный центр фермента.
При любом ранении нарушается поступления субстратов, и следовательно нарушается образование фермент-субстратного комплекса. Накопление метаболитов приводит к ухудшению состояния организма.
Литература:
А. Основные: 1. Биохимия. Т.Т.Берёзов, Б.Ф.Коровкин. 2010
2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976
2.Биохимия. Р.Страер. 1985
3.Северин. 2003
