
- •Лекция № 2 Химия белков
- •Лекция №3 Физико – химическое свойства белков
- •Лекция №4 Классификация белков. Простые и сложные белки. Нуклеопротеиды. Хромопротеиды.
- •Свойства днк
- •Лекция №5 Сложные белки. Гликопротеиды (углеводнобелковые комплексы), липопротеды (липид-белковые комплексы) и фосфопротеиды.
- •Гликолипиды
- •Строение мембран
- •Белки мембран
- •Общие свойства мембран
- •Функция мембран
- •Лекция 6: Ферменты, их роль в обмене веществ
- •Лекция№7 Механизм ферментативного катализа.
- •Лекция 8 Витамины – как коферменты
- •Лекция 9
- •Лекция 10:
- •Гипофиз,
- •Эндокринные железы
- •Лекция № 12. Биологическое окисление.
- •Лекция 13 Окислительное фосфорилирование. Хемиоосмотическая теория окислительного фосфорилирования
- •Лекция №14 Обмен и функции углеводов. Общая схема источников и путей расходования глюкозы. Анаэробный распад углеводов, судьба молочной кислоты
- •3 Фаза обмена углеводов- Метаболизм.
- •Лекция №15
- •Синтез гликогена
- •Лекция № 16 Прямое окисление углеводов. Нарушения углеводного обмена. Сахарный диабет. Гликогенозы
Лекция № 12. Биологическое окисление.
План лекции:
Тканевое дыхание.
Ферменты дыхательной цепи.
Строение НАД, ФАД, ФМН
4. Цитохромы
Цель лекции: Формирование знаний о биологическом окисление или тканевом дыхании клеток.
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа: поступление веществ (пищи) в организм, метаболизм и выделение конечных продуктов из организма.
В желудочно-кишечном тракте продукты питания перевариваются до простых веществ, всасываются в кровь и включаются в промежуточный обмене. Промежуточный обмен включают 2 типа реакций: катаболизм и анаболизм.
Катаболизм- это процесс расщепления органических веществ (белков, жиров, углеводов) до конечных продуктов (СО2, H2O, мочевина)
Реакция катаболизма сопровождается выделением энергии (экзергонические реакции).
Энергия освобождающаяся в ходе окисления либо рассеивается в виде тепла, либо превращается в АТФ.
Организм превращает около 40% энергии, выделившийся при окислении, в энергию макроэргических связей АТФ.
Анаболизм – это процесс синтеза органических веществ из простых мономеров, которые протекают с использованием энергии (эндерганические реакции).
Благодаря тому, что в организме происходят эти противоположные процессы возможно состояние гомеостаза.
Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для окисления.
Биологическое окисление- это ферментативное окисление различных субстратов (жиров, белков, углеводов) живыми организмами.
В результате биологического окисления освобождается потенциальная энергия заключенная в молекулах органических веществ. За счет этой энергии осуществляются все биохимические процессы (мышечное сокращение, секреция, передача нервного возбуждения).
Биологическое окисление белков, жиров и углеводов проходят в 3 этапа:
Образование С2 фрагментов (ацетил КоА)
Окисление ацетил КоА в цикле трикарбоновых кислот, с образованием СО2 и водорода, который акцептируется в НАД, НАДФ, ФАД.
Окисление НАДН, НАДФН, ФАДН2 в дыхательной цепи с участием кислорода, что приводит к образованию воды и энергии.
По химической сущности биологическое окисление прямо противоположно фотосинтезу, которое происходит в зеленых листьях:
солнечная энергия
 6СО2
+ 6Н2О
С6Н12О6
+ 6О2
- фотосинтез
6СО2
+ 6Н2О
С6Н12О6
+ 6О2
- фотосинтез

биологическое окислении
Используемый молекулярный кислород живых существ вызывает распад органических веществ до СО2 и Н2О.
Под окислением понимают отщепление электронов и протонов от субстрата водорода, а под восстановлением- присоединение электронов и протонов.
При окислении происходит:
отнятие водорода
присоединение кислорода
увеличение положительного и уменьшение отрицательного заряда
При восстановлении происходит противоположное явление:
присоединение водорода
отнятие кислорода
увеличение отрицательного заряда
Все реакции, идущие с отдачей электронов называются окислительными, а реакции присоединения электронов- восстановительными. Поэтому эти реакции называют окислительно-восстановительными.
Окислительно-восстановительная система требует наличия окислителя и восстановителя. Она состоит из:
донора электронов, вещества способного отдавать электроны.
Акцептора электронов – вещества способного принимать электроны.
 Донор
е + акцептор
Донор
е + акцептор
Способность восстановиться, отдавать электрон другому веществу представляет восстановительный или редокс потенциал данной реакции.
Для каждой окислительно-восстановительной пары свой редокс-потенциал.
НАД+/НАДН- - 0, 32
КоQ+/КоQН2- +0,04
Цитохром в- +0, 07
с1- +0,23
с- +0,25
а- +0,29
а3- +0,55
½ О2+2Н+2еН20- +0,82
Разные редокс-пары обладают различным сродством к электрону.
Чем более отрицателен редокспотенциал, тем сильнее выражена способность данной пары отдавать электроны.
НАД+/ НАДН - -0,32 – это говорит о высокой способности ее отдавать электроны, т. е. играть роль окислителя.
Н2 О2/Н2О- +0,82 – у этой пары наивысшая способность принимать электроны.
Основы современной теории биологического окисления были положены академиком Палладиным. Значительный вклад в изучение биологического окисления внесли Варбург, Виланд, Кребс, Митчелл, Энгельгард, Северин, Скулачев. Они открыли ряд веществ, участвующих в реакциях биологического окисления.
Происходит окисление субстрата, это отнятие либо протонов или, либо электронов водорода
Н
S е
 Н
Н
Если конечным акцептором электронов является кислород, то происходит тканевое дыхание.
Если в анаэробных условиях акцептором протонов и электронов водорода является какое то вещество, то это говорит о субстратном окислении.
Для организма выгодно тканевое или клеточное дыхание. Эта реакция идет многоступенчато через ряд промежуточных соединений, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходит восстановление О2 и синтез Н2О.
Окислительно-восстановительные реакции протекают в матриксе митохондрий. Митохондрии- субклеточные структуры, которые состоят из матрикса, внутренней и наружной мембраны. В матриксе митохондрий локализуются ферменты цикла трикарбоновых кислот (ЦТК) (изоцитратдегидрогеназа, ферменты окисления жирных кислот,малатдегидрогеназа и др.).
В наружной мембране находятся тиокиназы жирных кислот, моноаминооксидазы (МАО), АТФазы.
Во внутренней мембране митохондрий локализованы ферменты дыхательной цепи, ферменты синтеза АТФ, сукцинатдегидрогеназа, дегидрогеназы α-кетокислот.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов и происходит с участием ферментов:
никотинамидзависимых дегидрогеназ
флавинзависимых дегидрогеназ
К числу никотинамидзависимых ферментов относятся свыше 150 ферментов. Структура НАД была расшифрована Эйлером, а НАДФ- Варбургом.
НАД- зависимые дегидрогеназы---- ЛДГ, изоцитрат ДГ, МДГ- малат ДГ, алкоголь ДГ
НАДФ- зависимые ДГ- гл6фДГ , ГДГ- глутамат ДГ
В молекуле НАД- в основе лежит динуклеотид.
Первый нуклеотид состоит из аденина+ пентоза+ Н3РО4.
Во втором нуклеотиде, вместо азотистого основания амид никотиновой кислоты + пентозы + Н3РО4
НАДФ отличается тем, что имеет еще один остаток Н3РО4.
Вещество, непосредственно участвующее в переносе атомов водорода от окисляемого субстрата является пиридиновое кольцо, амид никотиновой кислоты, именно к этому кольцу и происходит присоединение одного атома водорода и двух электронов, второй атом Н остается в растворе, поэтому всегда происходит подкисление раствора.

Реакция идет очень быстро. Расположение этих коферментов в тканях различно. В печени 60% НАД находится в митохондриях, тогда как НАДФ в цитоплазме.
НАД- участвует в реакциях тканевого дыхания, а НАДФ в реакциях синтеза высших жирных кислот.
Флавиновые дегидрогеназы содержат в качестве коферментов ФАД или ФМН. Эти коферменты образуются в организме человека из вит. В2.
Рабочей частью ФАД и ФМН служит изоаллоксазиновое кольцо рибофлавина.
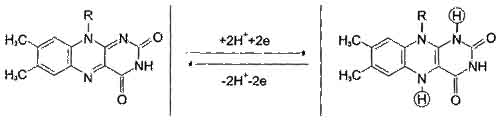
ФАД ФАДН2
Большинство ФАД - зависимые ДГ локализованы в матриксе митохондрий и во внутренней мембране митохондрий.
К ФАД- зависимым дегидрогеназам относятся СДГ- сукцинат ДГ
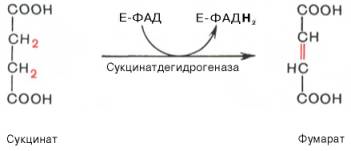
Перенос электронов от НАДН к О2 включает ряд переносчиков, которые локализованы во внутренней мембране митохондрий, которая называется дыхательная цепь.
Компонентами дыхательной цепи является НАДН- дегидрогеназа, простетической частью которой является ФМН. Единственный субстрат фермента НАДН, с которого 2 электрона и протон переносится на ФМН с образованием ФМНН2. Второй протон поглощается из матрикса. Реакция протекает по уравнению:
Н
S НАДН + Н +ФМН НАД +
ФМНН2
НАДН + Н +ФМН НАД +
ФМНН2
Н
НАДН- дегидрогеназа содержит железо серные белки, некоторые могут передавать электроны с ФМНН2. Электроны переносятся на железо-серные белки (FeS), а от них на кофермент Q (убихинон)
КоQ- вездесущий хинон. Молекула убихинона различается длиной углеводородной цепи, которая обозначается Q10

В процессе переноса электронов с НАДН- дегидрогеназы FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от НАДН- дегидрогеназы и других флавинзависимых дегидрогеназ
Н
S НАДН
 Н
Н
ФАДН2
Н

 АДН
ДГ (ФМН)- FeS ФМНН2
КоQ КоQН2
АДН
ДГ (ФМН)- FeS ФМНН2
КоQ КоQН2
Дальнейший перенос электронов от КоQ на кислород осуществляет система цитохромов.
Данная система состоит из ряда гемсодержащих белков (гемопротеидов), открытых в 1886г Мак- Муном, однако их роль была выяснена Кейлином.
Известно около 30 различных цитохромов, но в дыхательной цепи участвуют 5 типов цитохромов (а, а3, в, с, с1). Все они имеют простетическую группу, геминовую группу близкую к гему. Цитохромы отличаются друг от друга не только простетической группой, но и белковыми компонентами.
В ходе реакции при переносе электронов валентность железа обратимо меняется (из 2х валентного в 3х валентное). Цитохромы располагаются в дыхательной цепи между убихиноном и кислородом и в зависимости от редокс потенциала в определенной последовательности:
ц
 ит
в с1 с а
а3
ит
в с1 с а
а3
+0,07 +0,23 +0,25 +0,29 +0,55
Цитохром а3 ( цитохромоксидаза) является терминальным дыхательным ферментом Варбурга непосредственно взаимодействующим с О2.
Передача электронов в цитохромной системе осуществляется за счет валентности железа гема, а на участке цитохрома α3 – за счет изменения валентности меди. Установлено, что цитохромоксидаза (α3 ) состоит из 6 субъединиц, каждая из них содержит геминовую группу и атом меди. Две субъединицы из 6 составляют цитохром α, а остальные четырех относятся к цитохрому α3. Учитывая, что любой компонент дыхательной цепи может восстанавливать редокс-системы только с более низким, то в целом дыхательную цепь представить следующим образом.
Н
S НАДН
Н
-0,32 ФАДН2
Н АДН ДГ[(ФМН)- FeS] ФМНН2 КоQ КоQН2
в → С1 → С → α→ α3 +1/2O2 → H2O цитохромы+0,07+0,23+0,25+0,29+0,55+0,82
Литература:
А. Основные: 1. Биохимия. Т.Т.Берёзов, Б.Ф.Коровкин. 2010
2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976
2.Биохимия. Р.Страер. 1985
3.Северин. 2003
