
- •Методы общей бактериологии
- •Предисловие
- •Введение
- •Бактерии рода Bacillus
- •Bacillus anthracis
- •Распространение
- •Морфология возбудителя
- •Культуральные свойства
- •Профилактика
- •Bacillus cereus
- •Диагностика
- •Прочие виды, имеющие значение
- •Питательные среды для культивирования бактерий рода Bacillus
- •Бактерии рода Clostridium
- •Распространение
- •Морфология и культуральные свойства возбудителя
- •Морфология колоний
- •Антигенная структура
- •Метаболическая активность
- •Патогенность
- •Токсины и клинические проявления
- •Лабораторная диагностика
- •Столбнячная палочка
- •Распространение
- •Морфология возбудителя
- •Антигенная структура
- •Биохимия
- •Патогенность
- •Клинические проявления
- •Иммунитет
- •Лабораторная диагностика
- •Clostridium botulinum
- •Распространение
- •Морфология возбудителя
- •Антигенный состав
- •Биохимические свойства
- •Патогенность
- •Иммунитет
- •Лабораторная диагностика
- •Clostridium novyi
- •Морфология и культуральные свойства
- •Антигенная структура
- •Биохимические свойства
- •Патогенность
- •Лабораторная диагностика
- •Прочие возбудители анаэробной раневой инфекции
- •Clostridium histolyticum
- •Clostridium septicum (палочка Гона-Сакса)
- •Clostridium chavoei
- •Clostridium sporogenes
- •Clostridium sordellii
- •Clostridium fallax
- •Clostridium bifermentans
- •Clostridium difficile
- •Питательные среды для культивирования клостридий
- •Грамположительные, аэробные и факультативные кокки.
- •Микроорганизмы рода Staphylococcus
- •Staphylococcus aureus
- •Патогенез поражений
- •Лабораторная диагностика
- •S. Epidermidis
- •S. Saprophyticus
- •Питательные среды для культивирования стафилококков
- •Молочно-солевой агар
- •Желточно-солевой агар Чистовича
- •Среда Чаплина-Бернса
- •Среда Чемпена (для выделения патогенных стафилококков)
- •Микроорганизмы рода Streptococcus
- •Стрептококки группы а.
- •Распространение
- •Патогенез поражений
- •Лабораторная диагностика
- •Стрептококки группы в
- •S. Pneumoniae (пневмококк)
- •Распространение
- •Морфология и культуральные свойства
- •Патогенез поражений
- •Клинические проявления
- •Лабораторная диагностика
- •Негемолитические стрептококки
- •Патогенез
- •Лабораторная диагностика
- •Прочие стрептококки
- •Распространение
- •Клинические проявления
- •Лабораторная диагностика
- •Питательные среды для культивирования стрептококков
- •Бактерии рода Listeria Общая характеристика возбудителя
- •Дифференциация листерий от микроорганизмов других родов
- •Внутривидовая дифференциация листерий.
- •Listeria monocytogenes
- •Listeria innocua
- •Listeria welshimeri
- •Listeria seeligeri
- •Listeria ivanovii
- •Listeria grayi
- •Listeria murrау
- •Лабораторная диагностика
- •Общие положения
- •Материалы для исследования
- •Рецепты и способы приготовления питательных сред для выделения листерий
- •Триптозный агар.
- •Сывороточный агар.
- •Кровяной агар.
- •Бульон Левинталя с трипафлавином и налидиксиновой кислотой
- •Среда с ацетатом таллия и налидиксовой кислотой (tn).
- •Среда с тиоцианатом и налидиксовой кислотой (ptn).
- •Агар с триптофлавином и налидиксовой кислотой.
- •Мак Брайда листериозный агар mla
- •Модифицированный листериозный агар Мак Брайда
- •Селективный агар Мак Брайда
- •Обогащенная среда для выделения листерий
- •Агаровая среда для выделения листерий
- •Среда для выделения листерий (lpm)
- •Селективная среда pal cam
- •Селективная среда для выделения листерий (pal cam)
- •Селективная среда для листерий
- •Селективная среда для листерий
- •Селективная среда cnpa
- •Селективная среда
- •Листериозная селективная среда feindt
- •Селективная среда для выделения листерий Oxford
- •Бактерии рода Erysipelothrix
- •Распространение
- •Морфология и культуральные свойства
- •Антигенная структура.
- •Лабораторная диагностика
- •Питательные среды для культивирования е. Rhusiopathiae
- •Микроорганизмы рода Actinomyces
- •Распространение
- •Морфология и культуральные свойства возбудителя
- •Патогенез поражений
- •Клинические проявления
- •Лабораторная диагностика
- •A. Bovis
- •A. Viscosus
- •A. Hordeovutaeris
- •A. Pyogenes
- •A. Suis
- •A. Humiferis
- •Питательные среды для культивирования актиномицетов
- •Микроорганизмы рода Pseudomonas
- •Pseudomonas aeruginosa (синегнойная палочка)
- •Распространение
- •Морфология и тинкториальные свойства возбудителя
- •Культуральные свойства
- •Биохимические свойства
- •Пигментообразование
- •Патогенез
- •Антигенная структура
- •Патогенез
- •Лабораторная диагностика
- •Pseudomonas (Burkholderia) cepacia
- •Pseudomonas (Burkholderia) mallei
- •Распространение
- •Морфология и тинкториальные свойства
- •Культуральные свойства
- •Биохимия
- •Патогенез поражений
- •Клинические проявления
- •Лабораторная диагностика
- •Pseudomonas (Burkholderia) pseudomallei (палочка Уитмора)
- •Распространение
- •Морфология и тинкториальные свойства
- •Культуральные свойства
- •Биохимическая активность
- •Патогенез
- •Клинические проявления
- •Лабораторная диагностика
- •Питательные среды для культивирования и идентификации псевдомонад
- •Микроорганизмы рода Frаncisella
- •Распространение
- •Морфология
- •Культуральные свойства
- •Патогенез
- •Лабораторная диагностика
- •Питательные среды для культивирования франциселл
- •Микроорганизмы рода Yersinia Общая характеристика
- •Морфология
- •Антигенная структура
- •Патогенез
- •Клинические проявления у человека
- •Лабораторная диагностика
- •Общие положения.
- •Материалы для исследования
- •Порядок исследования материала
- •Оценка результатов бактериологического исследования.
- •Питательные среды для культивирования иерсиний Фосфатно-буферный раствор (фбр)
- •Буферно-казеиново-дрожжевая среда (бкд)
- •Дифференциально- диагностическая среда Серова
- •Среда с индикатором бромтимоловым синим (бтс)
- •Универсальный скошенный столбик
- •Щелочной раствор
- •Среда Кларка для аутоагглютинации
- •Микроорганизмы рода Pasteurella
- •Патогенез
- •Лабораторная диагностика
- •Питательные среды для культивирования пастерелл
- •Микроорганизмы рода Brucella
- •Распространение
- •Морфология
- •Антигенный состав
- •Биохимические характеристики
- •Патогенез
- •Лабораторная диагностика
- •Питательные среды для культивирования бруцелл
- •Микроорганизмы рода Haemophilus
- •Haemophilus influenzae (палочка Афанасьева-Пфейффера)
- •Морфология
- •Культуральные свойства
- •Антигенная структура
- •Н. Pleuropneumoniae
- •Н. Parasuis
- •H. Paracuniculis
- •H. Paragallinarum
- •H. Avium
- •H. Somnus
- •H. Agni
- •H. Equigenitalis
- •Питательные среды для культивирования гемофильных бактерий
- •Микроорганизмы рода Campylobacter
- •Группа Campylobocter jejuni (с. Jejuni, с. Coli, с. Lari) Культуральные свойства
- •Антигенная структура
- •Патогенез
- •Лабораторная диагностика
- •Распространенность
- •С. Fetus подвид fetus
- •С. Coli
- •С. Sputorum sb. Mucosalis
- •Spirillum pulli
- •Питательные среды для культивирования и идентификации кампилобактерий
- •Бактерии рода Leptospira
- •L. Interrogans
- •Морфология и культуральные свойства
- •Распространенность
- •Патогенез поражений
- •Лабораторная диагностика
- •Питательные среды для культивирования лептоспир
- •Бактерии рода Mycobacterium
- •Патогенез поражений и клинические проявления
- •Лабораторная диагностика
- •Выделение возбудителя
- •Биологическая проба
- •Серологические исследования
- •Кожные пробы с туберкулином
- •Дополнительные лабораторные методы
- •Лечение
- •Профилактика туберкулеза
- •Mycobacterium bovis
- •Мycobacterium africanum
- •Мycobacterium avium
- •Мycobacterium paratuberculosis
- •Мycobacterium intracellulare
- •Питательные среды для культивирования патогенных микобактерий
- •Микрорганизмы рода Mycoplasma
- •Морфология
- •Культуральные свойства
- •Биохимические свойства
- •Антигенная структура
- •Факторы патогенности
- •Патогенез
- •Питательные среды для культивирования микоплазм
- •Группа Rickettsiaceae
- •Морфология патогенных риккетсий (род Rickettsia)
- •Размножение
- •Культуральные свойства
- •Принципы лабораторной диагностики
- •Род Coxiella
- •Род Rochalimaea
- •Род Еhrlichia
- •Список литературы
- •Содержание
- •Методы частной бактериологии
Лабораторная диагностика
Наиболее достоверный результат, подтверждающий диагноз, получают выделением иерсиний из патологического материала. Данные бактериологических исследований не менее важны для дифференциальной диагностики заболеваний, протекающих с лихорадкой, лимфаденопатиями и энтероколитами.

Рисунок 16. Схема бактериологического выделения возбудителя чумы
Исследуемый материал. У больного с подозрением на чуму исследуют отделяемое бубона (при бубонной форме), содержимое язвы или других кожных поражений (кожная форма), мокроту и слизь из зева (легочная форма), кровь (все формы), фекалии и СМЖ (при поражениях кишечника или мозговых оболочек). Материал следует получить до начала антибиотикотерапии. Выделение Y.pestis проводят по стандартной схеме (рис. 16).
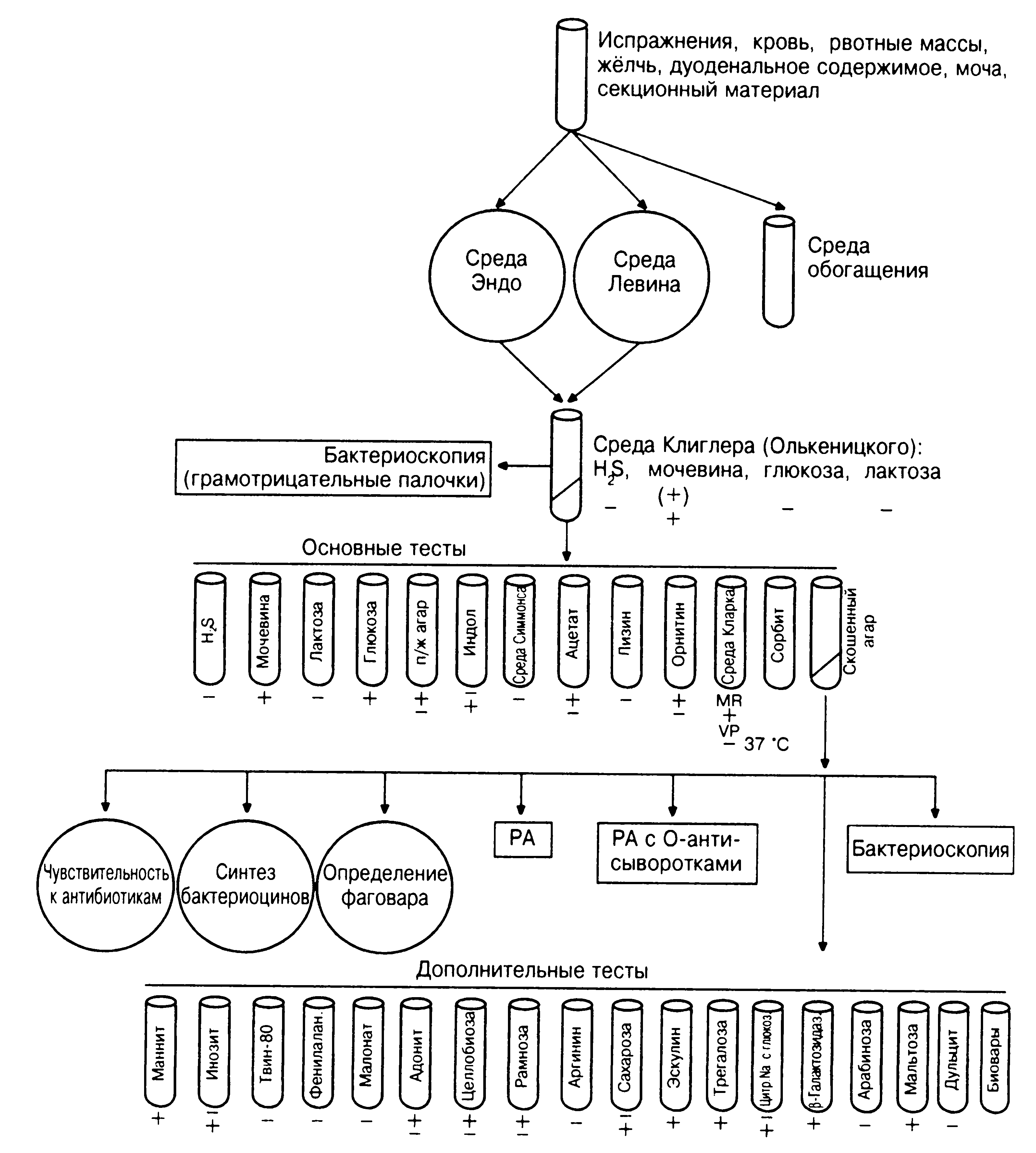
Рисунок 17. Схема бактериологического выделения возбудителя иерсиниозов
Возбудитель кишечного иерсиниоза может быть выделен из крови (Y.enterocolitica) и из кала (Y. pseudotuberculosis и Y. enterocolitica) по стандартной (рис. 17).
Общие положения.
Иерсиниоз – острое инфекционное заболевание из группы зооантропонозов, характеризующееся полиморфностью клинического проявления, в первую очередь как пищевая инфекция людей с тенденцией к генерализации, септикопиемии, а также поражению различных органов и систем жизнедеятельности у людей и животных.
Иерсиниоз относится к числу широко распространенных в мире инфекций, что обусловленно выраженной адаптационной способностью возбудителя. Исследования последнего десятилетия позволили сформулировать заключение о повсеместном распространении данной инфекции в России.
Так как по международной классификации кишечный иерсиниоз входит в число четырех наиболее распространенных пищевых инфекций, опережая по некоторым показателям сальмонеллез, то основным путем заражения людей являются пищевые продукты, и в частности мясопродукты.
Материалы для исследования
В бактериологическую лабораторию направляют не менее 200 г исследуемого субстрата, упакованного в водонепроницаемую тару и желательно в первые 1-3 часа после отбора. Если время доставки образцов свыше указанного срока, то материал допускается направлять в замороженном виде в термосе со льдом.
Порядок исследования материала
Первый этап (24-48 часов). Изучаемый субстрат (не менее 25 г) измельчают и смешивают со средой накопления – солевой фосфатно-буферный раствор (0,85% NaCl, КН2РО4 – 0,45 г, Na2НРО4 –6,34г, Н2О – 1000 мл) с 1% спиртовым раствором генцианвиолета, в соотношении 1:5 (1 часть продукта и 5 частей среды) встряхивают в течение 1 минуты и культивируют при +4°С 24 – 48 часов. Через указанные сроки (24 часа в первую очередь, с дальнейшим сохранением в холодильнике исследуемой суспензии) 1мл полученной бактериальной суспензии смешивают с 5 мл 0,5%-ного раствора КОН (приготовленного по следующей методике: готовят стерильный 40% раствор КОН, из него в пробирку, содержащую 7,9 мл 5% стерильного раствора NaCl, добавляют 0,1 мл) встряхивают и через минуту высевают на селективный агар. Параллельно на селективные среды высевают и со среды накопления, хранящейся в холодильнике, причем посев делают с верхней трети суспензии (но не с поверхности), не взбалтывая среду.
Второй этап. Рост на селективных средах (24-48 часов).
В качестве селективного агара используют несколько сред.
На агаре Эндорост изучаемых иерсиний – колонии мелкие, гладкие, слегка прозрачные. К 36 часам, удается их детальнее рассмотреть.
Среда Серовадает хорошие результаты:к 36 - 48 часам – колонии интенсивно-красного цвета, матовые,шероховатые, центр выпуклый.
Однако недостаток данной селективной среды — достаточно сложный по структуре состав: глюкоза – 0,5 г, мочевина – 0,5г, молибденовокислый аммоний – 0,1 г, углекислый натрий безводный – 0,1 г, 30% водный стерильный раствор сухой желчи – 2 мл, 1,6% водный раствор краски конгорот – 0,9 мл, 1,0% водный раствор генцианвиолета – 0,1 мл, сухой питательный агар –4,5 г, дистиллированная вода – 100 мл.
Среда Иркутского НИИПЧИ(аналог БТС), она выпускается как коммерческая и имеет следующий состав: желчь медицинская 20 мл, растворNaOH4% – 10-12 капель, сухой питательный агар – 35 г, глюкоза –10 г. мочевина 5 г, 1,6% спиртовой раствор бромтимолового синего – 8 мл, дистиллированная вода 1000 мл. В случае трудностей с приобретением ее состав достаточно доступен и она легко готовится в лаборатории. К 1 литру воды добавляют сухой питательный агар, медицинскую желчь, автоклавируют 20 минут при 0,5 атм. После охлаждения до 80°С добавляют глюкозу, мочевину, индикатор бромтимоловый синий и все смешивают. Среда зеленоватого цвета,хранится неделю. Иерсинии, разлагая мочевину, изменяют цвет среды на сине-зеленый, а колонии будут синего цвета. Те микроорганизмы, что не разлагают мочевину, растут в виде желтых колоний. Через 24-48 часов культивирования при температуре 22°С проводят идентификацию выросших колоний. Преимущество среды в том, что выявляетсяуреазнаяактивность.
Третий этап. Клонирование, выделение чистой культуры (от 48 часов), биохимическая идентификация выделенных штаммов.
Из выделенной по морфологии и окраске колонии берут бакмассу для мазка, окрашивают по Граму. Если при микроскопии наблюдают грамотрицательные, полиморфные палочки, с закругленными краями, без спор и капсул, одиночные, возможно кокковидные, реже овоидные, то оставшуюся бакмассу колонии переносят в МПБ, ресуспендируют, подращивают при 24-26°С и проводят идентификацию по биохимическим тестам.
При положительной уреазной активности, ферментации глюкозы и отсутствии газообразования в первые 24 часа при 37°С исключают все газообразующие энтеробактериии родов: Escherichia, Edwardsiella, Citrobacter, Salmonella, Enterobacter, Hafnia. Способность ферментировать арабинозу исключает еще два рода – Proteus, Serratia, отсутствие ферментации инозита исключает род Klebsiella. Внутри родовая дифференциация Yersinia проводится с использованием следующих биохимических тестов: положительные результаты ферментации сахарозы, целлобиозы, сорбозы, сорбита и отрицательные показатели ферментации рамнозы, мелибиозы, раффинозы при положительном тесте на уреазу и подвижность при 25°С могут свидетельствовать о принадлежности выделяемой культуры к бактериям вида Yersinia enterocolitica.
Внутривидовая дифференциация выделенных культур Yersinia enterocolitica делается с целью типирования биовариантов и проводится по следующим тестам: положительные результаты на индол, ксилозу, салицин, трегалозу указывают на принадлежность штаммов к 1 биовару, отрицательные результаты по этим тестам свидетельствуют о принадлежности штаммов к 5 биовару. Штаммы 2 биовара из указанных 4-х тестов дают отрицательные показатели только по салицину. Штаммы 4 биоварианта имеют из данных 4-х тестов положительный результат только по трегалозе. Штаммы 3 биовара дают отрицательные результаты по тестам на салицин и индол и положительные результаты по тестам на ксилозу и трегалозу. Биоварианты 2, 3, 4 являются наиболее патогенными для человека.
При исследовании по третьему этапу проводят одновременно постановку по всем необходимым тестам, что сокращает сроки исследования выделенной культуры.
