
- •Вопрос 1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос 2. Закон Гесса – основной закон термохимии. Следствия из закона Гесса.
- •1 Следствие.
- •Вопрос 4. Энергия Гиббса. Уравнение Гельмгольца-Гиббса: энтальпийный и энтропийный факторы. Критерии самопроизвольного протекания химического процесса.
- •Вопрос 5. Скорость химической реакции. Кинетическое уравнение. Факторы, определяющие скорость химической реакции
- •4) Природа реагентов
- •5) Площадь соприкосновения твердого вещества Вопрос 6. Химическое равновесие. Константа равновесия. Принцип Ле Шателье, примеры.
- •Вопрос 7. Растворы: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Способы выражения концентрации растворов. Эквивалент. Закон эквивалентов.
- •Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
- •Вопрос 10. Растворы слабых электролитов. Константа диссоциации. Ступенчатый характер электролитической диссоциации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •Вопрос 11. Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет ph
- •Вопрос 12. Электролитическая диссоциация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений
- •Вопрос 13. Гидролиз солей. Основные типы гидролиза. Обратимый гидролиз. Необратимый гидролиз
- •Вопрос 14. Количественные характеристики гидролиза солей (степень гидролиза, константа гидролиза). Вывод формул констант гидролиза, примеры. Влияние различных факторов на степень гидролиза солей.
- •Вопрос 15. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости Ksp. Условия растворения и образования осадков
- •Вопрос 16. Основные положения квантовой механики: корпускулярно-волновой дуализм, уравнение Шредингера, принцип неопределенности Гейзенберга.
- •Вопрос 22. Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •Вопрос 23. Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов
- •Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
- •28 Вопрос. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное и их природа. Энергия межмолекулярного взаимодействия
- •29 Вопрос. Окислители и восстановители, часто применяемые в химической практике. Влияние pH, температуры, концентрации реагентов и их природы на протекание овр.
- •Вопрос 30. Электродные потенциалы металлов. Факторы, определяющие положение металла в активности металлов. Уравнение Нернста.
- •31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
- •Вопрос 36. Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
- •Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
- •I. Сульфид водорода (сероводород) h2s и сульфиды
- •Вопрос 40. Серная кислота. Методы получения. Химические свойства
- •Вопрос 43. Общая характеристика элементов V группы. Строение атомов. Степени окисления. Отношение простых веществ к кислотам.
- •Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
- •1. Аммиак
- •2 . Гидразин
- •3. Гидроксиламин
- •Вопрос 48. Соединения фосфора с металлами, водородом, кислородом, галогенами (получение и химические свойства)
- •1. Соединения фосфора с металлами
- •2. Соединения фосфора с водородом
- •3. Галогениды фосфора
- •Вопрос 49. Соединения мышьяка, сурьмы, висмута (оксиды, гидроксиды, галогениды, сульфиды). Получение и свойства этих соединений
- •Вопрос 50. Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов. Галогениды азота
- •Вопрос 51. Оксиды p-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Вопрос 52. Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли.
- •Вопрос 53. Кремний. Степени окисления. Свойства кремния. Диоксид кремния. Кремниевые кислоты и их соли
- •Вопрос 54. Олово и свинец. Их химическая активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик
- •Вопрос 55. Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •Вопрос 56. Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
- •Вопрос 57. Железо, кобальт, никель. Строение атомов, степени окисления. Их отношение к кислотам. Оксиды, гидроксиды, соли, комплексные соединения этих элементов
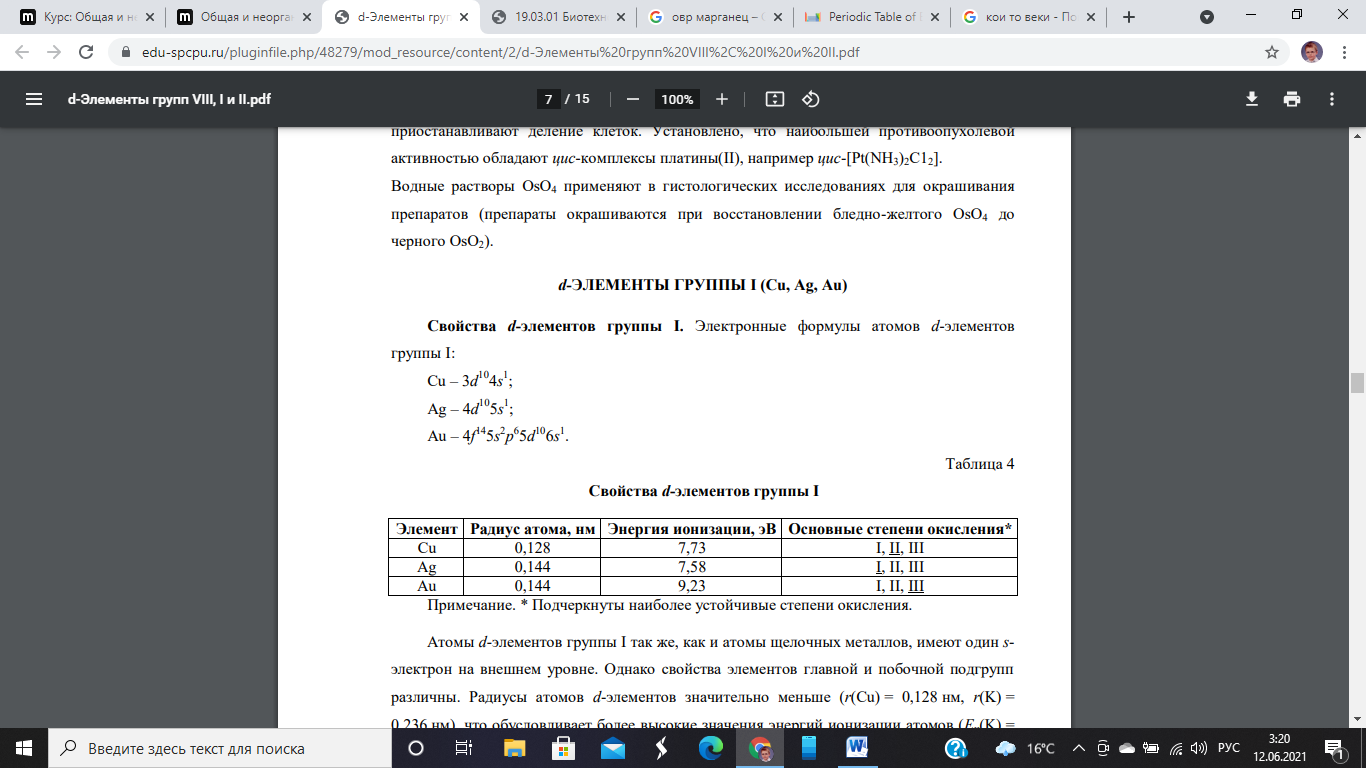
- •Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов
- •Вопрос 59. Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соединения. Химические свойства этих соединений
Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов

У атомов d-элементов группы I валентными являются не только s-электроны внешнего уровня, но и один или два d-электрона предвнешнего уровня
Химическая активность d-элементов сравнительно невелика и уменьшается с возрастанием порядкового номера элемента. Из-за малой химической активности серебро и золото называют благородными металлами.
Химические свойства простых веществ
Медь взаимодействует с кислородом с образованием Cu2O и CuO
Медные изделия на воздухе покрываются серо-зеленой пленкой из-за образования основной соли 2Cu + O2 + H2O + CO2 = (CuOH)2CO3 Так бронзовые памятники со временем покрываются патиной – налетом состава (CuOH)2CO3 и (CuOH)2SO4
Серебро и золото реагируют с кислородом только в присутствии цианид-ионов (вследствие образования устойчивых комплексов) или сероводорода (вследствие образования малорастворимых сульфидов) 4Au + O2 + 8KCN + 2H2O = 4K[Au(CN)2] + 4KOH 4Ag + O2 + 2H2S = 2Ag2S + 2H2O
Медь и серебро реагируют с серой с образованием Э2S (золото не реагирует с серой)
С хлором эти металлы образуют соответственно CuCl2, AgCl и AuCl3
Медь и серебро растворяются в азотной и концентрированной серной кислотах Ag + 2HNO3 = AgNO3 + NO2 + H2O Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O Золото можно растворить лишь в концентрированной селеновой кислоте и в «царской водке» 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Соединения меди
Медь образует гидроксиды Cu(OH)2 и CuOH
CuOH – малорастворимое вещество желтого цвета, очень неустойчивое и легко отщепляющее воду 2CuOH = Cu2O + H2O Гидроксид меди (I) получают восстановлением солей меди (II) в щелочном растворе 2CuSO4 + H2CO + 5NaOH = 2CuOH + HCOONa + 2Na2SO4 + 2H2O
Сu(OH)2 – малорастворимое соединение голубого цвета. Получают его обменными реакциями в растворе.
Большинство солей меди (II) хорошо растворимы в воде. Катион Cu2+ в воде частично гидролизован. В присутствии карбонатов-ионов гидролиз солей меди усиливается и выпадает осадок 2Cu2+ + 2CO32- + H2O = (CuOH)2CO3 + CO2
Соли меди хорошо относятся к комплексообразованию
Для меди (III) получены соли – купраты – при сплавлении оксида меди (II) с пероксидами или с сильными окислителями и щелочью 2CuO + Na2O2 = 2NaCuO2 2Cu(OH)2 + Ba(OH)2 + NaClO = Ba(CuO2)2 + NaCl + 3H2O Соединения меди (III) – сильные окислители, так как неустойчивы 2NaCuO2 + 8HCl = 2CuCl2 + 2NaCl + 4H2O + Cl2
Гидроксиды серебра и золота
Гидроксид серебра (I) очень неустойчив и в водном растворе не образуется 2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O AgOH может быть получен лишь при действии щелочи на спиртовой раствор нитрата серебра при -50◦С
Гидроксиды золота (I) и (III) получают обменными реакциями. Амфотерный Au(OH)3 – золотая кислота – растворяется и в кислотах и в щелочах с образованием комплексов Au(OH)3 + NaOH = Na[Au(OH)4] Au(OH)3 + 4HCl = H[AuCl4] + 3H2O
Галогениды серебра
AgCl и AgBr растворяются в концентрированном аммиаке с образованием комплексного иона [Ag(NH3)2]+. AgI в аммиаке не растворяется
Все галогениды серебра растворяются в растворе тиосульфата натрия AgГ + 2S2O32- = [Ag(S2O3)2]3- + Г-
