
ТеорИмба
.pdfГиперхромный эффект – увеличение интенсивности поглощения при какой-либо длине волны.
Гипохромный сдвиг – уменьшение интенсивности поглощения при какойлибо длине волны.
Для установления связи электронных спектров со строением органических соединений необходимо соотнести полосы поглощения с определенными электронными переходами. Наиболее широко используется для этого метод молекулярных орбиталей, предполагающий, что электроны, не участвующие в образовании химической связи, и электроны внутренних электронных оболочек находятся в том же энергетическом состоянии, что и в индивидуальном атоме (то есть находятся на так называемых атомных орбиталях). Валентные же электроны располагаются на энергетических уровнях, отличающихся от атомных. Данные уровни называются молекулярными орбиталями. Они образуются как линейная сумма отдельных атомных орбиталей.
В органических соединениях поглощение в ультрафиолетовой и видимой области связано с переходами валентных электронов одинарных и кратных связей (σ- и π-электронов) и электронов неподеленных пар гетероатомов (n-электронов).
Полосы поглощения в электронном спектре характеризуются длиной волны, а также интенсивностью. Положение полосы определяется разностью энергий состояний, между которыми происходит переход, и может быть охарактеризовано длинной волны в максимуме полосы поглощения. Смещение полос поглощения, происходящее под влиянием внутримолекулярных и межмолекулярных взаимодействий, осуществляется в результате изменения разности между энергиями основного и возбужденного состояний, причем это может происходить как за счет изменения энергии одного из состояний, так и обоих.
Различные электронные переходы требуют неодинаковой энергии и поэтому могут наблюдаться при различных длинах волн и иметь различные значения молярного коэффициента поглощения. Для возбуждения σ→σ* переходов требуется значительная энергия (УФ в вакуумной области, λ = 100—150 нм). Значительно меньше энергии требуется для осуществления π→π* перехода. Они наблюдаются в области 200—250 нм и характерны для молекул ароматических соединений с сопряженными связями.
13

Еще легче происходит переход наименее прочно связанных n-электронов, поэтому n→π* переходам соответствуют полосы поглощения в самой длинноволновой области λ = 250—300 нм. Такие переходы характерны для соединений, имеющих атомы с неподеленными электронными парами (N, S, O, галогены).
При исследовании электронных спектров поглощения органических молекул выявлено, что чаще всего имеют место переходы n→π* и π→π* переходы.
На рисунке 5 показана энергетическая диаграмма переходов между различными молекулярными орбиталями.
Рис. 5. Энергетическая диаграмма переходов между различными молекулярными орбиталями.
Протонирование затрагивает неподеленную пару электронов, что приводит к исчезновению полосы поглощения n→π* перехода, но при этом не влияет на полосу поглощения π→π* переходов. При увеличении полярности растворителя полоса n→π* перехода, которая сопровождается увеличением дипольного момента молекул, смещается в область коротких длин волн (гипсохромное смещение), а
14
полоса π→π* перехода, которая сопровождается уменьшением дипольного момента, смещается в длинноволновую область (батохромное смещение).
Электронные спектры поглощения отдельных классов органических соединений
Поглощение насыщенных углеводородов обусловлено только переходами электронов со связывающей σ-орбитали на разрыхляющую σ*-орбиталь. По шкале энергий видно, что для осуществления данного перехода потребуется больше всего энергии. Поэтому эти полосы поглощения находятся в области коротковолнового излучения (области вакуумного ультрафиолета). С ростом углеродной цепочки наблюдается некоторый батохромный сдвиг. Так метан поглощает при 125 нм, этан
– при 135 нм, а октан уже при 170 нм. Введение алкильных заместителей вообще приводит к сдвигу полосы поглощения в длинноволновую область.
В напряженных циклах, таких как циклопропан, происходит смещение полос поглощения в область излучения с меньшими энергиями (190 нм). Еще более напряженный кубан поглощает при 300 нм.
При появлении в молекуле насыщенного углеводорода гетероатомов (спирты, амины) в спектрах появляются полосы, отвечающие за переходы неподеленных электронных пар гетероатомов с несвязывающих n-орбиталей на σ*- разрыхляющие орбитали. Эти переходы наблюдаются в широком интервале длин волн от 180 до 250 нм.
Соединения с кратными углерод-углеродными связями.
Поглощение излучения двойными углерод-углеродными связями обусловлено переходами π-электронов в возбужденное состояние. Здесь разница энергий, как видно из энергетической диаграммы уровней МО, не так велика, как для σ-связывающей и σ*-разрыхляющей орбиталей и полоса поглощения наблюдается при длинах волн около 165 нм. Присутствие в молекуле системы сопряженных двойных связей приводит к образованию новой системы энергетических уровней. Из диаграммы энергетических уровней следует, что переход с ВЗМО на НСМО требует меньшей энергии, чем переход в несопряженной системе и полоса поглощения сопряженной системы сдвигается в длинноволновую область (рисунок 6). Для 1,3-бутадиена это 217 нм. Увеличение
15

длины сопряженной цепи приводит к дальнейшему батохромному смещению и увеличению интенсивности.
Рис. 6. Электронные π→π* переходы в молекуле бутадиена-1,3. Спектральные данные в этой области позволяют отличить цис- и транс-
изомеры. В спектре первых наблюдается более длинноволновая и менее интенсивная полоса.
Введение к двойной связи заместителя, содержащего гетероатом, приводит к взаимодействию его неподеленной электронной пары с π-электронами двойной связи и возникновению двух новых заполненных орбиталей. Переход с ВЗМО на НСМО требует меньшей энергии. В результате для хлористого винила наблюдается смещение полосы поглощения в область 185 нм, а для дивинилового эфира – 202 нм.
Эти же закономерности справедливы и для тройной связи. Ацетилен поглощает при 173 нм, а система сопряженных тройных связей при 210 – 250 нм.
Бензол и его производные.
16
Поглощение бензола связано с переходами π-электронов. В основном состоянии 6 π-электронов находятся на 3 молекулярных орбиталях, две из которых вырождены.
При возбуждении электроны орбиталей π2 и π3 переходят на орбитали π4 и π5. Это приводит к трем различным возбужденным состояниям и соответствует трем полосам поглощения: около 180 нм (высокая интенсивность), 200 нм (слабая интенсивность) и так называемой «бензольной полосы» при 230-260 нм слабой интенсивности с ярко выраженной колебательной структурой.
Замещение в бензольном ядре заместителем как донорного, так и акцепторного характера приводит к смещению полосы поглощения в длинноволновую область, увеличению ее интенсивности и сглаживанием колебательной структуры. Если заместитель обладает только индуктивным эффектом, то изменения в спектре не так значительны, как в случае если заместитель обладает мезомерным эффектом. При этом, чем сильнее сопряжение, тем сильнее изменения в спектр. Алкильные заместители и галогены слабо влияют на получаемый спектр, тогда как амино- и алкокси-группы оказывают очень сильное влияние. Сильное влияние оказывает наличие в кольце сопряженных с ним кратных углерод-углеродных связей.
По сравнению с бензолом в спектрах ароматических гетероциклических систем следует ожидать пика, соответствующего n-π*-переходу. Однако на практике эта полоса наблюдается только для циклов с несколькими гетероатомами, когда происходит ее смещение в длинноволновую область, причем иногда даже в видимую. В случае же циклов с одним гетероатомом чаще всего происходит перекрывании полосы, отвечающей n-π*-переходу с полосой π -π*-переходов.
Карбонильные соединения.
Поглощение карбонильной группы связано с переходами электронов кратной связи С=О и переходами n-электронов неподеленной электронной пары кислорода. π-Орбитали карбонильной группы возникают при взаимодействии 2рх- электрона углерода и 2рх-электрона кислорода.
Для карбонильных соединений, которые не имеют сопряжения с другими двойными связями, характерны три полосы поглощения: в области длин волн 150170 нм для π→π* перехода; в области 170-200 нм для n→σ* перехода и в области
17

270-290 нм для n→π* перехода. Добавление к карбонильной группе алкильного радикала приводит к гипсохромному сдвигу за счет положительного индуктивного эффекта последнего, приводящего к повышению энергию π*-орбитали. Энергия электронов неподеленной электронной пары при этом практически не изменяется.
Замещение водорода альдегидной группы на группу, обладающую положительным мезомерным эффектом (алкокси-, аминогруппу или галоген), сопровождается сильным гипсохромным сдвигом полосы, соответствующей n→π* переходу, что также объясняется повышением энергии π*-орбитали и сохранением при этом энергии электронов неподеленной электронной пары.
При увеличениии полярности растворителя максимум полосы поглощения n- π*-перехода смещается в коротковолновую область из-за понижения энергии основного состояния. В кислых средах из-за блокировки электронов неподеленной электронной пары указанная полоса совсем исчезает.
При сопряжении карбонильной группы с кратными углерод – углерод связями энергетические уровни π-электронов сильно изменяются, при этом энергия неподеленной пары кислорода при этом не меняется (рисунок 7). Это приводит к батахромному сдвигу полосы π→π* в область длин волн 200-220 нм и полосы n→π* перехода в область около 320 нм.
Рис. 7. Диаграмма энергетических уровней при сопряжении карбонильной группы с кратной углерод – углерод связью.
18
В спектрах соединения, содержащих связь C=N, наблюдаются полосы, соответствующие тем же переходам, что и для связи С=О. В частности, полоса n→π* перехода исчезает при подкислении и смещается в коротковолновую область в более полярном растворителе.
Таким образом, электронные спектры широко используются для идентификации и определения структуры органических соединений. По оптической плотности раствора, основываясь на законе Ламберта – Бугера – Бера, применяя различные подходы, можно определить концентрацию растворенного вещества или количественно контролировать ход химической реакции.
Задачи, решаемые с помощью спектроскопии в УФ и видимой области:
•определение наличия в молекуле кратных связей и их характера (сопряженные или нет, С-С или С-Неt);
•определение наличия в бензольном кольце заместителя и его характера (есть
ли сопряжение и если есть, то насколько сильное);
Аппаратное оформление спектроскопии в УФ и видимой области.
Спектрофотометры классифицируют в зависимости от того какой источник излучения используется в них. Существует два спектрометрических метода анализа:
а) Фотометрические – методы, применяющие для исследования световой поток с широким диапазоном длин волн.
б) Спектрофотометрические – методы, применяющие для исследования, световой поток с узким диапазоном длин волн Δλ < 10 нм).
Исходя из этого, спектрофотометры разделяют на фотоколориметры и спектрофотометры.
Фотоколориметры – приборы, предназначенные для определения содержания окрашенного вещества путем измерения величин поглощения и пропускания в видимой части ЭМИ. В данном типе приборов применяется световой поток с широким диапазоном длин волн. Общая схема однолучевого фотоколориметра приведена на рисунке 8.
19
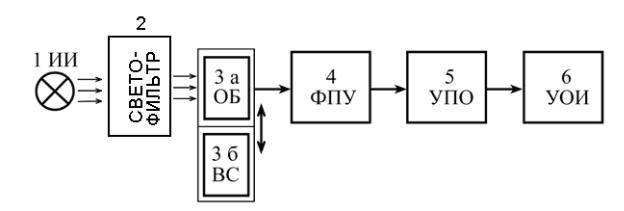
Рис. 8. Схема одноканального абсорбционного фотометра: 1 – источник излучения; 2 – оптическая избирательная система; 3а – кювета с исследуемыми веществами; 3б – кювета с веществом сравнения; 4 – фотоприемное устройство; 5 – устройство преобразования информации; 6 – устройство регистрации и отображения информации.
Принцип действия фотоколориметра заключается в следующем. От источника видимого света 1 световой поток проходит через светофильтр 2, где выделяется нужная полоса светового излучения Δλ. После прохождения через кювету 3а с исследуемым образцом или образцом сравнения 3б световой поток, поступает на фотоприемное устройство 4. Свет проходит попеременно через кювету 3а и 3б положение, которых меняется с помощью специальной каретки. После преобразования сигнала фотоприемным устройством в блоке 5, окончательный результат отображается блоком 6.
В качестве светофильтра в фотоколориметрах могут использоваться как стеклянные, так и металло-стеклянные (интерференционные) фильтры. Основным преимуществом стеклянных фильтров - их низкая стоимость и простота, недостаток же слишком широкая полоса пропускания (Δλ) – до 60 нм. В отличие от стеклянных фильтров, металло-стеклянные имеют ширину полосы пропускания в пределах 6–20 нм.
Исходя из того, что фотоколориметры используют излучение в видимой области, они находят свое применение в основном для измерения поглощений окрашенных веществ. Если вещество не поглощает ЭМИ в указанной области, то, его путем химической реакции можно перевести в окрашенный продукт. Кюветы, используемые в фотоколориметрии, изготавливают из стекла, которое, как
известно прозрачно в области видимого излучения. 20
Вторым типов спектрометров являются спектрофотометры. В спектрофотометрах вместо светофильтра применяют монохроматор, который позволяет выделить область длин волн Δλ в районе 0,2нм. В спектрофотометрах для получения когерентного излучения используют монохроматоры двух типов: призму и дифракционную решетку, позволяющие непрерывно изменять длину волны. При использовании в качестве источников лазеров отпадает необходимость в монохроматоре – лазер сам дает монохроматический свет.
Источником видимого света служит, как правило, вольфрамовая галогенная лампа, дающая постоянный поток света в диапазоне длин волн 380— 950 нм. В качестве источника УФ излучения используются водородные или дейтериевые лампы. В качестве фотоприемников применяются фотодиоды, фоторезисторы, фототранзисторы, для случаев слабых сигналов – фотоумножители.
Для измерения оптической плотности или пропускания в УФ области спектра требуются кюветы из кварцевого стекла, так как обычное стекло само по себе обладает сильным поглощением в этой области.
В зависимости от числа световых потоков, одновременно используемых в фотометрических приборах, спектрофотометры разделяют на одно- и многолучевые. В однолучевых фотометрах кюветы с исследуемым раствором и раствором сравнения по очереди передвигаются в зондирующий световой поток.
Основное отличие спектрофотометра от фотоколориметра состоит в возможности пропустить через исследуемый образец световой поток любой требуемой длины волны, проводить фотометрические измерения, сканируя весь диапазон длин волн, соответствующих как видимому свету, так и ближнему УФ диапазону (200 до 380 нм). При режиме сканирования во всем диапазоне длин волн получают спектральную кривую поглощения.
Принцип работы спектрофотометра заключается в следующем. Полихроматический свет от источника проходит через монохроматор, который разлагает белый свет на цветовые компоненты. Монохроматическое излучение (Δλ которого составляет несколько нанометров) проходит через ту часть прибора, где располагается образец с исследуемой пробой. Далее принцип работы и устройство спектрофотометра такие же, как и в фотоколориметре.
21
По чувствительности, селективности и точности спектрофотометрические измерения превосходят фотоколориметрические, так как определяется поглощение монохроматического света, а не пучка лучей с широким интервалом длин волн.
Для подготовки данного материала была использована следующая литература
1.А. В. Гармаш. Введение в спектроскопические методы анализа. Оптические методы анализа. / Гармаш А. В. [и др.] ; под ред. А. В. Гармаш. – М. : изд-во РАН, 1995. – 39 с.
2.С. И. Карпов. Физико-химические методы анализа органических соединений: методические указания для ВУЗов. / Карпов С. И., Селеменев В. Ф., Матвева М. В., Беланова Н. А. – Воронеж : издательско-
полиграфический центр Воронежского государственного университета, 2008.
–94 с.
3.Сильверстейн Р. Спектрометрическая идентификация органических соединений / Сильверстейн Р., Вебстерн Ф.,. Кимл Д - Москва: Бином, 2012.
–558 с.
4.Е.А. Краснокутская. Спектральные методы исследования в органической химии: Учебное пособие. Часть 1. Электронная и инфракрасная спектроскопия/ Краснокутская Е.А., Филимонов В.Д.- Томск: Томский политехнический университет, 2012. – 56 с.
22
