
7 семестр / Основы_физич_химии_Теория_и_задачи_Еремин_и_др_2005_480с
.pdf
24 |
Г л а в а 1. Основы химической термодинамики |
Пример 1-3. Найдите критические параметры и приведенное уравнение состояния для газа Дитеричи.
Решение. Запишем уравнение Дитеричи в виде:
|
|
a |
|
p(V − b) = RT exp |
− |
|
|
|
|||
|
|
RTV |
|
и продифференцируем левую и правую части этого уравнения два раза по объему при постоянной температуре:
|
∂ 2 p |
|
|
∂p |
|
|
|
a |
|
|
|
a 2 |
|
|
|
2a |
|
|
|||||
|
|
|
|
(V − b) + 2 |
|
|
|
= RT exp |
|
− |
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
2 |
|
|
|
2 |
|
2 |
|
4 |
|
3 |
||||||||||||
|
∂V |
|
|
|
|
|
|
|
R |
T |
V |
|
RTV |
|
|||||||||
|
|
T |
|
|
∂V T |
|
|
|
RTV |
|
|
|
|
|
|
|
|||||||
и учтем, что в критической точке первая и вторая производные равны 0:
|
|
a 2 |
2a |
|
|
|
|
|
|
− |
|
|
= 0 , |
R |
2 |
2 4 |
RTV |
3 |
||
|
T V |
|
|
|||
откуда находим:
TcVc = 2aR .
Если продифференцировать обе части уравнения состояния по объему один раз с учетом равенства нулю первой производной, то можно найти второе соотношение между критическими объемом и температурой:
|
∂p |
|
a |
|
|
|
a |
|
ap(V − b) |
|
|||
p + |
|
|
(V − b) = |
|
|
RT exp |
− |
|
|
= |
|
|
, |
|
RTV |
2 |
|
RTV |
2 |
||||||||
|
∂V |
T |
|
|
|
RTV |
|
|
|
||||
откуда
RTcVc 2 = a(Vc − b) .
Подставляя сюда первое найденное соотношение для критических параметров, получим:
Vc = 2b, |
Тc = |
a |
. |
|
|||
|
|
4Rb |
|
И, наконец, подставляя эти параметры в уравнение состояния, находим критическое давление:
pc = |
a |
. |
|
4b2e2 |
|||
|
|

Г л а в а 1. Основы химической термодинамики |
25 |
Для вывода приведенного уравнения состояния подставим в уравнение Дитеричи приведенные переменные:
p = pr |
a |
, |
V = 2bVr , |
T = Tr |
a |
. |
4b2e2 |
|
|||||
|
|
|
|
4Rb |
||
В результате получаем приведенное уравнение Дитеричи, не содержащее индивидуальных параметров:
|
|
|
pr (2Vr |
− 1) = Tr exp 2 − |
2 |
|
. |
|
|
|
|
|
|||||
|
|
|
|
|
|
VrTr |
||
Пример 1-4. Выведите уравнение состояния кристаллического |
||||||||
вещества, |
если известно, |
что термические |
коэффициенты равны |
|||||
α = |
a + cp |
и β = |
b − cT |
, где a, b, c – некоторые постоянные величины. |
||||
V0 |
|
|||||||
|
|
V0 |
|
|
|
|
||
Решение. Запишем уравнение состояния данной фазы в дифференциальной форме:
dV = αV0dT − βV0dp = a + cp V0dT − b − cT V0dp = V0 V0
= (a + cp)dT + (cT − b)dp .
Чтобы проинтегрировать это выражение, надо выяснить, является ли dV полным дифференциалом, т.е. выполняется ли равенство смешанных производных:
∂(cT − b) |
= |
∂(a + cp) |
с = с. |
∂T |
|
∂p |
|
Далее проводим интегрирование по температуре с постоянной интегрирования ϕ, зависящей от давления:
V = aT + cTp + ϕ(p).
Дифференцируя полученное уравнение по p и учитывая выражение для dV, получаем:
|
∂V |
|
∂ϕ( p) |
|
|
∂ϕ( p) |
|
||
|
|
= cT − b = cT + |
∂p |
|
−b = |
∂p |
|
||
|
∂p T |
|
T |
|
|
T |
|
||
ϕ(p) = –bp + const.
Следовательно,
V = aT + cTp – bp + const.
При T, p = 0, V0 = const.
Окончательно,
V = V0 + aT + cTp – bp.

26 |
Г л а в а 1. Основы химической термодинамики |
ЗАДАЧИ
1-1. Приведите пример термодинамического процесса, который может совершаться как обратимо, так и необратимо. Назовите для этого процесса по одной функции состояния и перехода.
1-2. Приведите пример обратимого, но неравновесного термодинамического процесса.
1-3. Приведите примеры систем со временем релаксации порядка: а) секунд; б) часов;
в) десятилетий.
1-4. Изменение теплоты в зависимости от температуры и объема в некоторой системе описывается уравнением:
δQ = C dT + (RT /V )dV
(C и R – постоянные). Является ли теплота функцией состояния в данном случае? Ответ обоснуйте.
1-5. Зависимость теплоты некоторого процесса от температуры и давления описывается выражением:
δQ = (RT p)dp − RdT .
p)dp − RdT .
Является ли теплота функцией состояния в данном случае?
1-6. Относительная влажность воздуха в комнате объемом 500 м3 при 298 К равна 87%. Давление насыщенного пара воды при этой температуре равно 0.0313 атм. Рассчитайте массу воды, находящейся в воздухе в виде пара.
1-7. Давление насыщенного пара ртути при 300 К равно 0.002 Торр. Плотность воздуха при этой температуре равна 1.18 г л–1. Рассчитайте:
а) концентрацию паров ртути в воздухе в моль л–1; б) весовое содержание ртути в воздухе в миллионных долях (млн–1).
1-8. Докажите, что при больших объемах уравнение Дитеричи переходит в уравнение идеального газа.
1-9. Найдите частные производные |
∂p |
|
и |
∂p |
|
|
для: |
||||
|
|
||||||||||
|
|
|
|
∂T |
V |
∂V |
|
T |
|||
а) идеального газа; |
|
|
|
|
|
|
|
|
|
|
|
б) газа Ван-дер-Ваальса; |
|
|
|
|
|
|
|
|
|||
в) газа, подчиняющегося уравнению Дитеричи. |
|
|
|||||||||
Докажите, что |
∂ 2 p |
= |
∂ 2 p |
. |
|
|
|
|
|
|
|
∂V ∂T |
∂T ∂V |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
Г л а в а 1. Основы химической термодинамики |
27 |
1-10. Используя вириальные разложения (1.8), найдите связь между вириальными коэффициентами B2, B3 и B2', B3'.
1-11. Найдите критические параметры и приведенные уравнения состояния для газов:
а) Ван-дер-Ваальса; б) Бертло.
1-12. Предложено следующее уравнение состояния (для одного моля):
p = |
RT |
− |
B |
+ |
C |
. |
V |
V 2 |
|
||||
|
|
V 3 |
||||
Выразите критические параметры через постоянные B и C и найдите фактор сжимаемости pV/RT в критической точке.
1-13. При 250 K и 15 атм мольный объем газа на 12 процентов меньше величины, рассчитанной по уравнению состояния идеального газа. Рассчитайте:
а) фактор сжимаемости при этих условиях; б) мольный объем газа. Какие силы преобладают в этом случае –
притяжения или отталкивания?
1-14. В некотором промышленном процессе азот нагревают до температуры 500 K в реакторе постоянного объема 1.000 м3. Масса газа равна 92.4 кг. Используя уравнение Ван-дер-Ваальса, определите приблизительное давление газа в реакторе при рабочей температуре 500 K. Параметры уравнения Ван-дер-Ваальса см. в табл. П-1.
1-15. Плотность водяного пара при 327.6 атм и 776.4 K равна 133.2 г л–1: а) определите мольный объем воды, Vm, и фактор сжимаемости, Z; б) рассчитайте Z из уравнения Ван-дер-Ваальса. Параметры уравне-
ния Ван-дер-Ваальса см. в табл. П-1.
1-16. Предположим, что 10.0 моль C2H6 поместили в сосуд объемом 4.860 л при 27 °C. Оцените величину давления, создаваемого этаном, исходя из уравнения состояния:
а) идеального газа; б) газа Ван-дер-Ваальса.
Используя результаты расчетов, определите значение фактора сжимаемости. Параметры уравнения Ван-дер-Ваальса см. в табл. П-1.
1-17. Некоторый газ подчиняется уравнению состояния газа Ван-дер- Ваальса с a = 0.76 м6 Па моль–2. Объем газа равен 4.00 10–4 м3 моль–1 при 288 K и 4.0 МПа. Используя эти данные, рассчитайте значение параметра b в уравнении Ван-дер-Ваальса. Чему равен фактор сжимаемости этого газа при температуре 298 К и давлении 1 атм?
1-18. Критические объем и давление некоторого газа равны 160 см3 моль–1 и 40 атм соответственно. Оцените критическую темпе-

28 |
Г л а в а 1. Основы химической термодинамики |
ратуру, считая, что газ подчиняется уравнению состояния Бертло. Оцените радиус газообразной молекулы, если она имеет сферическую форму. (Параметр b в уравнении Бертло равен учетверенному собственному объему молекул).
1-19. |
Покажите, что уравнение Ван-дер-Ваальса приводит к Z < 1 и |
Z > 1, |
и укажите условия, при которых выполняются эти неравенства. |
§ 2. Первый закон термодинамики
Первый закон (первое начало) термодинамики – это фактически закон сохранения энергии. Он утверждает, что:
Существует аддитивная функция состояния термодинамической системы, называемая энергией, U. Энергия изолированной системы постоянна. В закрытой системе энергия может изменяться за счет:
а) совершения работы W над окружающей средой (или среды над системой);
б) обмена теплотой Q с окружающей средой.
(2.1.а) |
dU = δQ + δW (дифференциальная форма), |
(2.1.б) |
∆U = Q + W (интегральная форма). |
Буква δ в уравнении (2.1.а) отражает тот факт, что Q и W – функции перехода и их бесконечно малое изменение не является полным дифференциалом. В системе СИ размерность работы, теплоты и энергии – [Дж].
Согласно рекомендациям ИЮПАК, принято считать положительной теплоту, полученную системой, и работу, совершенную над ней. То есть действует «эгоистический» принцип: положительно то, что увели-
чивает внутреннюю энергию системы. Мы будем придерживаться именно этой системы знаков.1
Эквивалентность теплоты и работы установлена экспериментально. Первый закон справедлив для любых систем и процессов, но в случае открытых систем использовать его в форме уравнения (2.1.а) нельзя, так как в процессах, сопровождающихся переносом вещества от системы к окружению или обратно, наблюдаемые изменения энергии не удается разделить на теплоту и работу. Причиной этого является тот
1 В некоторых изданиях придерживаются другой системы знаков: работа считается положительной, если она совершается системой над окружающей средой.
Г л а в а 1. Основы химической термодинамики |
29 |
факт, что при внесении в систему некоторого количества вещества изменяется объем системы, т.е. совершается работа расширения (сжатия), и при этом вместе с веществом поступает некоторое количество связанной с ним энтропии.
Иногда для открытых систем первый закон записывают в виде:
dU = δQ + δW + ∑µi dni , |
(2.2) |
i |
|
где последняя сумма характеризует процесс обмена веществом между системой и окружением. Эту сумму условно называют «химической работой», имея в виду работу переноса вещества из окружения в систему. Функция µ получила название «химический потенциал» (подробно о химическом потенциале см. § 5, 6).
Энергия любой системы определяется с точностью до постоянной величины. Однако практического неудобства это не вызывает, так как результатом термодинамического процесса является изменение энергии, поэтому уровень отсчета можно выбрать условно. В общем случае энергия системы складывается из:
•кинетической энергии движения системы как целого;
•потенциальной энергии, обусловленной положением системы во внешнем силовом поле;
•внутренней энергии.
Обычно в химической термодинамике рассматриваются неподвиж-
ные системы в отсутствие внешних полей. В этом случае полная энергия системы равна ее внутренней энергии, которая является суммой
•кинетической энергии молекулярного движения;
•энергии межмолекулярных взаимодействий (притяжения и отталкивания составляющих систему частиц);
•энергии, эквивалентной массе покоя всех частиц согласно уравнению Эйнштейна;
•энергии излучения.
При термодинамическом описании систем рассматривают не все
виды энергии, а только некоторые из них. Так, при химической реакции не изменяется энергия взаимодействия нуклонов в ядрах, поэтому в качестве компонентов системы можно выбирать атомы химических элементов. Если же приходится учитывать ядерные превращения, то в качестве компонентов выбирают элементарные частицы. Внутренняя энергия неизменных структурных единиц принимается за условный уровень отсчета внутренней энергии и входит как константа во все термодинамические соотношения.
В отличие от внутренней энергии, теплота и работа не являются функциями состояния, их значения зависят от типа процесса. Работа – это упорядоченная форма передачи энергии, а теплота – неупорядоченная, связанная с хаотическим движением частиц.
30 |
Г л а в а 1. Основы химической термодинамики |
Работа
(2.3)
(2.4)
(2.5)
(2.6.а)
Работа W – форма передачи энергии от одного тела к другому, не связанная с переносом теплоты и (или) вещества. Существуют разные виды работы: механическая, электрическая, магнитная, изменения поверхности и др. Бесконечно малую работу любого вида можно представить как произведение обобщенной силы на изменение обобщенной координаты, например:
δWмех = – pdV |
механическая работа (работа расширения); |
δWэл = ϕdq |
работа переноса заряда; |
δWпов = σdΩ |
работа изменения площади поверхности; |
δWмагн = VHdМ |
работа намагничивания вещества; |
где ϕ – электрический потенциал, q – заряд, σ – поверхностное натяжение, Ω – площадь поверхности, H – напряженность магнитного поля, М – удельная намагниченность.
Понятие «обобщенный» подразумевает, что силы и координаты могут иметь произвольные размерности, но их произведение имеет размерность энергии.
Сумму всех видов работ за исключением механической работы называют полезной (немеханической) работой:
δWпол.= ϕdq + VHdМ + ∑µi dni +….
i
С учетом (2.3), дифференциальное выражение первого закона можно представить в виде:
dU = δQ – pdV + δWпол.
Механическую работу, производимую при расширении против внешнего давления pe, рассчитывают по формуле:
V2
W = – ∫ pe dV .
V1
Если процесс расширения обратим, то внешнее давление отличается от давления системы (например, газа) на бесконечно малую величину: pe = pi – δp и в формулу (2.5) можно подставлять давление внутри системы, которое определяется по уравнению состояния.
В адиабатическом процессе отсутствует теплообмен с окружающей средой (Q = 0, δQ = 0), поэтому работа может совершаться только за счет убыли внутренней энергии: W = ∆U. При обратимом адиабатическом расширении идеального газа давление и объем связаны соотноше-
нием (уравнением адиабаты):
pV γ = const.
где γ = Cp / CV, Cp и CV – изобарная и изохорная теплоемкости (см. далее).
Г л а в а 1. Основы химической термодинамики |
31 |
В уравнении (2.6.а) важны два момента: во-первых, это уравнение процесса, а не уравнение состояния; во-вторых, оно справедливо только для обратимого адиабатического процесса. Это же уравнение можно записать в эквивалентных формах:
TV γ–1 = const, |
(2.6.б) |
T γ p1–γ = const. |
(2.6.в) |
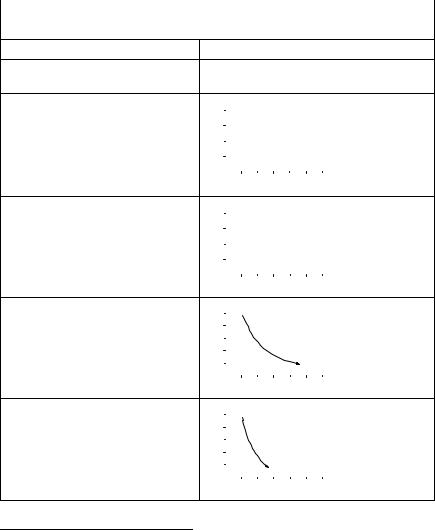
В табл. 2.1 приведены формулы для расчета работы, совершаемой идеальным газом в различных процессах. При обратимом процессе совершаемая работа всегда больше, чем при любом необратимом процессе между теми же состояниями.
Работа идеального газа в различных процессах |
|
Таблица 2.1 |
||
|
|
|
|
|
Процесс |
Графическое |
–W |
|
|
изображение процесса1 |
|
|
||
|
|
|
|
|
Расширение в вакуум
Расширение против постоянного внешнего давления pe
Изохорное обратимое расширение
p
Изобарное обратимое расширение
p
Изотермическое обратимое расширение
p
Адиабатическое обратимое расширение
p
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
pe(V2 – V1) |
||
|
|
|
1 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
p |
(V2 – V1) |
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
nRT ln(V2/V1) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1V1 − p2V2 |
|
|
|
|
|
2 |
|
|
|
|
|
γ −1 |
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 Графики приведены только для обратимых процессов.

32 |
Г л а в а 1. Основы химической термодинамики |
Теплота. Калорические коэффициенты
(2.7)
(2.8.а)
(2.8.б)
(2.8.в)
(2.8.г)
(2.8.д)
(2.8.е)
(2.9)
Теплота Q – форма передачи энергии от более нагретого тела к менее нагретому, не связанная с переносом вещества и совершением работы. Зависимость теплоты от термодинамических переменных можно выразить с помощью уравнения (2.1.а), рассматривая внутреннюю энергию как функцию температуры и объема:
δQ = –δW + dU =
= |
|
∂U |
|
∂U |
|
∂U |
|
|
∂U |
|
pdV + |
|
dT + |
|
dV = |
|
dT + p + |
|
dV . |
||
|
|
∂T V |
|
∂V T |
|
∂T V |
|
|
∂V T |
|
Входящие в это уравнение частные производные называют калорическими коэффициентами системы, они характеризуют:
•теплоемкость системы при постоянном объеме (или изохорную теп-
лоемкость)
|
δQ |
|
∂U |
CV = |
|
= |
|
|
∂T V |
|
∂T V |
•и скрытую теплоту изотермического расширения
|
|
|
|
δQ |
|
∂U |
|
|
|
l = |
|
= p + |
. |
|
|
|
|
∂V T |
|
∂V T |
Помимо этих частных производных, к калорическим коэффициен- |
||||||
там системы относятся: |
|
|
|
|||
δQ |
|
|
|
|
|
|
C p = ∂T p |
– изобарная теплоемкость; |
|||||
h = δQ |
|
– скрытая теплота изотермического сжатия; |
||||
∂p |
T |
|
|
|
|
|
χ = δQ |
|
– скрытая теплота изобарного расширения; |
||||
∂V |
p |
|
|
|
|
|
λ = δQ |
|
– скрытая теплота изохорного сжатия. |
||||
∂p |
V |
|
|
|
|
|
Кроме изобарной и изохорной теплоемкостей в термодинамике используют также истинную и среднюю теплоемкости. Истинная теплоемкость:
C = δdTQ .

Г л а в а 1. Основы химической термодинамики |
33 |
Средняя теплоемкость численно равна количеству теплоты, которое надо сообщить веществу, чтобы нагреть его на 1 К:
|
|
|
|
|
Q |
(2.10) |
|
C = |
|
|
|||||
|
|
|
. |
||||
T |
2 |
− T |
|||||
|
|
|
|
1 |
|
|
|
Если величины C, C , CV, Cp относятся к одному молю вещества, то говорят о мольных значениях теплоемкостей Cm. Размерность теплоемкости [Дж К–1], мольной теплоемкости [Дж моль–1 К–1]. Истинная и средняя мольные теплоемкости связаны между собой соотношениями:
|
|
|
|
|
|
|
|
1 |
T |
|
|
|
|
|
|
|
|
|
∫2 |
CmdT . |
|
Cm = (limC |
m )T2 |
−T1 |
→0 , Cm = |
|
||||||
T |
− T |
|||||||||
|
|
|
|
2 |
1 T |
|
||||
|
|
|
|
|
|
|
|
|
1 |
|
Соотношение между Cp и CV можно вывести, например, с помощью уравнения (2.7). Если разделить правую и левую части уравнения (2.7) на dT при p = const и учесть определение изобарной и изохорной теплоемкости, то получим:
|
∂Q |
= CV |
|
|
∂U |
|
∂V |
C p = |
|
+ p + |
|
|
. |
||
|
∂T p |
|
|
|
∂V T |
∂T p |
|
На основании опытов Джоуля было установлено, что при изотермическом расширении идеального газа его внутренняя энергия не зависит от объема, то есть
|
∂U |
= 0 . |
|
|
|
|
∂V T |
|
В изотермических процессах с участием идеального газа внутренняя энергия не изменяется, и работа расширения происходит только за счет поглощаемой теплоты. Так как для идеального газа
|
|
∂V |
|
= |
nR |
, |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
p |
|
|
|||||
|
|
∂T p |
|
|
|
|
|||
то |
|
|
|
|
|
|
|
|
|
C p = CV |
|
∂U |
|
|
∂V |
= CV |
+ nR |
||
+ p + |
|
|
|
|
|
||||
|
|
∂V |
T |
∂T p |
|
|
|||
и для одного моля идеального газа
C p,m = CV ,m + R .
(2.11)
(2.12)
(2.13)
(2.14)
(2.15)
(2.16)
