
- •Свойства неорганических соединений и водных растворов электролитов
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •Примеры некоторых амфотерных гидроксидов
- •1.2. Соли
- •1.3. Примеры Решения задач
- •1.4. Вопросы для самостоятельной подготовки к контрольной работе
- •1.5. Задачи и упражнения для самостоятельной работы
- •Тема 2. Равновесия в водных растворах электролитов. Водородный показатель. Гидролиз солей
- •2.1. Электролитическая диссоциация
- •Кислот, оснований, солей
- •Константа диссоциации некоторых слабых электролитов в водных растворах (25°с)
- •2.2. Примеры заданий
- •2.3. Ионные реакции двойного обмена
- •Порядок составления уравнений реакций
- •2.4. Водородный показатель рН
- •Логарифмическая шкала и водородный показатель рН
- •Расчеты значений рН и рОн для сильных кислот и оснований Примеры, в которых концентрация выражена в стандартной форме
- •Примеры расчета рН для одноосновных кислот и однокислотных оснований
- •Примеры расчета рН для многоосновных кислот и многокислотных оснований
- •Расчеты значений pH, константы диссоциации, степени диссоциации и концентрации для слабых кислот
- •Примеры расчета значений рН, константы диссоциации и концентрации для слабых кислот
- •1,810-5 Моль/л. Определить рН раствора кислоты с концентрацией 0,1 моль/л.
- •Методы измерения рН
- •Характерная окраска и области перехода ряда индикаторов
- •2.5 Гидролиз солей
- •2.6. Вопросы для самостоятельной подготовки к контрольной работе
- •2.7. Задачи и упражнения для самостоятельной работы
- •Библиографический список рекомендуемой литературы
- •Оглавление
- •Свойства неорганических соединений и водных растворов электролитов
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
Воронежский государственный архитектурно-строительный университет
266
Кафедра химии
Свойства неорганических соединений и водных растворов электролитов
Методические указания
к выполнению лабораторных и контрольных работ по химии
для студентов 1-го курса ВГАСУ специальности 220301 –
«Автоматизация технологических процессов
и производств (в строительстве)»
Воронеж 2006
Составители О.В. Артамонова, В.В. Шаталова
УДК 54.00
ББК 24.00
Свойства неорганических соединений и водных растворов электролитов [Текст] : метод. указания к выполнению лаб. и контр. работ по химии для студ. спец. 220301 / Воронеж. гос. арх.-строит. ун-т; сост.: О.В. Артамонова, В.В. Шаталова. – Воронеж, 2006. – 30 с.
Даны задания, которые помогут студентам самостоятельно подготовиться к лабораторным и контрольным работам по химии.
Предназначены для студентов специальности 220301- «Автоматизация технологических процессов и производств (в строительстве)».
Ил. 1. Табл. 4. Библиогр.: 5 назв.
Печатается по решению редакционно-издательского совета Воронежского государственного архитектурно-строительного университета
Рецензент – О.Р. Сергуткина, к.х.н., доц., кафедры химии ВГАСУ

Введение
В предлагаемых методических указаниях даны разработки для самоподготовки по химии для студентов дневной формы обучения специальности «Автоматизация технологических процессов и производств (в строительстве)».
Самостоятельная работа студентов является важнейшим этапом переработки учебной информации в прочные и глубокие знания. Таким образом, задача данных методических указаний – научить студентов самостоятельно готовиться к лабораторным и контрольным работам, развивать у них способность к логическому мышлению, анализу и обобщению материала лекций и учебника. Содержание указаний соответствует программе курса «Общая химия» и включает основные разделы: «Основные классы неорганических соединений», «Равновесие в водных растворах электролитов. Водородный показатель. Гидролиз солей».
Для успешного выполнения лабораторных работ необходима предварительная подготовка. Данные указания должны помочь студентам при разборе, осмысливании домашних заданий и являются практическим руководством к их выполнению и подготовке к контрольным работам. Перед каждой темой даны краткие теоретические сведения по изучаемым вопросам. Предлагаемые для самостоятельного решения упражнения позволят закрепить изучаемый материал. Актуальность указаний заключается в том, что они помогут студентам уделить больше времени решению задач и выполнению упражнений, так как число учебных часов аудиторных лабораторных занятий ограничено, поэтому теоретическая подготовка к ним идет в основном при самостоятельном изучении материала.
Тема 1. Основные классы неорганических соединений
Сложные неорганические вещества образуют три класса соединений:
оксиды, гидроксиды, соли.
Генетическую связь между различными классами неорганических соединений можно представить в виде схемы (рис.1).
Основные Средние Кислые


С


 ОЛИ
ОЛИ


Основания Кислоты

ГИДРОКСИДЫ
О сновные
+Н2О Кислотные
сновные
+Н2О Кислотные


ОКСИДЫ
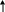
+О2
СЛОЖНЫЕ
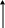
Металлы Неметаллы

ПРОСТЫЕ
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Рис. 1. Схема генетической связи неорганических соединений
1.1. ОКСИДЫ И ГИДРОКСИДЫ
Оксиды – сложные вещества, состоящие из атомов двух элементов, один из которых – кислород. Оксиды бывают несолеобразующие (SiO, CO, N2O, NO) и солеобразующие. Последние, в свою очередь, делятся на основные, кислотные и амфотерные.
Общая формула оксидов:
ЭxОy, (1.1)
где x – число атомов элемента;
у – число атомов кислорода.
Например: оксид калия К2О; оксид кальция СаО; оксид алюминия Al2O3; оксид азота (V) N2O5; оксид кремния SiО2; оксид серы SО3.
К гидроксидам относятся основания (основные гидроксиды), кислоты (кислотные гидроксиды) и амфотерные гидроксиды.
Основания – сложные вещества, молекулы которых состоят из атомов элементов и одной или нескольких гидроксидных групп OH-.
Общая формула оснований
Меn+(OH)n, (1.2)
где n – число гидроксильных групп, равное валентности (заряду иона) металла (Меn+).
Например: гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, гидроксид железа (III) Fe(OH)3. Основания проявляют основные свойства.
Кислоты – сложные вещества, молекулы которых состоят из одного или нескольких атомов водорода и кислотного остатка.
Общая формула кислот
Нn+An, (1.3)
где А – кислотный остаток, n – число атомов водорода, равное заряду кислотного остатка.
Например:
соляная кислота HCl, серная кислота H2SO4, фосфорная кислота H3РO4.
n = 1 n = 2 n = 3
Амфотерные гидроксиды – это сложные вещества, которые проявляют свойства кислот и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме оснований и в форме кислот.
Примеры амфотерных гидроксидов даны в табл. 1.1.
Таблица 1.1
