
- •Методические указания
- •Расчет равновесного коэффициента распределения жидкость—пар и концентрации примеси во фракциях, получаемых в процессе дистилляции
- •Расчет процесса непрерывной ректификации
- •Расчет скорости роста эпитаксиальных слоев полупроводниковых соединений aiiibv и твердых растворов на их основе из парогазовой фазы при использовании химических транспортных реакций
- •Моделирование процесса получения слоев поликристаллического кремния осаждением из газовой фазы
- •394026 Воронеж, Московский просп., 14
ФГБОУ ВО «Воронежский государственный технический университет»
Кафедра полупроводниковой электроники и наноэлектроники
Методические указания
к выполнению лабораторных работ № 1—4
по дисциплине «Нанотехнологии» для студентов направления подготовки бакалавров 11.03.04 «Электроника и наноэлектроника»
(профиль «Электронное машиностроение»)
очной формы обучения
Воронеж 2016
Составитель канд. техн. наук Г.И. Липатов
УДК 621.382
Методические указания к выполнению лабораторных работ № 1—4 по дисциплине «Нанотехнологии» для студентов направления подготовки бакалавров 11.03.04 «Электроника и наноэлектроника» (профиль «Электронное машиностроение») очной формы обучения / ФГБОУ ВО «Воронежский государственный технический университет»; сост. Г.И. Липатов. Воронеж, 2016. 47 с.
В методических указаниях изложены необходимые теоретические сведения, содержание, варианты заданий и методика выполнения лабораторных работ «Расчет равновесного коэффициента распределения жидкость—пар и концентрации примеси во фракциях, получаемых в процессе дистилляции», «Расчет процесса непрерывной ректификации», «Расчет скорости роста эпитаксиальных слоев полупроводниковых соединений AIIIBV и твердых растворов на их основе из парогазовой фазы при использовании химических транспортных реакций», «Моделирование процесса получения пленок поликристаллического кремния осаждением из газовой фазы». Тематика лабораторных работ подобрана так, что позволяет изучить основные закономерности технологических процессов получения высокочистых полупроводниковых материалов и приобрести практические навыки в расчете показателей и режимов проведения процессов. Предназначены для студентов 4 курса, изучающих дисциплину «Нанотехнологии».
Методические указания подготовлены в электронном виде в текстовом редакторе MS WORD 2007 и содержатся в файле НАНОТЕХНОЛОГИИ_ЛабРаб.doc.
Табл. 11. Ил. 10. Библиогр.: 7 назв.
Рецензент канд. физ.-мат. наук, доц. Т.Г. Меньшикова
Ответственный за выпуск зав. кафедрой д-р физ.-мат. наук, проф. С.И. Рембеза.
Издается по решению редакционно-издательского совета Воронежского государственного технического университета
© ФГБОУ ВО «Воронежский государственный технический университет», 2016
Лабораторная работа № 1
Расчет равновесного коэффициента распределения жидкость—пар и концентрации примеси во фракциях, получаемых в процессе дистилляции
Цель: изучить основные закономерности процесса дистилляции и методику расчета изменения примесного компонента во фракциях дистиллята.
Теоретические сведения
Равновесный коэффициент распределения жидкость—пар является термодинамическим параметром, используемым при расчетах таких процессов полупроводниковой технологии, как дистилляция, ректификация, молекулярная дистилляция в вакууме при испарении жидкой фазы.
Равновесный
коэффициент распределения компонента
В может
быть рассчитан по данным о давлениях
насыщенного пара этого компонента
(p(B))
и второго компонента раствора —
компонента А
(p(A)),
значениям коэффициента активности
компонентов раствора (γжB
и γжA)
и равновесных парциальных давлениях
компонентов (![]() и
и
![]() )
над раствором.
Уравнение для его расчета можно записать
в виде:
)
над раствором.
Уравнение для его расчета можно записать
в виде:
![]() (1)
(1)
где x, у — молярные доли компонента В в равновесных жидкой и паровой фазах.
Значения
p(B),
![]() и
рассчитывают для температуры фазового
перехода. При записи уравнения (1)
допущено, что паровая фаза является
идеальной:
и
рассчитывают для температуры фазового
перехода. При записи уравнения (1)
допущено, что паровая фаза является
идеальной:
![]() =1.
Температурная зависимость давления,
Па, насыщенного пара компонентов может
быть записана в виде
=1.
Температурная зависимость давления,
Па, насыщенного пара компонентов может
быть записана в виде
![]() (1а)
(1а)
Значения коэффициентов Aj и Bj для ряда веществ приведены в табл. 1. Равновесные парциальные давления компонентов, входящие в уравнение (1), рассчитывают по уравнению
![]() (2)
(2)
Таблица
1
Точка
кипения (Tкип)
и коэффициенты уравнении (1а) температурной
зависимости давления насыщенного
пара
Вещество
Tкип,
К
Aj
Вj
Вещество
Tкип,
К
Aj
Вj
AsCl3
403
1960,0
9,8644
PSC13
398
1562,0
8,9337
ВС13
286
1315,3
9,6040
SbCl3
492
2640,0
103715
СС14
350
1614,0
9,6189
SiCl4
330
1488,0
9,5114
GaCl3
474
2258,0
9,7608
SiHCl3
305
1300,0
9,2673
GeCl4
357
1615,0
9,5288
Si2OCl6
408
1948,0
9,7761
PCl3
348
1634,0
9,7077
SiOCl2
350
1684,0
9,8212
POCl3
380
1820,0
9,7945
SiO2Cl2
342
1634,0
9,7779
![]() ,
для расчета
равновесного коэффициента распределения
можно использовать уравнение
,
для расчета
равновесного коэффициента распределения
можно использовать уравнение
![]() (3)
(3)
Так как процессы очистки, основанные на равновесии жидкость—пар, проводятся в основном при температуре кипения раствора, то наибольший интерес представляют величины K0B, соответствующие этой температуре. При малой концентрации примесного компонента — это практически температура кипения компонента А (TкипA). Напоминаем, что температурой кипения называют такую температуру, при которой давление насыщенного пара компонента равно внешнему давлению. Если внешнее давление равно 1,01325105 Па (1 атм), то температуру кипения называют точкой кипения.
Если жидкая фаза представляет собой совершенный раствор (γi=1), то для расчета коэффициента распределения по уравнению (3) достаточно иметь только табличные данные по величинам давления насыщенного пара компонентов A и В. В противном случае для расчета K0B необходимо знать значение коэффициента активности компонента В. Его получают экспериментально различными методами или рассчитывают в различных приближениях теории растворов.
В
широко используемом при расчетах
процессов получения материалов
электронной техники симметричном
способе нормировки, когда за стандартное
принимают состояние компонента в чистом
его виде, коэффициент активности
выражается через разность химических
потенциалов реального раствора и
раствора в предположении его «совершенности»
— через избыточный химический потенциал
![]() :
:
![]()
где
![]() ;
;
![]() —
химический потенциал компонента в
чистом виде; R
— универсальная газовая постоянная,
8,314 Дж/(моль·К).
—
химический потенциал компонента в
чистом виде; R
— универсальная газовая постоянная,
8,314 Дж/(моль·К).
При
таком способе нормировки для растворителя
(компонента А)
при
малой концентрации растворенного
компонента В
(xB0,
xA1)
принимается
γA=1
(lnγA=0);
![]() и выполняется закон Рауля:
и выполняется закон Рауля:
![]() .
Для растворенного компонента В
закон
Рауля не выполняется, а для расчета
избыточного химического потенциала и
соответственно величины коэффициента
активности чаще всего используют
приближения регулярного, квизирегулярного
и субрегулярного растворов.
.
Для растворенного компонента В
закон
Рауля не выполняется, а для расчета
избыточного химического потенциала и
соответственно величины коэффициента
активности чаще всего используют
приближения регулярного, квизирегулярного
и субрегулярного растворов.
В
приближении двухкомпонентных регулярных
растворов
избыточная молярная энтальпия
![]() ,
где
ν
—
энергия смещения, или параметр
взаимодействия, а избыточная энтропия
,
где
ν
—
энергия смещения, или параметр
взаимодействия, а избыточная энтропия
![]() равна
нулю. Следовательно, избыточная энергия
Гиббса
равна
нулю. Следовательно, избыточная энергия
Гиббса
![]()
![]() равна
избыточной энтальпии (энтальпии
смешения):
равна
избыточной энтальпии (энтальпии
смешения):
![]() .
Так как
.
Так как
![]() (4)
(4)
то для избыточного химического потенциала компонента B получаем:
![]() (5)
(5)
Следовательно, в области малых концентраций компонента В в приближении регулярных растворов имеем:
![]() (6)
(6)
В
приближении двухкомпонентных
квазирегулярных
растворов
избыточная
молярная энтальпия —
![]() ,
а
избыточная молярная энтропия —
,
а
избыточная молярная энтропия —
![]() ,
где
а
и
b
—
постоянные величины. Таким образом, для
избыточной энергии Гиббса имеем:
,
где
а
и
b
—
постоянные величины. Таким образом, для
избыточной энергии Гиббса имеем:
![]() .
С
использованием уравнения (4) нетрудно
получить:
.
С
использованием уравнения (4) нетрудно
получить:
![]() (7)
(7)
В области малых концентраций компонента В в приближении квазирегулярных растворов из уравнения (7) получаем:
![]() (8)
(8)
В приближении
субрегулярных
растворов
![]()
![]() ,
а избыточная
молярная энтропия равна нулю.
,
а избыточная
молярная энтропия равна нулю.
Следовательно,
![]() .
.
Используя уравнение (4), получаем
![]() (9)
(9)
В области малых концентраций компонента В в приближении субрегулярных растворов из уравнения (9) получаем:
![]() (10)
(10)
Из уравнений (6), (8) и (10) следует, что при уменьшении температуры кипения (вследствие снижения внешнего давления) величина коэффициента активности в жидкой фазе (γжB) все более отличается от единицы. При этом, если p(B)>p(A) и γжB>1 (или p(B)<p(A) и γжB<1), равновесный коэффициент распределения K0В [см. уравнение (3)] также будет больше отличаться от единицы. Это способствует лучшей очистке в процессах, основанных на равновесии жидкость—пар. Поэтому в ряде случаев эти процессы целесообразнее проводить при пониженном общем давлении, приводящем к уменьшению температуры кипения.
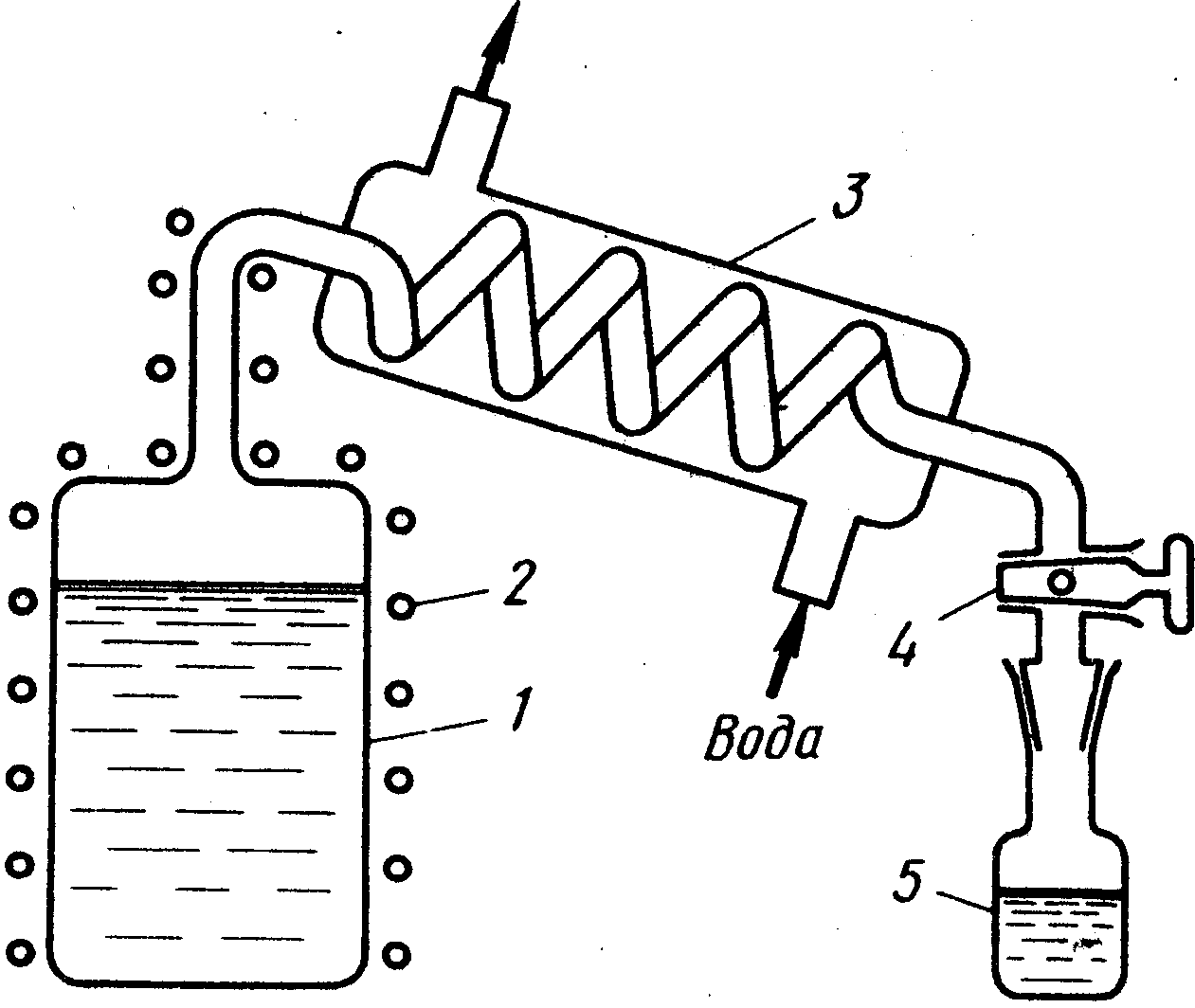
В процессе дистилляции (рис. 1) изменение концентрации компонента В в паровой фазе описывается уравнением Релея:
![]() (11)
(11)
где
х0
молярная
доля компонента B
в исходном растворе; y
—
молярная доля компонента В
в
паровой фазе при определенном значении
gисп;
gисп=nп/![]() — молярная доля испарившегося раствора,
равная отношению числа испарившихся
молей к их числу в исходном растворе.
— молярная доля испарившегося раствора,
равная отношению числа испарившихся
молей к их числу в исходном растворе.
Рис.
2. Схема
установки для непрерывной дистилляции:
1
—
вакуумируемая камера; 2
— полочный
испаритель; 3
—
резистивный нагреватель
Рис.
1. Схема процесса дистилляции для
растворов с температурой конденсации
меньше температуры охлаждающей воды:
1
— куб-испаритель;
2
— нагреватель куба; 3
— змеевиковый конденсатор; 4
— кран
для временного перекрытия стока
дистиллята; 5
— сменный приемник фракций дистиллята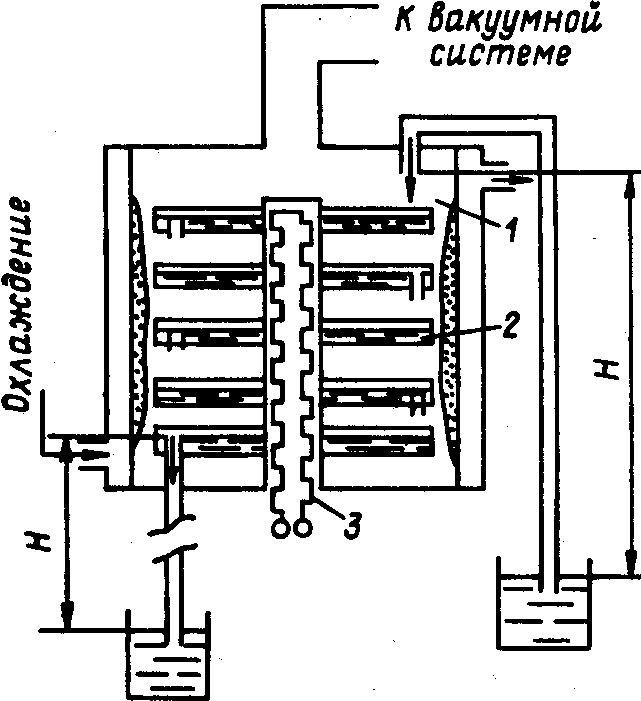
Уравнение (11) получено при условии одинаковой во всем объеме жидкой фазы в определенный момент времени концентрации компонента В (но зависящей от gисп). Принято, также, что для раствора справедлив закон Генри у°=K0В, где K0В — величина постоянная, что справедливо в области малых концентраций примесного компонента для идеальных растворов (γжB=1), регулярных, квазирегулярных и субрегулярных растворов. Графическая интерпретация уравнения (11) дана на рис. 3.
Рис.
3. Графическая интерпретация уравнения
(11); цифры на кривых — значения K0В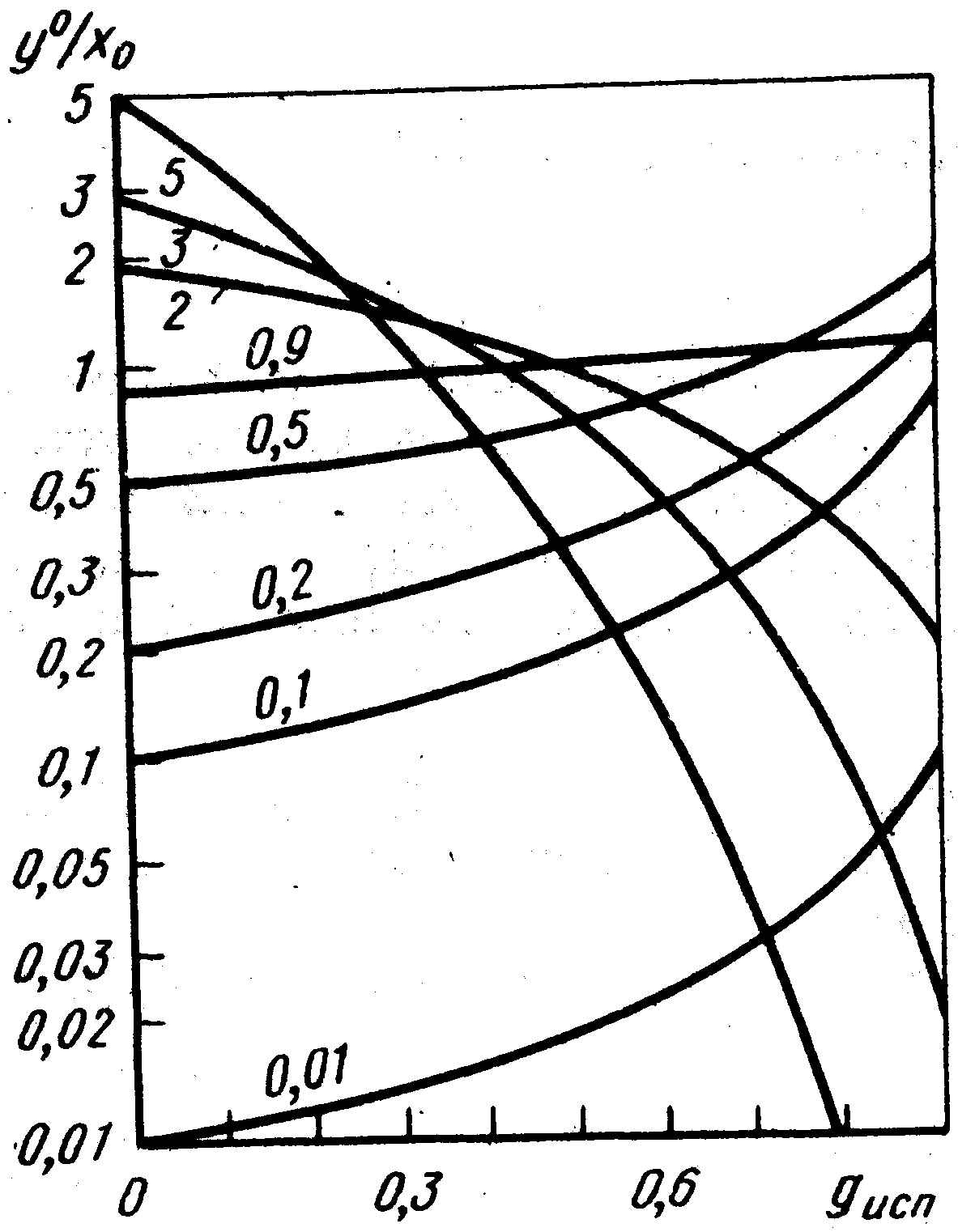
![]() (12)
(12)
где gисп (i) — молярная доля испарившегося раствора i-той фракции; gисп (i–1) — молярная доля испарившегося раствора (i–1)-й фракции (gисп (0)=0).
Концентрацию компонента В в i-той фракции рассчитывают по уравнению
![]() (13)
(13)
Варианты для расчетов представлены в табл. 2.
Задание
Рассчитать коэффициент активности и равновесный коэффициент распределения для системы компонент А — примесь В. Рассчитать молярную долю B во фракциях, каждая из которых отбирается при испарении 0,1 молярной доли исходного раствора. Молярная доля B в исходном растворе x0. Процесс проводится при внешнем давлении 1,01325105 Па (1 атм).
Таблица 2
Варианты
заданий для расчета
Номер варианта
Компонент
Примесь
νж,
Дж/моль
x0102
1
SiCl4
РС13
477,6
0,08
2
РОС13
1861,0
0,10
3
СС14
163,7
0,12
4
ВС13
–66,1
0,14
5
SiHCl3
127,8
0,16
6
SbCl3
10182,7
0,18
7
GeCl4
212,4
0,20
8
SiHCl3
CCl4
122,9
0,08
9
BC13
88,8
0,10
10
PC13
–12,8
0,12
11
AsCl3
2550,0
0,14
12
SiCl4
208,8
0,16
13
GeCl4
PC13
80,4
0,05
14
AsCl3
3299,0
0,08
15
SiCl4
–21,6
0,10
16
SbCl3
8428,0
0,12
17
CC14
148,8
0,14
18
AsCl3
POCl3
–1784,0
0,05
19
SOCl2
126,5
0,08
20
SO2Cl2
295,3
0,10
выполнения
1. Оценить давление насыщенного пара компонента в точке кипения его.
2. Рассчитать коэффициент активности примеси по уравнению (6).
3. Рассчитать давление насыщенного пара примеси в точке кипения компонента по уравнению (1а).
4. Рассчитать равновесный коэффициент распределения по уравнению (3) в точке кипения компонента A.
5. Рассчитать молярную долю примеси во фракциях дистиллята по уравнению (13). Результаты расчета оформить в следующем виде:
Номер фракции . . . |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
x104 . . . . . . . . . . . . |
|
|
|
|
|
|
|
|
|
Построить график изменения концентрации примесного компонента в дистилляте x=f(gисп) в координатах xg— номер фракции.
Контрольные вопросы
1. На чем основаны процессы очистки, используемые при получении высокочистых соединений элементов (чаще всего хлоридов и гидридов?)
2. Как получают паровую фазу?
3. Что такое равновесный коэффициент распределения?
4. Что понимают под квазистационарным приближением?
5. В виде каких последовательно протекающих стадий можно рассматривать процесс дистилляции?
6. Что понимают под лимитирующей стадией процесса?
7. Какие процессы относят к кристаллизации из паровой фазы?
8. Как работает установка непрерывной дистилляции?
Лабораторная работа № 2
