
- •Реакции нуклеофильного отщепления.
- •Механизм реакций отщепления
- •Направление отщепления
- •Конкуренция реакций нуклеофильного замещения и отщепления и роль изомеризации
- •1. Миграция алкильных групп
- •2. Миграция атомов водорода (гидридный перенос)
- •3. Перегруппировки, связанные с наличием в интермедиатах нескольких реакционных центров
Лекция №27
Реакции нуклеофильного отщепления.
План
Реакции нуклеофильного отщепления.
Механизм реакций отщепления. Направление отщепления.
Конкуренция реакций нуклеофильного замещения и отщепления и роль изомеризации.
Эти реакции называют еще реакциями элиминирования (англ. elimination). Их можно классифицировать по взаимному расположению отщепляемых групп (1,1-, 1,2-, 1,3-элиминирование и т.д.).
Наибольшее практическое значение имеют реакции 1,2-отщепления, ведущие к образованию ненасыщенных веществ (процессы дегидрогалогенирования, дегидратации и др.):
RCH2CH2Cl +HO-;-H2O -Cl-;((((((( RCH=CH2
Cl2CH-CH2Cl +HO-;-H2O -Cl-;((((((( Cl2C=CH2
RCH2CH2OSO3H -H2SO4;((((( RCH=CH2
RCH2-CH2-OH [H3O+];-H2O;((((( R-CH=CH2
а также отдельные реакции 1,3 и 1,4-отщепления с образованием гетероциклических соединений

Механизм реакций отщепления
В зависимости от условий реакции и строения реагирующих веществ 1,2-отщепления может протекать по разным механизмам. По очередности разрыва связей С–Х и С–Н они подразделяются на механизмы Е1, Е2 и Е1св, где цифры 1 и 2 – показывают молекулярность скорость-определяющей стадии, индекс “св” означает сопряженное основание (англ. conjugated basе).
Реакция Е1 обычно конкурирует с SN1 и имеет с ним общую скорость-определяющую стадию гетеролиза связи С-Х

Образовавшийся карбкатион взаимодействует далее с каким-либо основанием или растворителем, выполняющим функцию основания, с отщеплением протона и образованием алкена:

В соответствии с характером лимитирующей стадии протеканию Е1 благоприятствуют те же факторы, что и реакции SN1, а скорость реакции выражается кинетическим уравнением

R=k [H-C- C-X]
подобным уравнению скорости SN1 – реакции.
Как указывалось выше, к этим факторам относятся разветвление алкильной группы и наличие электронодонорных заместителей при реакционном центре субстрата, уменьшение энергии связи С–Х, наличие растворителя и катализаторов, способных к электрофильному взаимодействию с Х. Типичный пример представляет дегидратация спиртов, катализируемая протонными или апротонными кислотами, которые стабилизируя уходящую группу, способствуют ее эффективному отщеплению и образованию карбкатиона:

Таким образом, протонированный спирт претерпевает мономолекулярное расщепление, определяя Е1 – характер реакции.
Поскольку стабильность ионов карбония возрастает в ряду
трет. R+ > втор. R+ > перв. R+
то дегидратация наиболее легко протекает у третичных спиртов, в то время как для первичных спиртов требуются наиболее жесткие условия.
Если в субстрате отсутствуют структурные возможности для стабилизации карбкатиона, а реагент представляет собой сильное основание, то реакция отщепления протекает по механизму Е2. В этом случае разрыв связей С-Н и С-Х происходит синхронно в процессе бимолекулярной элементарной реакции

и скорость такой реакции описывается кинетическим уравнением второго порядка
r=k[B-][H-C–C-X] (2)
подобным уравнению для реакции SN2.
По этому механизму протекают реакции расщепления н-хлоралканов, эфиров серной кислоты и др.
Реакция Е2 ускоряется электроноакцепторными группами, повышающими кислотность отщепляемого атома водорода. К таким группам относятся СF3, NO2, SO2, CN, C=O, наличие которых при том же углеродном атоме, что и отщепляемый водород, существенно ускоряет реакцию. Примером может служить катализируемая основаниями дегидратация -кетоспиртов

![]()
Е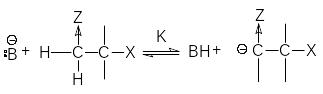 сли
протон в субстрате обладает достаточно
высокой кислотностью, а группа Х
отщепляется трудно, реакция протекает
по механизму Е1св,
когда происходит предварительное
отщепление протона по быстрой равновесной
реакции
сли
протон в субстрате обладает достаточно
высокой кислотностью, а группа Х
отщепляется трудно, реакция протекает
по механизму Е1св,
когда происходит предварительное
отщепление протона по быстрой равновесной
реакции
(3)
а группа Х отщепляется в следующей
медленной мономолекулярной стадии
распада карбкатиона
группа Х отщепляется в следующей
медленной мономолекулярной стадии
распада карбкатиона
(4)
Роль электроноакцепторной группы Z заключается в поляризации отщепляемого протона и стабилизации промежуточного аниона.
С корость
реакции в соответствии с характером
лимитирующей стадии выражается уравнением
корость
реакции в соответствии с характером
лимитирующей стадии выражается уравнением
(5)
Концентрация карбаниона определяется равновесием (3)

(6)
П одставляя
выражение (6) в уравнение (5) приходим к
кинетическому уравнению реакции Е1св
одставляя
выражение (6) в уравнение (5) приходим к
кинетическому уравнению реакции Е1св
(7)
Из уравнений (2) и (7) видно, что механизмы Е2 и Е1св кинетически неразличимы. Различие между ними можно выявить на основе анализа активационных параметров брутто-реакций. Так, константа скорости реакции SN2 как константа истинной бимолекулярной реакции будет характеризоваться отрицательными энтропиями активации, тогда как брутто-константа реакции Е1св должна характеризоваться положительной энтропией активации.
Примером Е1св-реакции является 1,3-отщепление НСl от хлоргидринов с образованием оксиранов
Cl-CH2CH2OH + HO- Cl-CH2CH2O- + H2O

