
- •Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.)
- •Атомы не могут связываться друг с другом произвольно. Каждый атом способен связываться с
- •Завершенная внешняя электронная оболочка обладает меньшей (т.е. более выгодной для атома) энергией, чем
- •Классическая теория химической связи, была предложена Косселем (ионная связь) и Льюисом (ковалентная связь)
- •Для квантово-механического описания образования ковалентной связи используют два подхода – метод валентных связей
- ••3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных
- •Два механизма образования общих электронных пар
- •В образовании σ-связи могут принимать участие следующие типы орбиталей: s-s (как при образовании
- •Образование молекулы кислорода (О2)
- •.Число общих электронных пар между связанными атомами
- •Если связь между двумя атомами образована тремя общими электронными парами, то такая связь
- •Валентность элементов в ковалентных соединениях
- •Пространственная конфигурация молекул по модели гибридизации валентных орбиталей.
- •Гибридизация - это смешивание и выравнивание по форме и по энергии орбиталей одного
- •sp-гибридизация
- •Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которые располагаются в
- •Атом бора образует с тремя атомами хлора три σ-связи по обменному механизму. Тип
- •sp3- гибридизация
- •Атом углерода образует четыре одинарные связи с атомами водорода, все эти связи –
- •Строение молекулы аммиака (NH3)
- •2. Донорно-акцепторный механизм образования ковалентной связи:
- •Количественные характеристики химической связи.
- •Полярность связей и молекул.
- •Межмолекулярные взаимодействия
- •Типы межмолекулярного взаимодействия
- •Взаимодействие диполь - индуцированный диполь (индукционное взаимодействие).
- •Дисперсионное взаимодействие.
- •Водородная связь
- •Металлическая связь
- •1.Химическая связь – это совокупность сил, удерживающих вместе два или несколько атомов или
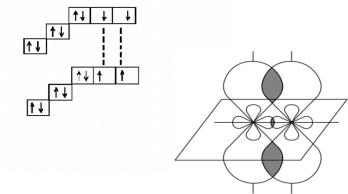
Образование молекулы кислорода (О2)
Атомам кислорода для завершения электронной оболочки не хватает не одного электрона, как в предыдущих случаях, а двух. Это означает, что в данном случае перекрываться будут не две орбитали соседних атомов, а четыре. Это молекула кислорода - О2.
1. О + О → О2
2. 8O 1s22s22p4 + 8O 1s22s22p4
3.Графическая схема
4.Пространственная схема Орбитали рх образуют σ-связь
При перекрывании двух ру или pz-орбиталей имеют место два центра с
повышенной электронной плотностью – выше и ниже линии, соединяющей центры атомов.
Такая связь называется π-связью. Она не обеспечивает наибольшее перекрывание электронных облаков и поэтому менее прочная по сравнению с σ-связью. . Возникает она в том случае, если 2 атома связаны двумя или тремя электронными парами 5. Структурная формула О=О. Одна связь σ, одна связь π.

.Число общих электронных пар между связанными атомами
характеризует кратность связи.
Структурная формула молекулы кислорода запишется как О=О. Одна из этих связей –σ, другая π. Любая двойная связь состоит из одной σ-связи и одной π-связи. σ-связь более прочная по сравнению с π- связью, так как область перекрывания электронных облаков в этом случае меньше. π-связь образуют следующие наборы орбиталей: p-p, p-d, d-d
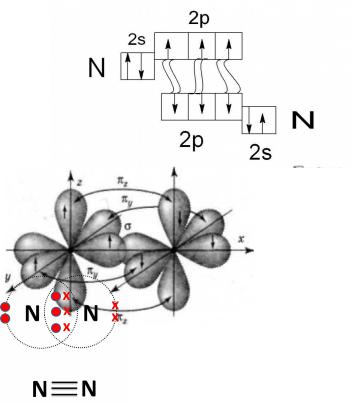
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух π-связей. Образование тройной связи можно проследить на примере молекулы азота
7N + 7N → N2
2.Электронная формула 1S22s22p3
3.Графическая формула
5. Пространственная схема
6. Структурная формула В молекуле азота 1 σ-связь и две π-связи
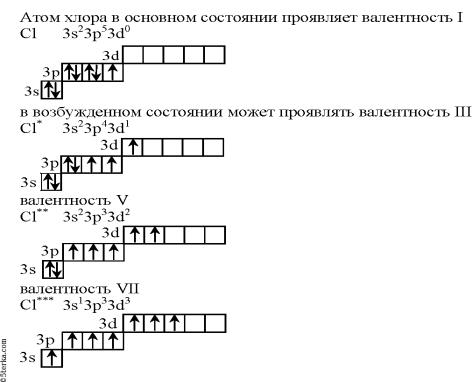
Валентность элементов в ковалентных соединениях
В образовании ковалентных связей участвуют неспаренные электроны.
Валентность элемента – это число химических связей, которые образует атом этого элемента в химических соединениях.
Поскольку одна химическая связь образуется парой неспаренных электронов различных атомов, то валентность элемента определяется числом неспаренных электронов в его атоме
Число неспаренных электронов многих элементов увеличивается при
переходе атома из основного состояние в возбужденное состояние.
Пример
Атом хлора
Пространственная конфигурация молекул по модели гибридизации валентных орбиталей.
Для определения пространственной формы молекул наиболее широко используется модель гибридизации валентных орбиталей. Идею о гибридизации атомных орбиталей выдвинул американский ученый Лайнус Полинг (1901-1994).
Согласно квантово-механическим расчетам, σ- и π-связи должны отличаться по энергии. Опыт опровергает квантово- механические расчеты. Все связи оказываются равноценными (и по энергии, и по длине). Для объяснения этого введено представление о гибридизации валентных орбиталей, которое позволяет предсказывать пространственную конфигурацию молекулы
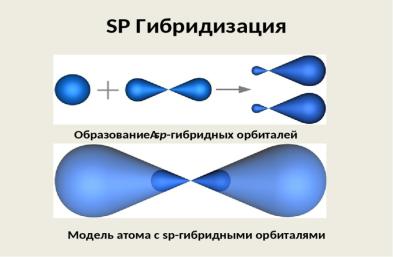
Гибридизация - это смешивание и выравнивание по форме и по энергии орбиталей одного и того же атома, участвующих в образовании связей.
В результате гибридизации первоначальная форма облаков изменяется, и образуются два облака, имеющие форму ассиметричной гантели. электронная плотность в гибридной орбитали сконцентрирована по одну сторону в большей степени, чем по другую. Благодаря такому неравномерному распределению электронной плотности вокруг ядра, гибридное облако способно к более глубокому перекрыванию, чем обычное, и дает энергетически более выгодную связь.
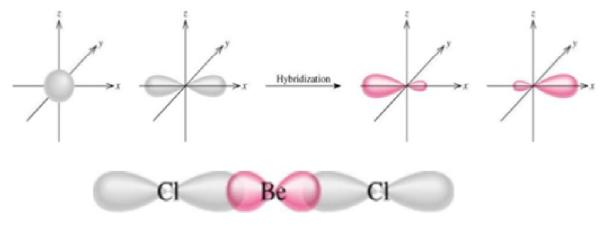
sp-гибридизация
Гибридизуется одна s- и одна р-орбиталь, образуются две гибридные орбитали, которые располагаются на одной прямой под углом 180°. Молекула общего вида АХ2 имеет
линейную структуру. Примеры соединений: ВеН2, ВеС12,СО2, CS2. Типы гибридизации
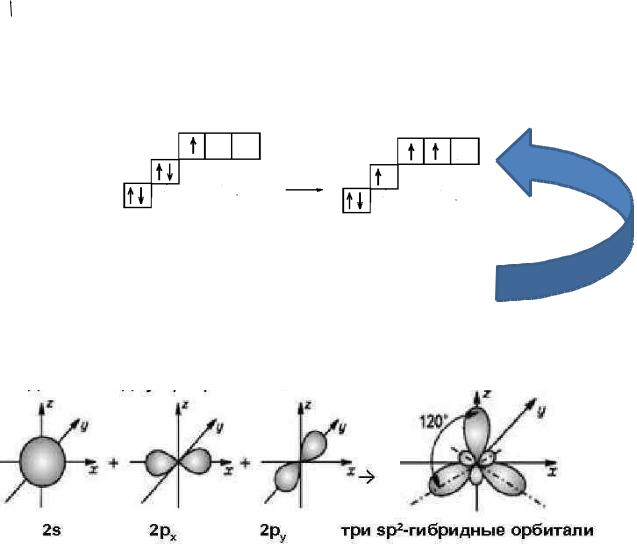
Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которые располагаются в одной плоскости под углом 120°. Молекула общего вида АХ3 имеет треугольную, плоскую
структуру.
Примеры соединений: ВCl3, ВН3, SO3. sр2-гибридизация характерна также для орбиталей углерода в молекуле этилена.Строение молекулы BCl3.
1. Электронная формула:
5B 1s22s22p1 17Cl 1s22s22p63s23p5
2.Переход атома бора в возбужденное состояние:
3.Пространственная схема В образовании связи участвуют одна s- и две р-орбитали, что приводит к образованию трех гибридных орбиталей, расположенных под углом 120о. У каждого атома хлора по неспаренному электрону.
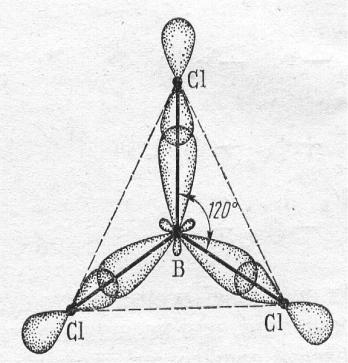
Атом бора образует с тремя атомами хлора три σ-связи по обменному механизму. Тип гибридизации – sp2. Молекула BCl3 имеет форму
равностороннего треугольника с атомом бора в центре. Валентный угол α в таких молекулах равен 120о
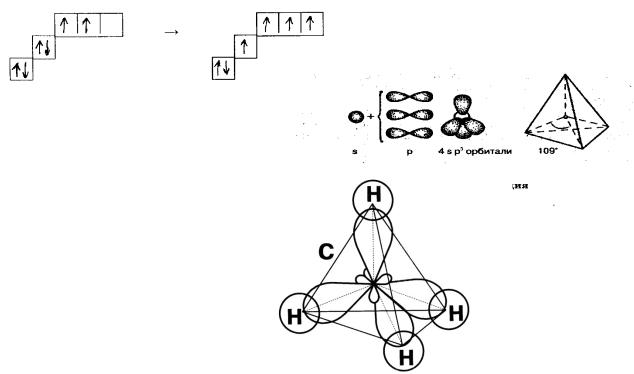
sp3- гибридизация
Гибридизуются одна s и три р-орбитали. Четыре гибридных облака направлены к вершинам тетраэдра и располагаются в пространстве под углом 109028′. Молекула общего вида АВ4 имеет форму тетраэдра.
Строение молекулы метана. Электронная формула
6С 1s22s22p2 |
1H 1s1 |
2.Схема перехода атома углерода в возбужденное состояние:
3.Гибридизация s- и трех р-орбиталей атома углерода.
4.Образование σ- связей между четырьмя гибридными орбиталями атома углерода и s-орбиталями четырех атомов водорода.
