
- •Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.)
- •Атомы не могут связываться друг с другом произвольно. Каждый атом способен связываться с
- •Завершенная внешняя электронная оболочка обладает меньшей (т.е. более выгодной для атома) энергией, чем
- •Классическая теория химической связи, была предложена Косселем (ионная связь) и Льюисом (ковалентная связь)
- •Для квантово-механического описания образования ковалентной связи используют два подхода – метод валентных связей
- ••3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных
- •Два механизма образования общих электронных пар
- •В образовании σ-связи могут принимать участие следующие типы орбиталей: s-s (как при образовании
- •Образование молекулы кислорода (О2)
- •.Число общих электронных пар между связанными атомами
- •Если связь между двумя атомами образована тремя общими электронными парами, то такая связь
- •Валентность элементов в ковалентных соединениях
- •Пространственная конфигурация молекул по модели гибридизации валентных орбиталей.
- •Гибридизация - это смешивание и выравнивание по форме и по энергии орбиталей одного
- •sp-гибридизация
- •Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которые располагаются в
- •Атом бора образует с тремя атомами хлора три σ-связи по обменному механизму. Тип
- •sp3- гибридизация
- •Атом углерода образует четыре одинарные связи с атомами водорода, все эти связи –
- •Строение молекулы аммиака (NH3)
- •2. Донорно-акцепторный механизм образования ковалентной связи:
- •Количественные характеристики химической связи.
- •Полярность связей и молекул.
- •Межмолекулярные взаимодействия
- •Типы межмолекулярного взаимодействия
- •Взаимодействие диполь - индуцированный диполь (индукционное взаимодействие).
- •Дисперсионное взаимодействие.
- •Водородная связь
- •Металлическая связь
- •1.Химическая связь – это совокупность сил, удерживающих вместе два или несколько атомов или
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные взаимодействия.
Химическая связь
Химическая связь – это совокупность сил, удерживающих вместе два или несколько атомов или ионов.
Атомы не могут связываться друг с другом произвольно. Каждый атом способен связываться с конкретным количеством других атомов, причем связанные атомы располагаются в пространстве строго определенным образом.
Причину этих ограничений следует искать в свойствах электронных оболочек атомов, а точнее - в свойствах внешних электронных оболочек, которыми атомы взаимодействуют друг с другом.
Завершенная внешняя электронная оболочка обладает меньшей (т.е. более выгодной для атома) энергией, чем незавершенная. По правилу октета завершенная оболочка содержит 8 электронов:
ns2np6
Таковы внешние электронные оболочки атомов благородных газов, за исключением гелия (n = 1), у которого завершенная оболочка состоит из двух s- электронов (1s2) просто потому, что p-подуровня на 1-м уровне нет.
Внешние оболочки всех элементов, кроме благородных газов, являются незавершенными и в процессе химического взаимодействия они завершаются.

Классическая теория химической связи, была предложена Косселем (ионная связь) и Льюисом (ковалентная связь) на рубеже 19-20 столетий. Обе теории исходили именно из положения об особой стабильности 2-х и 8-электронных оболочек.


Для квантово-механического описания образования ковалентной связи используют два подхода – метод валентных связей (МВС) и метод молекулярных орбиталей (ММО). Мы будем пользоваться только первым подходом (МВС). Рассмотрим его основные положения
Ковалентная связь Основные положения метода валентных связей (МВС)
1.В образовании связи участвуют электроны только внешней электронной оболочки;
2.Химическая связь образуется двумя валентными электронами с антипараллельными спинами. При этом электронные орбитали перекрываются, и между атомами появляется область с повышенной электронной плотностью.

•3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных орбиталей.
•4. Из нескольких связей данного атома наиболее прочной будет связь, которая получилась в результате наибольшего перекрывания атомных орбиталей.
•5. На схемах и в структурных формулах каждая ковалентная связь между атомами обозначается чертой —. Например, структурная формула молекулы водорода будет иметь вид H—H.
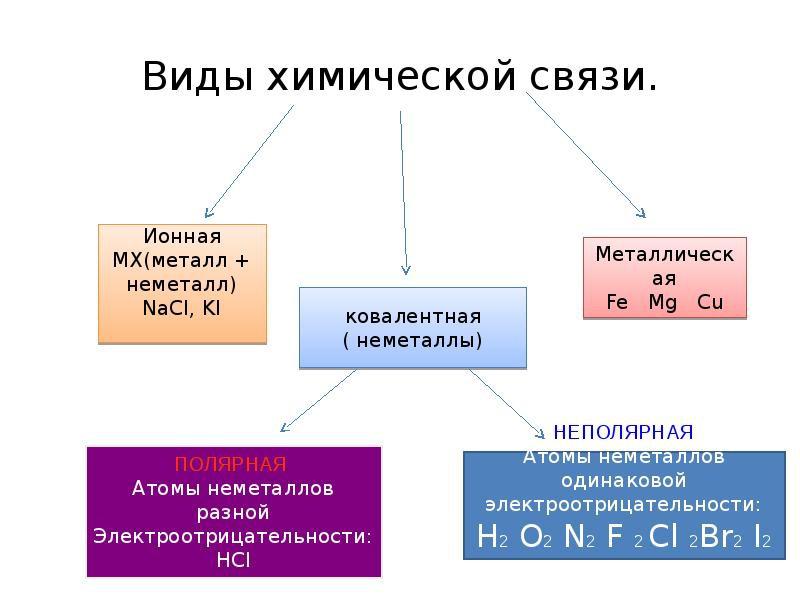
Два механизма образования общих электронных пар
Обменный механизм.
Рассмотрим схему этого механизма на примере образования молекулы фторида водорода (HF).
1. Схема образования молекулы:
H + F → HF (это схема, показывающая атомы, участвующие в образовании связи, а не химическая реакция!)
2. Электронные формулы элементов:
9F 1s23s22p5 |
1H 1s1 |
3. Графические формулы элементов
1H
4) Пространственная схема
Область повышенной электронной плотности лежит на линии, которая соединяет центры атомов. Такая связь называется σ-связью (сигма-связью)
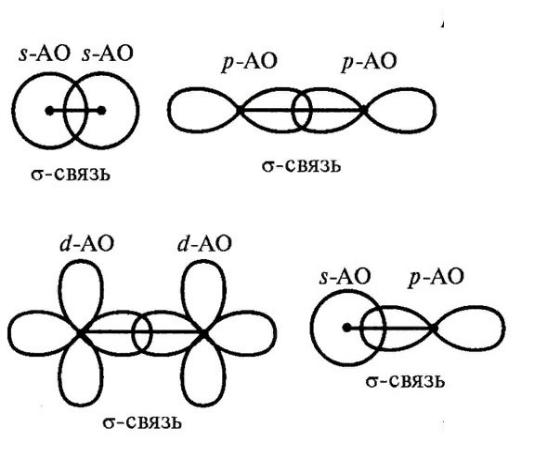
В образовании σ-связи могут принимать участие следующие типы орбиталей: s-s (как при образовании атома водорода), s-p (схема образования молекулы HF), p-p, p-d, d-d и др
