Энтальпия
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Определением этой величины служит тождество: H=U+PV
Размерность энтальпии-Дж/моль.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
![]()
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Энтропия
Основное
содержание второго начала термодинамики
заключается в постулировании существования
функции, называемой энтропией S, которая
для обратимых процессов определяется
по уравнению:
![]()
а
для самопроизвольных:
![]()
Изменение энтропии реакции можно рассчитать по формуле
![]()
Зависимость изменения энтропии от температуры выражается законом Кирхгофа:
![]()
Для
изолированной системы изменение энтропии
– критерий возможности самопроизвольного
протекания процесса. Если
![]() ,
то процесс возможен; если
,
то процесс возможен; если![]() ,
то в прямом направлении процесс
невозможен; если
,
то в прямом направлении процесс
невозможен; если![]() ,
то в системе равновесие.
,
то в системе равновесие.
-
Основные классы органических соединений.
|
№ п/п |
Гомологический ряд |
Функциональная группа |
Пример соединения |
Название |
|
1 |
Углеводороды предельные (алканы) |
|
|
Пропан |
|
2 |
Углеводороды этиленовые (алкены) |
|
|
Пропен |
|
3 |
Углеводороды ацетиленовые (алкины) |
|
|
Пропин |
|
4 |
Диеновые углеводороды (алкадиены) |
|
|
Бутадиен-1,3 |
|
5 |
Ароматические углеводороды |
|
|
Метилбензол (толуол) |
|
6 |
Спирты |
|
|
Этанол |
|
7 |
Фенолы |
|
|
Фенол |
|
8 |
Альдегиды |
|
|
Пропаналь |
|
9 |
Кетоны |
|
|
Пропанон |
|
10 |
Карбоновые кислоты |
|
|
Пропановая кислота |
|
11 |
Сложные эфиры |
|
|
Этил ацетат (уксусно-этиловый эфир) |
|
12 |
Амины |
|
|
Этиламин |
|
13 |
Аминокислоты |
|
|
Аминоэтановая кислота (глицин) |
|
14 |
Сульфокислоты |
|
|
Бензолсульфокислота |
Соединения с открытой цепью атомов углерода, называемые также ациклическими. В зависимости от характера связей между атомами углерода, эти соединения подразделяют на предельные (или насыщенные), содержащие в молекулах только простые (ординарные) связи, и непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные или тройные) связи между атомами углерода.
Соединения с замкнутой цепью атомов углерода, или карбоциклические. Эти соединения в свою очередь подразделяются на:
-
соединения ароматического ряда; они характеризуются наличием в молекулах особой циклической группировки из шести атомов углерода — бензольного ароматического ядра.
-
алициклические соединения — все остальные карбоциклические соединения. Они различаются по числу атомов углерода в цикле и, в зависимости от характера связей между этими атомами, могут быть предельными или непредельными.
Гетероциклические соединения. В молекулах этих соединений имеются циклы, включающие, кроме атомов углерода, также гетероатомы, т. е. атомы других элементов (кислорода, азота, серы и др.).
-
Механизмы образования ковалентной связи.
Основным признаком ковалентной связи является наличие общей электронной пары, принадлежащей обоим химически соединенным атомам, поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра. Возникновение общей электронной пары связи может проходить по разным механизмам, чаще — по обменному, а иногда — по донорно-акцепторных. по принципу обменного механизма образования ковалентной связи каждый из взаимодействующих атомов поставляет на образование связи одинаковое количество электронов с антипараллельными спинами. К примеру:

![]()
по донорно-акцепторному механизму двухэлектронная связь возникает при взаимодействии различных частиц. Одна из них — донор А: имеет неразделенную пару электронов (то есть такую, что принадлежит только одному атому), а другая — акцептор В — имеет вакантную орбиталь.


Частица, которая предоставляет для связи двухэлектронное облако (неразделенную пару электронов), называется донором, а частица со свободной орбиталью, которая принимает эту электронную пару, — акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и вакантной орбитали другого называется донорно-акцепторным механизмом.
-
Гравиметрический анализ. Основные операции.
Гравиметрией называют метод количественного анализа заключающийся в точном измерении массы определяемого компонента пробы в виде соединения известного состава или в форме элемента. Классическое название - весовой анализ. ГА основан на основе сохранения массы веществ при химических превращениях. Это наиболее точный из химических методов анализа.
Характеристики: предел обнаружения 0,001 гр. Погрешность 0,002 гр, информативность 17 бит. В ГА исполняют реакции обмена, замещения, разложения, комплексообразования, а также электрохимические процессы. Наиболее распространённый метод ограждения, которой состоит из следующих операций ионного обмена:
-
Взятие нарезки аналитического вещества.
-
Взвешивание нарезки.
-
Выбор растворителя.
-
Этот растворитель после взвешивания растворить в воде.
-
Осаждение. Cl-+Ar+ -> AgCl (↓); NaCl <-> Na++Cl-; AgNO3 <-> Ag++NO-3
-
Отделение осадка AgCl (↓) от раствора NaNO3: NaCl+AgNO3 -> AgCl (↓)
-
Выбор фильтра.
-
Фильтрование.
-
Выбор промывной жидкости и промывания осадка не холодной водой.
-
Получение ГА формы, а именно высушивание или прокатывания до постоянной массы.
-
Взвешивание.
-
Расчёт результатов анализов.
-
Выявление ошибок.
-
Квантовые числа электронов.
N – главное квантовое число, хар-ет энергетический уровень, равен номеру периода.
l – орбитальное квантовое число l=n-1
|
0 |
1 |
2 |
3 |
4 |
|
s |
p |
d |
f |
g |
ml – = -l, 0, +l
2l+1=1 => 1 квадрат
ms – спИновое квантовое число: +1/2, -1/2
-
Окислительно-восстановительные и кислотно-оснОвные свойства веществ.
Соединения максимальной степени окисления, которой обладает данный элемент, могут в окислительно-восстановительных реакциях являться только окислителями, а степень окисления элемента в данном случае будет только понижаться. Атомы элементов отдали свои валентные электроны и поэтому могут только принимать электроны.
Максимальная степень окисления элемента равна номеру группы периодической системы.
Соединения максимальной степени окисления могут быть только восстановителями, а степень окисления элемента будет повышаться.
В случае, если элемент находится в промежуточной степени окисления, то его атомы могут как принимать, так и отдавать электроны. Это зависит от условий реакции и вещества, с которым происходит взаимодействие.
Способность вступать в реакции, как с окислителями, так и с восстановителями называется окислительно-восстановительной двойственностью.
Вещества, обладающие окислительно-восстановительной двойственностью способны к реакции самоокисления-самовосстановления. При этом часть атомов элемента с промежуточной степенью окисления отдает электроны, а другая часть их принимает.
Пример реакции самоокисления-самовосстановления:
Cl20 + 2NaOH = Na+1Cl-1 + Na+1Cl+1O-2 + H20O-2,
В данном случае хлор является и окислителем, и восстановителем.
Реакцию самоокисления-самовосстановления называют реакцией диспропорционирования.
Кислотные свойства определяются тем, в большей или меньшей степени элемент проявляет свойства неметалла, чем меньше радиус атома элемента, тем он более склонен образовывать кислотный оксид, которому будет соответствовать гидроксид с наиболее ярко выраженными кислотными свойствами. И, наоборот, основные свойства будут проявлять оксиды и гидроксиды металлов, причем, чем больше радиус атома металла, тем в большей степени его оксиды и гидроксиды будут иметь оснОвный характер. Поэтому в периодах с увеличением заряда ядра металлические свойства ослабевают, а неметаллические усиливаются, поэтому оснОвные свойства оксидов и гидроксидов ослабевают, а кислотные усиливаются. У металлов семейства d-элементов оснОвный или кислотный характер оксидов и гидроксидов определяется их степенью окисления. Если степень равна (+1,+2),то оксид и гидроксид - оснОвные, если (+3),амфотерные, (+4,+5,+6 и +7) кислотные.
-
= 2
-
Скорость химических реакций и методы ее регулирования. Принцип Ле-Шателье.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени: υ = ΔC / Δt.
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности: υ = Δν / (S·Δt).
Способы увеличения скорости хим реакции:
-
Температура - при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
-
Концентрация. Также повысить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
-
Давление. Для газов концентрация напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
-
Катализатор. Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором. Это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции
-
Площадь соприкосновения реагирующих веществ. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
-
Природа реагирующих веществ. Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества. Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления определяется общим положениям, известным под названием принципа подвижного равновесия и принципа Ле Шателье.
Если на систему, находящиеся в равновесии, производятся какое-либо внешнее воздействие, то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
-
Условия осаждения кристаллических осадков
Осаждение нужно вести так, чтобы пересыщение раствора относительно осаждаемого соединения было минимальным, так как значительное пересыщение раствора способствует образованию большого числа мелких кристаллов - центров кристаллизации, размеры которых в дальнейшем почти не увеличиваются. При осаждении из разбавленных растворов образуется малое число центров кристаллизации, осаждение протекает медленно и мелкие кристаллы при этом растут.
Для получения крупнокристаллических осадков необходимо соблюдать следующие условия осаждения:
1) осаждают из достаточно (разбавленного раствора разбавленным раствором осадителя;
2) раствор осадителя добавляют очень медленно, по каплям, особенно в начале осаждения;
3) при введении осадителя раствор следует все время хорошо перемешивать стеклянной палочкой, чтобы предотвратить местные сильные пересыщения;
4) осаждение ведут из горячего раствора горячим раствором осадителя, так как нагревание обычно увеличивает растворимость мелких кристаллов и, соответственно, способствует росту крупных;
5) в некоторых случаях в начале осаждения для создания благоприятных условий роста кристаллов целесообразно несколько повысить растворимость образующегося осадка введением соответствующих реагентов; однако в конце осаждения растворимость осадка необходимо понизить для уменьшения потерь определяемого вещества, для этого вводят в раствор некоторый избыток осадителя, изменяют кислотность среды и т.д.
-
= 19
-
Гидролиз солей. Основные типы.
Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей.
Любую соль можно представить, как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей.
гидролиз по аниону
Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и сильное основание, например, по аниону гидролизуются метасиликат натрия (Na2SiO3), формиат натрия (HCOONa), ацетат калия (CH3COOK), сульфит кальция (CaSO3) и т.д.
Рассмотрим более подробно на примере ацетата калия (CH3COOK). Данная соль образована сильным основанием — гидроксидом калия (KOH)и слабой кислотой — уксусной (CH3COOH). Уравнение гидролиза будет выглядеть следующим образом:
-
CH3COOK ↔ СH3COO— + K+ (диссоциация соли);
-
СH3COO— + K+ + H2O ↔ CH3COOH + K+ + OH— (полное ионное уравнение);
СH3COO— + H2O ↔ CH3COOH + OH— (сокращенное ионное уравнение);
-
CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение).
Наличие ионов OH— в растворе свидетельствует о щелочном характере среды.
б) гидролиз по катиону
Этот тип гидролиза также характерен только для неорганических солей, в образовании которых участвовали сильная кислота и слабое основание, например, по катиону гидролизуются хлорид железа (III) (FeCl3), сульфат меди (II) (CuSO4), нитрат бериллия (Be(NO3)2) и т.д.
Рассмотрим более подробно на примере нитрата бериллия (Be(NO3)2). Данная соль образована слабым основанием — гидроксидом бериллия (Be(OH)2) и сильной кислотой — азотной (HNO3). Уравнение гидролиза будет выглядеть следующим образом:
Be(NO3)2 ↔ Be2+ + 2NO3— (диссоциация соли);
Be2+ + 2NO3— + H2O ↔ BeOH+ + H+ + 2NO3— (полное ионное уравнение);
Be2++H2O ↔ BeOH+ + H+ (сокращенное ионное уравнение);
Be(NO3)2 + H2O ↔ Be(OH)NO3 + HNO3 (молекулярное уравнение).
Наличие ионов H+свидетельствует о кислом характере среды.
в) гидролиз и по катиону, и по аниону
Этот тип гидролиза характерен только для неорганических и органических солей, в образовании которых участвовали слабая кислота и слабое основание. Например, по катиону и аниону гидролизуются сульфит аммония (NH4SO3), сульфид железа (II) (FeS), нитрит меди (II) (Cu(NO2)2) и т.д.
Рассмотрим более подробно на примере сульфида серы. Данная соль образована слабым основанием — гидроксидом железа (II) (Fe(OH)2) и слабой кислотой — сероводородной (H2S). Уравнение гидролиза будет выглядеть следующим образом:
FeS ↔ Fe2+ + S2- (диссоциация соли);
FeS — + H2O ↔ Fe(OH)2↓+ H2S↑ (молекулярное уравнение).
Среда нейтральная.
-
Методы редоксометрии.
Окислительно-восстановительным титрованием, или редоксиметрией, называют группу титриметрических методов анализа, основанных на использовании окислительно-восстановительных реакций. Методы, в которых рабочими растворами являются окислители (KMnO4, K2Cr2O7, I2 и др.), называют иначе оксидиметрией. С их помощью определяют количественное содержание веществ, обладающих восстановительными свойствами. Методы, в которых рабочими растворами или титрантами являются растворы восстановителей (аскорбиновой кислоты, гидразина, гидрохинона), называются редуктометрией. Они служат для количественного определения веществ, проявляющих окислительные свойства. Обычно названия методов редоксиметрии происходят от названия используемых в них рабочих растворов. Чаще всего применяют на практике следующие методы окислительно-восстановительного титрования: а) перманганатометрию (титрант – раствор KMnO4); б) иодометрию (титрант – раствор I2); в) хроматометрию (титрант – раствор K2Cr2O7); г) броматометрию (титрант – раствор KBrO3); д) нитритометрию (титрант – раствор NaNO2). Окислительно-восстановительные процессы лежат в основе горения топлива, коррозии металлов, электролиза, металлургии и т.д. С окислительно-восстановительными реакциями связаны дыхание, обмен веществ, гниение и брожение, фотосинтез и нервная деятельность живых организмов. В связи с этим редоксиметрия является одним из важнейших методов физико-химического исследования в химии, биологии, физиологии и медицине. Таким образом, далеко не каждая окислительно-восстановительная реакция может быть использована в титриметрии. Вещества, используемые в качестве титрантов в окислительно-восстановительном титровании, должны быть достаточно сильными окислителями или восстановителями, чтобы с хорошей скоростью, необратимо и количественно взаимодействовать с определяемым соединением. Для достижения данной цели при проведении анализа во многих случаях применяют различные дополнительные приемы: нагревание, введение в реакционную смесь катализаторов, создание соответствующей среды путём добавления определённого количества кислоты или щёлочи.
-
Титриметрический анализ, основные операции.
Титриметрическими называют методы анализа, основанные на титровании.
Титрование – это процесс определения вещества, при котором к нему постепенно прибавляют небольшие порции реагирующего с ним другого вещества до того момента, пока всё определяемое вещество не вступит в реакцию. Реагент, используемый для титрования, называется титрантом.
В титриметрических методах анализа титрант добавляют к анализируемому веществу в виде раствора с точно известной концентрацией растворённого вещества. Сейчас титрант, в принципе, можно добавлять не только в виде раствора, но и в виде порошка, таблеток, бумаги, пропитанной раствором реагента.
Момент титрования, при котором количество прибавленного титранта становится химически эквивалентным количеству определяемого вещества, называется точкой эквивалентности.
-
Коллигативные свойства растворов.
Основными независимыми переменными в теории растворов являются концентрация, температура и давление. В некоторых случаях число переменных, необходимых для расчета остальных параметров раствора, удается свести к минимуму. Так, определенные свойства разбавленного раствора нелетучего неэлектролита можно рассчитать, зная только концентрацию раствора и при этом абстрагируясь от химической природы растворенного вещества.
Свойства растворов, которые зависят только от концентрации компонентов, но не зависят от их природы, называются коллигативными.
К коллигативным свойствам растворов относят:
-
Понижение упругости растворителя над раствором,
-
Повышение температуры кипения растворов (в сравнении с чистыми растворителями),
-
Понижение температуры замерзания растворов (в сравнении с чистыми растворителями),
-
Возникновение осмотического давления,
-
Диффузия.
-
Условия осаждения аморфных осадков.
Осаждение аморфных осадков во многих отношениях отличается от условий осаждения кристаллических осадков. Это прежде всего связано со следующими особенностями аморфных осадков:
1) они склонны к адсорбции, т.е. к поглощению посторонних ионов или молекул из раствора, при этом примеси осаждаются на поверхности частиц осадка и происходит загрязнение его;
2) они легко образуют коллоидные растворы, при этом часть осадка остается в растворе и возрастают потери определяемого вещества.
Для осаждения частиц из коллоидного раствора их необходимо коагулировать. Коагуляцией называют процесс соединения коллоидных частиц в более крупные. Однако коллоидные частицы несут электрические заряды, препятствующие их коагуляции. Для нейтрализации зарядов коллоидных частиц в раствор добавляют коагулирующий электролит, катионы или анионы которого, адсорбируясь на поверхности коллоидных частиц, вызывают их коагуляцию и выпадение в осадок.
Осаждение аморфных осадков ведут при следующих условиях:
1) осаждают из горячих растворов;
2) перед осаждением добавляют в раствор какой-либо коагулирующий электролит (чаще всего соли аммония, так как они разлагаются при последующем прокаливании осадка);
3) осаждение ведут из концентрированных растворов концентрированными растворами осадителя; осадитель вводят быстро.
По окончании осаждения к раствору с осадком прибавляют большой объем горячей воды (примерно 100 мл) и хорошо перемешивают. Это способствует переходу адсорбированных поверхностью осадка примесей в раствор. Аморфные осадки фильтруют и промывают сразу после осаждения без отстаивания, так как за длительное время осадок сильно уплотняется и промывание его становится затруднительным.
Задачи:
 →
→
-
Подберите коэффициенты, схему окислительно-восстановительной реакции, используя метод электронного баланса. (Упражнение по теме окислит-восстан реакций)
ВООП – восстановитель отдает, окислитель принимает. Кислород проверяем последним
-
C0 + 4H+1N+5O-23 → 3C+4O-22 + 4N+2O-2 + 2H+12 O-2
3| C0
-4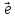 → C+4
– восстановитель
→ C+4
– восстановитель
4| N
+3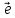 → N+2
– восстановитель
→ N+2
– восстановитель
-
10Na+1I-1 + 2Na+1I+5O-23 + 6 H+12S+6O-24 → 6I02 + 6Na+12S+6O-24 + 6H+12O-2
5| | 2I-1
-2 → I02
- восст-ль
→ I02
- восст-ль
|10| хрень с этими двумя I02 – закон сохран-я колич-ва элементов
1| | 2I+5
+10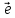 → I02
– окислитель
→ I02
– окислитель
Сокращаем на 2:
5NaI + NaIO3 + 3 H2SO4 → 3I2 + 3Na2SO4 + 3H2O
-
Cu0 + Pd+2(N+5O-23)2 → Cu+2(N+5O-23)-2 +Pd0
1| 2| Cu0
-2 →Cu+2
– восст-ль
→Cu+2
– восст-ль
1| 2| Pd +2 → Pd0
- окислитель
→ Pd0
- окислитель

-
Какой инертный газ и ионы каких элементов имеют одинаковую электронную конфигурацию с частицей, возникшей в результате удаления из атома Кальция Ca всех валентных электронов.
Инертные газы 8 группы А-подгруппы – благородные.
Ca (20) - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2, Ca (+20) )2)8)8)2

Ответ: Аргон (18).
-
Напишите электронную формулу атома …
Например, кальций: +2040Ca - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
-
К раствору хлорида натрия NaCl, объемом 120 мл, массовой долей NaCl 16%, плотностью 1,12 гр/мл прилили H2O V=80 мл, плотностью 1 гр/мл. Рассчитать массовую долю NaCl в полученном растворе.

-
Какая масса раствора с массовой долей гидроксида натрия NaOH 4% потребуется для полной нейтрализации HCl, массой 30 гр с массовой долей 5%?

n – количество вещества, w – массовая доля, M – молярная масса.
-
Напишите, как протекает гидролиз соли бромида меди CuBr2.
В тетради написано только молекулярные уравнения + ионный вид
Первая стадия гидролиза
Молекулярное уравнение: CuBr2 + HOH ⇄ CuOHBr + HBr
Полное ионное уравнение: Cu2+ + 2Br- + HOH ⇄ CuOH+ + Br- + H+ + Br-
Краткое ионное уравнение: Cu2+ + HOH ⇄ CuOH+ + H+
Вторая стадия гидролиза
Молекулярное уравнение: CuOHBr + H2O ⇄ Cu(OH)2 + HBr
Полное ионное уравнение: CuOH+ + Br- + H2O ⇄ Cu(OH)2 + H+ + Br-
Краткое ионное уравнение: CuOH+ + H2O ⇄ Cu(OH)2 + H+
Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет имееть кислую среду (pH < 7).
-
= 1
-
Напишите структурные формулы изомерных ацетиленовых углеводородов составом C7H12, главная цепь которых состоит из 5 углеродных атомов и назовите их.
Одна тройная связь 3,4-диметилпентин-1, 4,4-диметилпентил-2
-
Сколько электронов и протонов содержат частицы NO2- и PH3 (фосфин)?
PH3: у Н протонов 3 (1*1=1, а 3 – потому что в частице H3), у Р -15 (30-15). Всего 18 протонов, значит электронов 18.
NO-2: у N протонов 7 (14-7), у O – 8 (16-8), таких две. 7+8+8=23 протона. На один электрон должен быть больше, т.е. 23+1=24 электрона.
-
Определить заряд комплекса, степень окисления и координационное число комплекса образования, приведите названия следующих определений: [Cu(NH3)2]Cl; Cr[(NH3)2(H2O)3]Cl3 ; K3[FeBr6] .
K3[FeBr6] – гексоцианоферрат (III) калия, красная кровяная соль. Ион-комплексообразователь имеет заряд {-3} ([Fe(CN)6]{-3})
-
Написать структурные формулы всех изомерных углеводородов составом C6H12
Алкены и циклогексаны (одна двойная связь)
Циклогексан, метилциклогексан, 1,2-диметилциклобутан (квадрат с ногами), 1,3-диметилциклобутан (квадрат с левой ногой и правой рукой), этилциклобутан (квадрат из CH с ответвлением C2H5),
1-метил,2-этилциклопропан (треугольник, нога слева и нога со ступней справа),
1,2,3-триметилциклопропан (осьминожка)
Алкены: гексен-1, гексен-2, гексен-3
2-метилпентен-1, 2-метилпентен-2, 2,3-диметилбутен-1, 2,3-диметилбутен-2, 2-этилбутен-1, 2-этилбутен-2
-
Написать структурные формулы всех изомерных углеводородов составом C5H12
Алканы. Норм-пентан, 2,2-диметилпропан, 2-метилбутан.
-
Напишите электронную конфигурацию атома аргона Ar (18) в 1 возбужденном состоянии.

По правилу Кличковского: n+l должно быть наименьшее. Для 4s идет первее. n – главное квантовое число, = номеру периода, l – орбитальное квантовое число, l=n-1
|
0 |
1 |
2 |
3 |
4 |
|
s |
p |
d |
f |
g |
Например, l=3(аргон в 3 периоде лежит)-1=2, следовательно, d-семейство.
По правилу того человека n+l:
4s: 4+0=4,
3d: 3+2=5, 5<4, значит 4s идет первее 3d.
-
=1 Cu, Нитрат палладиума 2 – Pl(NO3)2 (Pl2+) и Нитрат меди 2 – Cu(NO3)2.
???
-
В лаборатории имеется раствор с массовой долей серной кислоты H2SO4 5,5%, плотностью 1,035 гр/мл. Определить объем раствора, который потребуется для приготовления раствора молярной массой 0,2М и объемом H2SO4 равным 300 мл.
В 1л, 1М (р-ра) H2SO4 содержит 98 гр/моль H2SO4.
0,3л 1М (р-ра) - . . . х гр H2SO4
х = (0,3л*98гр)/1л= 29,4 гр
В 0,3л 1М (р-ра) H2SO4 содержится 29,4 H2SO4
В 0,3л 0,25М (р-ра) содержится y гр H2SO4
Y= (0,25*29,4)/1=7,4 гр H2SO4
5,5/100=0,055=7,4/m гр.(р-ра)
m(р-ра)=7,4/0,055=135 гр
m=ρ*V, V=m/ρ=135/1,35=100 гр.
-
=6 NH4+
NH+4OH- = NH+ + OH-
NH+4OH- + HCl = NH4Cl + HOH
NH4Cl + HOH = NH+4OH- + HCl
Ионный вид: NH+4 +Cl- +HOH = H+ + Cl- +NH4OH
Сокращенный вид: NH+4 + HOH = H+ + NH4OH
Среда кислая.