
otchet111
.docБолее эффективно применение многоленточных сушилок с лентами из металлической сетки. В них сушильный агент движется перпендикулярно плоскости ленты сквозь находящийся на ней слой материала (перекрестный ток). При пересыпании материала с ленты на ленту увеличивается поверхность его соприкосновения с сушильным агентом, что способствует возрастанию скорости и равномерности сушки. Ленточные сушилки могут работать по различным вариантам сушильного процесса.
Ленточные сушилки громоздки
(подобно туннельным сушилкам) и сложны
в обслуживании главным образом из-за
перекосов и растяжения лент; их удельная
производительность (на 1 ![]() »
поверхности ленты) невелика, а удельные
расходы тепла (на 1 кг испаренной влаги)
довольно высоки. Кроме того, они непригодны
для сушки пастообразных материалов,
поэтому для этой цели их используют в
комбинации с вальцовыми сушилками.
»
поверхности ленты) невелика, а удельные
расходы тепла (на 1 кг испаренной влаги)
довольно высоки. Кроме того, они непригодны
для сушки пастообразных материалов,
поэтому для этой цели их используют в
комбинации с вальцовыми сушилками.

1- камера сушилки; 2 – бесконечная лента; 3 – ведущие барабаны;
4 - ведомые барабаны; 5 – калорифер; 6 – питатель; 7 – опорные ролики
Рисунок 2 – Многоленточная сушилка
В некоторых современных конструкциях ленточных сушилок применяется в качестве сушильного агента перегретый пар, иногда – в смеси с горячими инертными глазами.
Сушка перегретым паром (при отсутствии или очень малом содержании кислорода) представляет интерес для материалов, окисляющихся или загорающихся при повышенных температурах в присутствии кислорода воздуха. В конструктивном отношении эти сушилки сложны, так как во избежание попадания в них воздуха необходимо обеспечивать их герметичность.
3 Математическое моделирование кинетики химических реакции
Дана табличная зависимость скоростей химической реакции от концентрации основного реагирующего компонента Vr-Vr(Ca) при различных температурах (таблица 1) [3,6].
Таблица 1 - Зависимости скорости химической реакции от концентрации реагирующего компонента при различных температурах
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
№(j) |
t,˚C |
|
2,5 |
7,5 |
12,5 |
17,5 |
22,5 |
27,5 |
|
1 |
10 |
|
28,9 |
101,1 |
181,0 |
265,7 |
353,8 |
444,8 |
|
2 |
35 |
|
30,1 |
105,4 |
188,7 |
276,8 |
368,7 |
463,5 |
|
3 |
70 |
|
31,6 |
110,5 |
197,8 |
290,4 |
386,7 |
486,1 |
|
4 |
100 |
|
32,7 |
114,3 |
204,6 |
300,3 |
400 |
502,8 |
|
5 |
140 |
|
33,9 |
118,6 |
212,4 |
311,7 |
415,2 |
521,8 |
|
|
Са |
27,5 |
22,5 |
17,5 |
12,5 |
7,5 |
2,5 |
|
1 |
|
0 |
0,014132 |
0,03295 |
0,060575 |
0,110031 |
0,283041 |
|
2 |
|
0 |
0,013561 |
0,031625 |
0,058122 |
0,10556 |
0,271673 |
|
3 |
|
0 |
0,01293 |
0,030148 |
0,055426 |
0,100674 |
0,258902 |
|
4 |
|
0 |
0,0125 |
0,02915 |
0,053588 |
0,097332 |
0,250238 |
|
5 |
|
0 |
0,012042 |
0,028083 |
0,051624 |
0,093782 |
0,241275 |
Таблица 2 – Зависимость концентрации реагирующего компонента от времени реакции при различных температурах
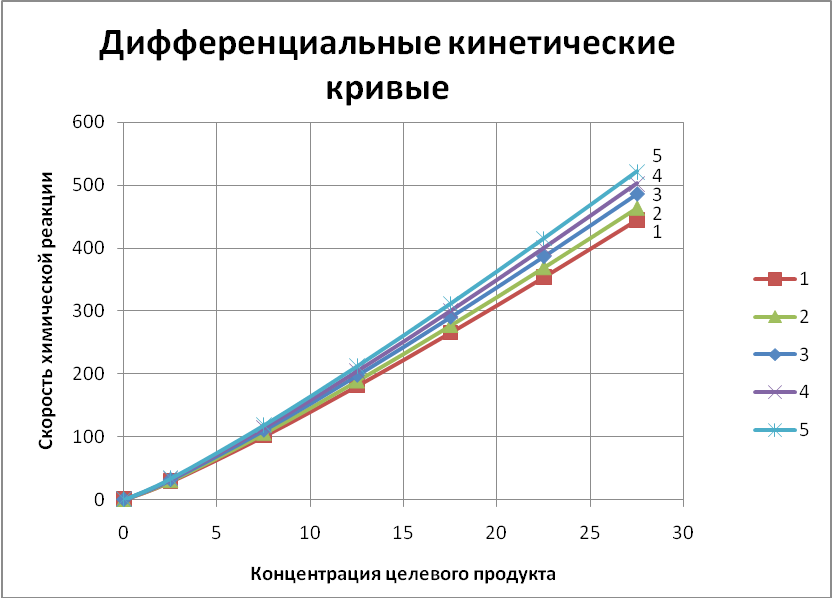
1 – при t=10°С; 2– при t=35°С; 3– при t=70°С; 4– при t=100°С; 5– при t=140°С
Рисунок 1 – Зависимость скоростей химической реакции от концентрации целевого продукта для различных температур
Рассчитаем время протекания реакции
по формуле
![]()
![]() [2]
[2]
Определили интегральную кинетическую
зависимость концентрации от времени
реакции Са=Са(![]() )
(таблица 2, рисунок 2).
)
(таблица 2, рисунок 2).
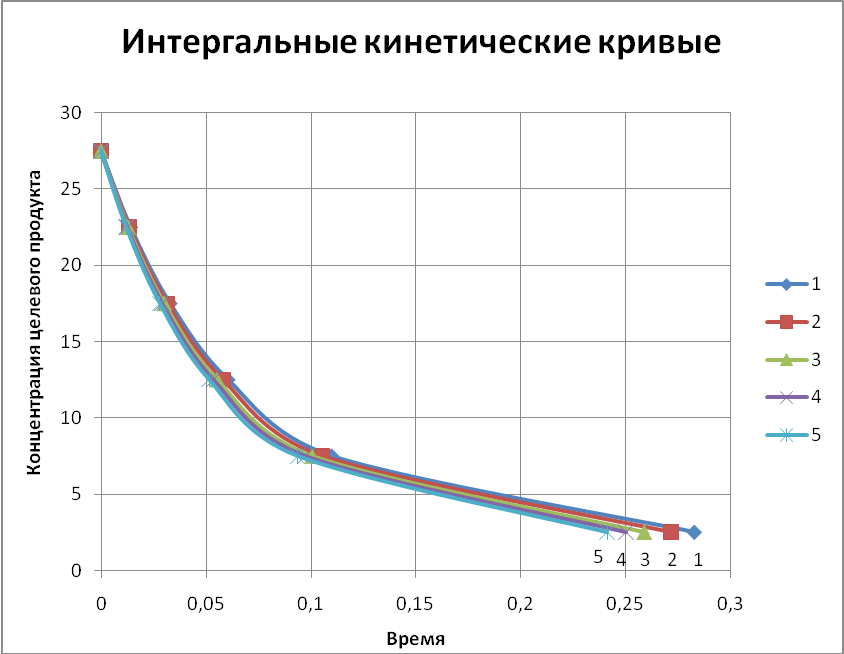
1 – при t=10°С; 2– при t=35°С; 3– при t=70°С; 4– при t=100°С; 5– при t=140°С
Рисунок 2 – Зависимость концентрации целевого продукта от времени реакции для различных температур
В таблице 3 представлены исходные данные, справочные данные и расчетные параметры, полученные при расчете уравнения Аррениуса методом наименьших квадратов на ЭВМ по программе «Kinetika».
Таблица 3 – Идентификаторы программы «Kinetika» для расчета параметров уравнения Аррениуса методом наименьших квадратов на ЭВМ
|
№ п/п |
Наименование параметра |
Размерность |
Обозначение |
Вел. |
|
|
в литерат. |
в програм. |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|||||
Продолжение таблицы 3
|
Исходные данные |
|||||
|
1 |
Массивы скоростей реакций при различных температурах |
кг/м3∙ч |
|
|
См. табл.1 |
|
2 |
Массив концентрации реагирующего компонента А |
кг/м3 |
|
|
См. табл.1 |
|
3 |
Массив температур, при которых заданы дифференциальные кинетические зависимости |
°C |
t |
t
|
См. табл.1 |
|
4 |
Число температур, при которых заданы дифференциальные кинетические зависимости (должно быть от 3 до 5) |
- |
m |
m |
5 |
|
5 |
Число параметров в массивах скоростей реакций и концентраций (должно быть от 3 до 10) |
- |
|
|
6 |
|
Справочные параметры |
|||||
|
1 |
Универсальная газовая постоянная |
Дж/моль∙К |
R |
R |
8,314 |
Продолжение таблицы 3
|
Расчетные параметры |
|||||
|
1 |
Массив теоретических значений скоростей реакций при различных температурах |
кг/м3∙ч |
|
|
См. табл.3 |
|
2 |
Относительное отклонение теоретических скоростей реакций при различных температурах от заданных экспериментальных значений |
% |
|
d
|
См. табл.3 |
|
3 |
Константа
скорости реакции при данной
|
-
|
K |
K |
См. табл.4 |
|
|
|
|
|
|
|
|
4 |
Порядок
реакции данной
|
-
|
n |
n |
См. табл.4 |
|
5 |
Константа скорости реакции при температуре стремящейся к бесконечности |
-
|
K0 |
K0 |
43,56 |
|
6 |
Энергия активации |
Дж/моль |
E |
E |
1,16∙103 |
Продолжение таблицы 3
|
7 |
Массив теоретических значений констант скорости реакции, рассчитанных по уравнению Аррениуса при заданных температурах |
-
|
Kt |
Kt |
См. табл.4 |
|
8 |
Относительные отклонения теоретических значений констант скорости реакции, рассчитанных по уравнению Аррениуса, от значений, рассчитанных по заданным дифференциальным кинетическим данным |
% |
|
dk |
См. табл.4 |
Основные расчетные формулы:
1. Линеаризированное уравнение для степенной кинетической зависимости скорости от концентрации:
![]()
![]() ;
;
![]() ;
;
или y=a+bx,где
y=![]() ,
x=
,
x=![]() ,
b=n [4].
,
b=n [4].
2. Формулы для определения коэффициентов a и b линеаризированного уравнения
 ;
;
 [5].
[5].
3. Относительное отклонение теоретических значений скоростей реакций от значений, заданных в таблице 3;
![]() .
.
4. Линеаризованная зависимость для уравнения Аррениуса:
![]() [7];
[7];
![]()
![]() [8];
[8];
Или y=a+bx, где
y=![]() ,
x=
,
x=![]() ,
a=
,
a=![]() ,
b=
,
b=![]() .
При этом расчеты коэффициентов a
и b проводятся по формулам
пункта 2 в пределах суммирования
.
При этом расчеты коэффициентов a
и b проводятся по формулам
пункта 2 в пределах суммирования
![]() .
.
5. Относительное отклонение теоретических
значений константы скорости реакции
![]() проводится по формуле:
проводится по формуле:
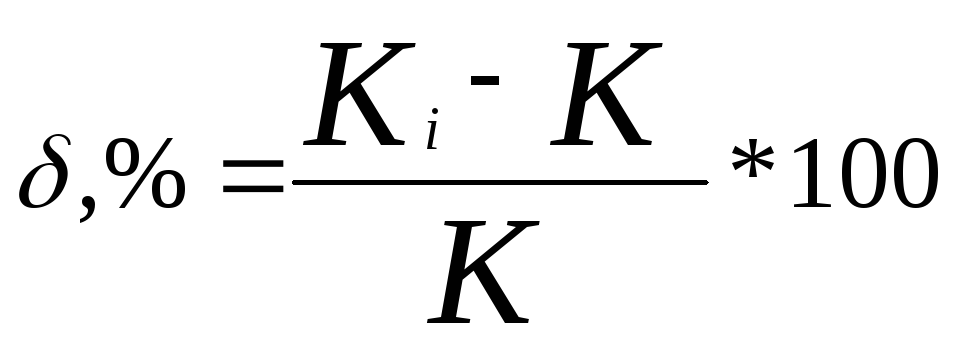 .
.
В таблице 4 представлены результаты расчетов зависимости скоростей реакций от концентрации в виде степенного уравнения
![]() и относительное отклонение экспериментальных
значений скорости реакции от значений,
рассчитанных в программе.
и относительное отклонение экспериментальных
значений скорости реакции от значений,
рассчитанных в программе.
Таблица 4 – Сравнение заданных и теоретических зависимостей скоростей реакции от концентрации при различных температурах
|
j |
t, |
Ca,кг/ |
2,5 |
7,5 |
12,5 |
17,5 |
22,5 |
27,5 |
|
1 |
10 |
|
28,9 |
101,1 |
181 |
265,7 |
353,8 |
444,8 |
|
|
28,8971 |
101,1142 |
181,025 |
265,6666 |
353,8106 |
444,7639 |
||
|
|
-0,0101 |
0,0141 |
0,0138 |
-0,0126 |
0,003 |
-0,0081 |
||
|
2 |
35 |
|
30,1 |
105,4 |
188,7 |
276,8 |
368,7 |
463,5 |
|
|
30,1069 |
105,3635 |
188,6457 |
276,8633 |
368,735 |
463,5375 |
||
|
|
0,023 |
-0,0346 |
-0,0288 |
0,0229 |
0,0095 |
0,0081 |
||
|
3 |
70 |
|
31,6 |
110,5 |
197,8 |
290,4 |
386,7 |
486,1 |
|
|
31,5939 |
110,5276 |
197,8585 |
290,3524 |
386,6683 |
486,0497 |
||
|
|
-0,0195 |
0,025 |
0,0296 |
-0,0164 |
-0,0082 |
-0,0104 |
||
|
4 |
100 |
|
32,7 |
114,3 |
204,6 |
300,3 |
400 |
502,8 |
|
|
32,6907 |
114,34 |
204,6627 |
300,3174 |
399,9192 |
502,6864 |
||
|
|
-0,0284 |
0,035 |
0,0307 |
0,0058 |
-0,0202 |
-0,0226 |
||
|
5 |
140 |
|
33,9 |
118,6 |
212,4 |
311,7 |
415,2 |
521,8 |
|
|
33,8974 |
118,6246 |
212,3852 |
311,7006 |
415,1289 |
521,8558 |
||
|
|
-0,0076 |
0,0208 |
-0,007 |
0,0002 |
-0,0171 |
0,0107 |
В таблице 5 представлены результаты расчетов константы скорости и порядка реакции от температуры в сравнении с их значениями, рассчитанными по уравнению Аррениуса методом наименьших квадратов на ЭВМ.
Таблица 5 – Зависимости константы
скорости реакции и порядка реакции от
температуры в степенных кинетических
уравнениях
![]() в сравнении с теоретическими значениями
константы скорости реакции, рассчитанными
для уравнения Аррениуса МНК на ЭВМ
в сравнении с теоретическими значениями
константы скорости реакции, рассчитанными
для уравнения Аррениуса МНК на ЭВМ
|
|
1 |
2 |
3 |
4 |
5 |
|
t,C0 |
10 |
35 |
70 |
100 |
140 |
|
n |
1,1401 |
1,1402 |
1,1399 |
1,1397 |
1,1402 |
|
K |
10,166 |
10,591 |
11,117 |
11,505 |
11,925 |
|
Kt |
10,167 |
10,595 |
11,113 |
11,495 |
11,933 |
|
∆ |
0,0023 |
0,0449 |
-0,0337 |
-0,0869 |
0,0734 |

 ,кг/м3
,кг/м3