
Травматология_челюстно-лицевой_области
.pdf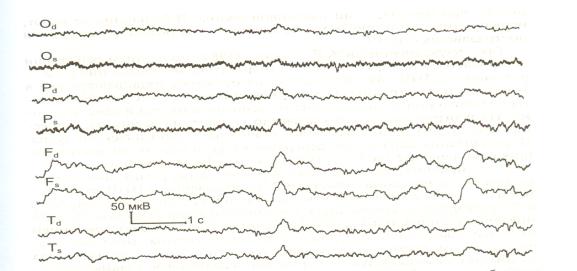
функциональные нагрузки. На электроэнцефалограмме (ЭЭГ) отсутствуют специфические изменения, характерные для отдельных видов травм челюстно-лицевой области, однако электроэнцефалограмме - картина свидетельствует о нарастании изменений в структурах головного мозга параллельно утяжелению клинических форм травмы челюстно-лицевой области (рис.22).
В ряде исследований, посвященных этой проблеме, авторы расценивают изменения на электроэнцефалограмме как проявление закрытой травмы головного мозга даже у пострадавших с нетяжелой травмой костей лица. Вряд ли можно безоговорочно согласиться с таким мнением. Отсутствие неврологической симптоматики и относительно быстрая регрессия электроэнцефалограмме - нарушений у больных с нетяжелыми повреждениями челюстнолицевой области позволяют расценивать их как отражение неспецифической защитно-компенсаторной реакции ЦНС на болевой синдром. Клинико-экспериментальные исследования, показали, что
Рисунок 22. Электроэнцефалограмма больного с переломами нижней челюсти и сотрясением головного мозга. Преобладает низковольтная быстрая активность, отдельные симметричные медленные волны.
повреждения периферических ветвей тройничного нерва при переломах костей лица, сопровождаясь патологической афферентной импульсацией, также способны вызывать достаточно выраженные нарушения функционального состояния ЦНС. Это приводит к снижению защитно-компенсаторных возможностей организма и способствует развитию осложнений. Поэтому оценка функционального состояния головного мозга у пострадавших с травмой челюстно-лицевой области имеет существенное диагностическое значение.
31
Реография
Репаративные процессы в кости тесно связаны с состоянием кровообращения в зоне перелома. Нарушения кровообращения являются одной из первых реакций организма на травму. Для их диагностики у пострадавших с травмой челюстно-лицевой области наибольшее распространение получила реография — регистрация колебаний электрического сопротивления тканей, обусловленных изменением кровенаполнения их при прохождении пульсовой волны. В большинстве работ, посвященных этой проблеме, приводятся результаты обследования пострадавших с переломами нижней челюсти.
Так, исследованиями А.Е. Савина (1984) по данным реографии установлено, что нарушения регионарного кровообращения у пострадавших с переломами нижней челюсти даже без смещения отломков развиваются уже в 1-е сутки после травмы. Отмечалось снижение интенсивности артериального притока, затруднение венозного оттока в зоне перелома. На реограммах на это указывало уплощение вершины, снижение амплитуды пульсовых волн, смещение дикротического зубца. Нормализация параметров реограммы у этой категории пострадавших отмечена уже на седьмые сутки после оказания помощи.
Сувеличением тяжести травмы расстройства регионарного кровотока
взоне перелома нарастают. У пострадавших с переломами нижней челюсти со смещением отломков амплитуда пульсовых волн на стороне перелома была в 2,3 раза ниже по сравнению с противоположной стороной. Восстановление регионарного кровообращения у больных с повреждением нижнего альвеолярного нерва и смещением костных отломков значительно замедляется. Так, артериальная гиперемия у большинства из них развивается только в конце третьей недели после травмы.
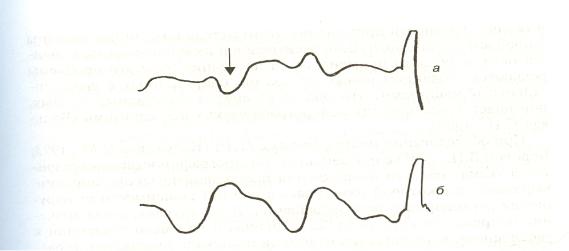
Осложнение переломов нижней челюсти развитием гнойновоспалительных процессов в костной ране сопровождается изменением на реограмме формы пульсовых волн. Практически у всех пострадавших с нагноением костной раны на стороне перелома регистрировались реограммы, на которых основная волна была направлена вниз (рис. 23). Такая инвертированная волна является наиболее характерным признаком развития гнойно-воспалительного процесса в костной ране.
Динамическое исследование регионального кровообращения у пострадавших с переломами костей лица с помощью реографии позволяет своевременно прогнозировать течение процесса консолидации отломков. Достоверным реографическим признаком наличия оптимальных условий в костной ране для заживления переломов
32
нижней челюсти следует считать развитие на 7—14-е сутки после травмы артериальной гиперемии в зоне повреждения.
Резкое снижение реографических показателей, отражающих интенсивность артериального притока, появление признаков венозного застоя, предстаза в сосудистом русле зоны перелома в сочетании с нарастанием клинических признаков воспаления являются прогностическими критериями развития гнойновоспалительного процесса в костной ране.
Эти данные о нарушении кровообращения у пострадавших с переломами нижней челюсти были подтверждены в последующих работах В.Н. Борового (2001).
Зуев В.П. (1989), пришел к заключению, что двучелюстное шинирование неблагоприятно сказывается на состоянии регионарного кровотока на стороне перелома нижней челюсти и практически не влияет на кровоток на неповрежденной стороне.
Рисунок 23. Реограмма больного с переломом нижней челюсти, нагноением костной раны. На стороне перелома (а) регистрируется инвертированная волна (стрелка). На неповрежденной стороне (б) инвертированная волна отсутствует.
Ультразвуковая остеометрия
Для контроля за процессами консолидации отломков при переломах костей лица в клинике наиболее часто используют рентгенографию. Этот метод может быть дополнен, а иногда и заменен, ультразвуковой остеометрией. В основе метода лежит измерение скорости распространения ультразвука в кости. Применяемый для этих целей аппарат ЭОМ-01ц регистрирует время прохождения сигнала, а скорость (в м/с) определяют математическими расчетами. В литературе приводятся данные и о времени, и о скорости (Логинова Н.К, и соавт., 1984; Боровой В.Н., 2001). Все они показывают, что переломы нижней челюсти сопровождаются снижением скорости распространения ультразвука и соответственно увеличением времени
33
прохождения сигнала почти на 1/3. На 3—4-й недели при неосложненной консолидации отломков скорость прохождения сигнала приближается к показателям у здоровых лиц и сравнивается с ними спустя 4—6 месяца. При развитии гнойно-воспалительного процесса в кости динамика прироста скорости замедлялась или принимала отрицательное значение.
Схожесть методики в проводимости звука была предложена (Сагатбаевым А.Д., 1999) при переломах нижней челюсти одонтокамертонометрической диагностике.
Глава 3. Репаративная регенерация костной ткани. 3.1 Методы оценки репаративного остеогенеза
При изучении местных функционально-биохимических и структурноморфологических изменений, возникающих при заживлении переломов костей, многие исследователи смогли уже сравнительно давно сформулировать положение о стабильности репаративного остеогенеза, подчеркивая при этом условность такого разделения, так как регенерация костной ткани представляет собой единый процесс, отдельные фазы которого взаимообусловлены и тесно связаны между собой.
1.Сначала происходит пролиферация соединительнотканных элементов, и на месте перелома образуется грануляционная ткань. Развивающийся отек ведет к выпадению нитей фибрина. Эти нити образуют пока еще беспорядочный клубок. Место повреждения костной ткани как бы «притягивает» минеральные соли, их приток постепенно увеличивается.
2.Нити выпавшего фибрина приобретают ориентировку по длинной оси костного сегмента и превращаются в коллагеновые волокна или, вернее, в коллагеновые трубочки, содержащие минеральные соли в растворенном состоянии. Формируется коллогеновая основа, белковая матрица костной ткани.
3.Минеральные соли из жидкого состояния начинают переходить в кристаллические. Образуются костные пластинки («балки»), еще лишенные гаверсовых каналов. Концентрация минеральных солей в эту фазу остается высокой.
4.Формируется зрелая костная ткань, кристаллы бетатрикальцийфосфата замещаются кристаллами гидроксилапатита.
5.Обменные процессы в новой костной ткани нормализуются, то есть интенсивность становится равной скорости обмена в
неповрежденных костях скелета.
Одним из актуальных аспектов в изучении механизмов репаративной регененрации костной ткани является исследование биоэнергетического обеспечения восстановительных процессов.
34
Было достоверно отмечено (Власов Б.Я., Сергеева Н.А., 1986) повешение активности сукцинатдегидрогеназы в период от одной до четырех недель после перелома. Начиная, с четвертой недели активность снижалась, приближаясь к норме.
Выявленное повешение активности сукцинатдегидрогеназы приходится на период консолидации, когда вследствие нарушения сосудистой сети косная мозоль может находиться в состоянии более или менее выраженной гипоксии.
Приводим данные по концентрации гормонов в ответ на травму костей челюстно-лицевой области.
Кортикотропин через четыре-пять часов после травмы происходило самое значительное (в10раз) увеличение концентрации гормона. К концу суток она снижалось (до 9,5 раз). Затем еще более резко уменьшалось. К седьмому дню она была на 31% ниже по сравнению с величиной к первому часу после травмы. К четырнадцатому дню концентрация уменьшалась в 4,6 раза, а концу месяца в два раза. В последующие недели второго месяца концентрация кортикотропина изменялось очень незначительно.
Кортизол в ближайшие часы после травмы наблюдалось увеличение в 2,9 раза. К концу суток отмечалось тенденция к уменьшению (2,6 раза). В последующие семь дней продолжалось существенное снижение (1,9раза) концентрации. На второй-третьей неделях происходили снижение более медленными темпами. Величина, близкая к норме, определялась к концу месяца, а полная нормализация отмечалось на сорок пятый день.
Альдестерон в ближайшие четыре-пять часов концентрация увеличивалась в 4,0 раза, а к концу суток уже начинала снижаться (3,5 раза). К седьмому дню установлено дальнейшее уменьшение (в2,5 раза), на четырнадцатый день она была больше нормы в 1,6 раза, на третьей недели снижалась более медленными темпами. К концу последующих двух недель медленно происходила нормализация.
Паратирин в течение первых суток концентрация возрастала в 6,5 раз. Увеличение происходило вплоть до четырнадцатого дня, однако ежедневный темп прироста концентрации был меньше, чем в первые сутки, и составлял 60% за каждый день. В итоге на четырнадцатый день она была больше нормы в 14,3 раза. На третьей недели наблюдалось довольно существенное ее снижение (на51% за каждый день). В течение четвертой недели уменьшение концентрации происходило более быстрыми темпами (140% за каждые сутки) и на двадцать восьмой день она была близка к норме. Полная нормализация отмечалась на сорок пятый день после перелома. Соматотропин, концентрация этого гормона возрастала довольно медленно (первые сутки увеличение в 1,3 раза). В дальнейшем ( до двадцать первого дня) концентрация возрастала прямолинейно
35
(средняя величина прироста за сутки 36%). В конце первого месяца (третья неделя) прирост несколько ослабевал. Максимальные значения (9,1 раза) концентрации отмечены на двадцать восьмыесорок пятые дни, затем она очень медленно (на 6% за сутки) уменьшалось. Полная нормализация установлена на сто тридцать пятый день после перелома.
Кальцитонин, изменения развивались одновременно с соматотропином, однако увеличение было более медленным: первый день содержание увеличивалось на 10%, на третий на 25%. Прирост в два раза отмечен только на пятнадцатые сутки. Максимальная концентрация достигалось на сорок пятый день и затем медленно снижалось, достигая нормы только на сто пятые сутки.
Циклические нуклеотиды.
цАМФ через четыре-пять часов после травмы наблюдалось самая высокая концентрация (28,6 ± 3,1 ммоль/мл). К концу первых суток отмечалось тенденция к снижению. В последующие дни происходило, прямолинейное уменьшение и к четырнадцатому дню концентрация была близка к норме, а на двадцать первый день наблюдалось нормализация.
цГМФ, статистически достоверное увеличение содержание данного нуклеотида обнаружено на третьи сутки. В дальнейшем отмечалось стремительное увеличение с максимальной концентрации (в 2,2 раза) на четырнадцатые сутки. Затем она довольно медленно снижалось, и достигала нормы на сорок пятый день.
В ответ на травму следует незамедлительная реакция со стороны гипофиз-адреналовой системы: увеличивается концентрация кортикотропина, стимулирующего продукцию гормонов коры надпочечников. Отмечается увеличение активности паращитовидных желез. Под влиянием этих гормонов в мембранах клеток активируется аденилциклазы. В результате этого возрастает образование цАМФ. Повышение концентрации альдестерона ведет к усилению выведения калия, задержке воды в организме, повышению проницаемости соединительно - тканевых барьеров в месте травмы, развитию асептической воспалительной реакции, повышению антитоксических свойств сыворотки по отношению к некоторым бактериальным токсинам.
Усиленное выведение ионов калия приводило к повышению гидрофильности тканей, мышечного тонуса. Конкретным проявлением этого эффекта являлась отечность поднижнечелюстной и щечных областей, у некоторых больных в течение нескольких дней отмечалось субфебрильная температура. Паратирин повышал содержание кальция и снижал количество фосфора в крови. Это происходило в результате активирования резорбтивных процессов. Одновременно с растворением костного минерала происходила резорбция и органического матрикса, состоящего главным образом из
36

коллагеновых волокон и гликозаминогликанов. В результате этих процессов с первых же дней после перелома наблюдалось повышенное накопление меченного пирофосфата, а также уменьшение величины костного минерала. Через две недели на рентгенограмме была видна деминерализация костных отломков
(24,25,26,27).
Рисунок 24. Обзорная рентгенограмма черепа в прямой проекции Перелом нижней челюсти в области тела справа. Снимок выполнен В момент обращения больного, через 5 часов после травмы.
Рисунок 25. Обзорная рентгенограмма того же больного. Снимок выполнен через 1 сутки после травмы. Плоскость перелома широкая, контуры неровные.
37
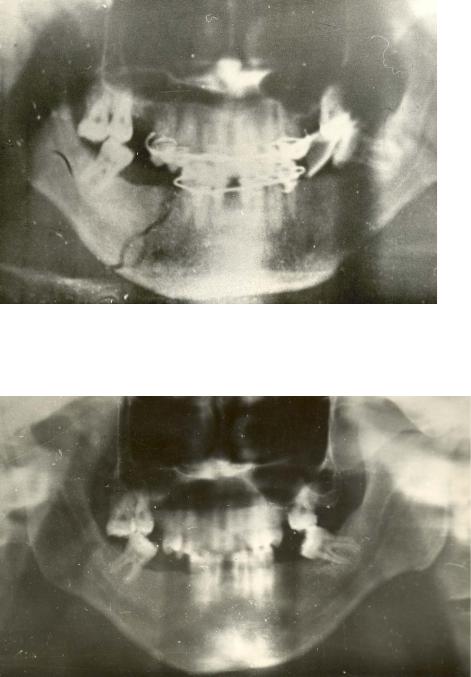
Рисунок 26. Обзорная рентгенограмма того же больного через 22 дня после травмы. Плоскость перелома существенно сузилась, контуры краев костных фрагментов ровные.
Рисунок 27. Обзорная рентгенограмма того же больного через 1 год, линия перелома не определяется.
Высокая концентрация кортизола угнетает синтез клеточных ферментов, биосинтез белка в печени, ускоряются аминотрансферазные реакции и распад некоторых аминокислот. Усиливаются процессы гликонеогенеза в печени, снижается утилизация углеводов в других тканях. Однако концентрация кортикотропина и кортикостероидов быстро снижается и начинает нарастать концентрация соматропина и кальцитонина, а также цГМФ. Кальцитонин ослабляет деминерализацию костных фрагментов, тормозит активность остеокластов, рассасывающих кость, способствует увеличению массы формирующего регенерата.
38
Соматотропин подавляет действие инсулина, стимулирует образование коллагена путем воздействия на биосинтез РНК и ДНК и включение аминокислот в полипептидную цепь, оказывает влияние на минеральный обмен. В результате такого действия в отломках прекращается дальнейшая убыль минералов, и они начинают нарастать.
Экспериментальным путем было доказано, что костные раны заживают либо первичным, либо вторичным мозолеобразованием.
При экспериментальном изучении морфогенеза костной мозоли и клиническом изучении динамики течения заживления переломов установлено, что при первичном заживлении костная рана заполняется остеогенной тканью, образующейся из камбиальных элементов периоста, эндоста и компактной кости.
Первичным костеобразованием заживают вколоченные и компрессионные переломы, а также хорошо репонированные и фиксированные переломы. Консолидация этих переломов происходит быстро, с незначительно выраженной периостальной реакцией и с полным анатомическим и функциональным восстановлением поврежденных органов.
Вторичным костеобразованием заживают плохо репонированные переломы, с недостаточно плотным контактом, подвижностью отломков, при зиянии костной раны, при интерпозиции мягких тканей между отломками и все открытые переломы, осложненные нагноением.
Для вторичного костеобразования требуется больше времени, чем для первичного костного сращения. Последние может служить эталоном оптимальной скорости заживления кости.
К настоящему времени достигнуты определенные успехи, которые позволяют исследователям более детально сопоставить морфологические и химические процессы в регенерате, и на этой основе получить более полное представление их стадийности.
Впервые часы после травмы кости развивается генерализованная катаболическая фаза общей защитной реакции организма. Местные процессы
вобласти перелома, характеризующиеся распадом мукопротеинов, полипептидов и других органических соединений, приводят к уменьшению общего белка крови, изменению соотношения между белковыми фракциями сыворотки крови и усилению окислительно-восстановительных реакций, процессов декарбоксилирования, гидролитического и энзиматического расщепления с участием соответствующих ферментов.
Впоследующем, по мере заживления перелома, анаболические процессы начинают преобладать над катоболическими, что проявляется активной защитной реакцией организма, сопровождающейся гипергликемией, усилением способности тканей депонировать аскорбиновую кислоту и таких ферментов, как оксидоредуктазы, гидролазы и синтетазы. Интенсификация биосинтеза специфических белков и ферментов совпадет
39
с периодом наиболее активного формирования коллагеновой матрицы костного регенерата.
3.2 Методы оптимизации репаративной регенерации
Сцелью оптимизации пролиферации, дифференцировки, ферментативной активности остеогенных клеток используют большое количество средств, непосредственно действующих на них.
Арсенал известных и применяющихся на сегодняшний день средств и методов подразделяются в зависимости от их влияния на репаративную регенерацию на две основные группы.
Впервую группу входят средства и методы, которые устраняют различные факторы, подавляющие регенеративные процессы, действуя на них косвенно.
Во вторую группу вошли средства, оптимизирующие образование естественных стимуляторов регенерации и обладающие органной, тканевой и клеточной специфичностью. Такое подразделение все же является условным.
Впроцессе репаративной регенерации кости ведущая роль принадлежит кровообращению в зоне перелома. Зависимость течения репаративной регенерации костей от степени развития микроциркулярной сети общепризнанна – кость образуется вокруг сосудов, проросших в грануляционную ткань. Так (Скагер А.А., Лурье Т.М. 1982г.) доказали, что клеточная активность и кровоснабжение находятся в тесной связи между собой и образует единый сосудисто-регенерационный комплекс в процессе заживления перелома. При нарушении кровоснабжения зоны перелома кости развивается явления гипоксии, что отрицательно влияет на репаративный остеогенез и тормозит его. Оксибиотический метаболизм в зоне перелома находится в прямой зависимости от васкуляризации. Отсутствие или недостаточное проростание сосудов
вмежклеточном регенерате ведет к образованию хряща. С целью ликвидации гипоксии, улучшения окислительно-восстановительных процессов и предупреждения развития воспалительных осложнений в области нарушения целостности кости проводили под кожную оксигенацию. С этой же целью применяют гипербарическую оксигенацию. Гипербарическая оксигенация нормализует активность щелочной фосфотазы крови и кальция плазмы крови, тормозит резорбцию костной ткани, и активизирует ее построение.
Для уменьшения локальной гипоксии используют биоэлектростимуляцию жевательных и височных мышц. Так, (Мирзакулова У.Р. 1999г.) включила электростимуляцию в комплексное лечение больных с переломами нижней челюсти и снизила продолжительность лечения больных.
40
