
2_2015_Thermodynamics
.pdf
«Ряд напряжений металлов» - - неоткалиброванная шкала стандартных потенциалов
Восстановители: боргидрид (-1.25 В) |
|
Потенциал, В |
HBO3/HBH4 |
Ni2+/Ni |
(н.в.э.) O2/H2O |
При pH = 0!
H3PO3/H3PO2 |
0 |
Сu2+/Cu |
K2PtCl4/Pt |
|
гипофосфит (-0.5 В) |
H+/H |
|||
|
||||
|
|
2 |
|
|
«Сильный» окислитель (восстановитель) нужно выбирать не в стандартных условиях, а в условиях проведения реакции.
При более высоком рН (сместились потенциалы всех систем,
в которых в равновесии участвуют ионы гидроксония!) |
11 |
|
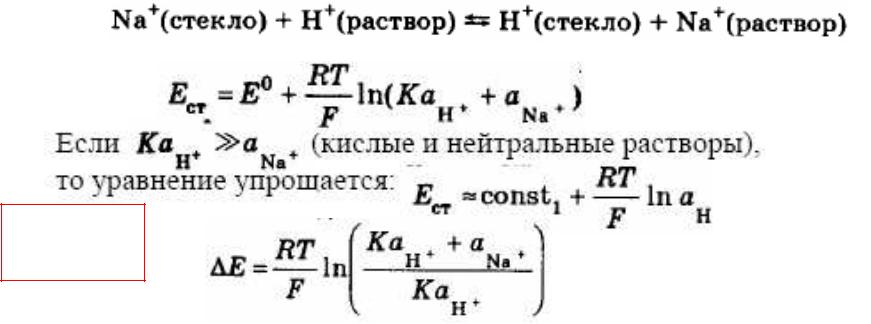
мембранное равновесие
F.Donnan, 1911 - мембрана между растворами (1) и (2),
проницаемая по ионам + и —
E |
D |
= ϕ (1) − ϕ (2) = |
RT |
ln |
a−(1) |
= |
RT |
ln |
a+(2) |
|
|
|
|
||||||
|
|
F a(2) |
|
F a(1) |
|||||
|
|
|
|
|
− |
+ |
|||
Уравнение Никольского для стеклянного электрода:
pH = - lg(aH+)
Щелочная
ошибка:
12

Reference value standard
Учет коэффициента активности хлорида |
13 |
в среднем коэффициенте активности – сверхтермодинамический. |
|
14

Буферный раствор позволяет сохранять pH =const при изменении соства раствора
HA ↔ H+ + A- |
Слабая кислота (pK |
= - lg K > 1) |
|
a |
a |
MA ↔ M+ + A- |
Соль той же кислоты (диссоциирована нацело) |
|
Буферная емкость = 1 если изменение рН на 1 происходит при введении 1 моля сильной кислоты или основания в 1 литр буферного раствора.
15

Зависимость окислительно-восстановительных потенциалов от природы растворителя
-Скачок потенциала на границе двух жидкостей – неизмеряем.
-Работа переноса иона из одной жидкости в другую – неизмеряема.
−FEOx / Re d = GRe d − GOx + GResolvd − GOxsolv
«Универсальная» шкала потенциалов для всех растворителей предполагает Reference систему с как можно менее выраженной 16
сольватацией.
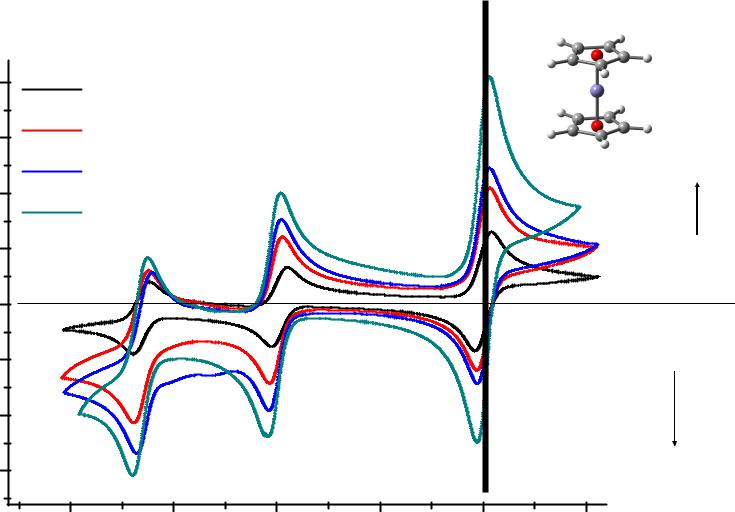
Ферроценовая шкала – Fc непосредственно в рабочем растворе
|
20 |
|
15 |
|
10 |
I, μΑ |
5 |
0 |
|
|
-5 |
-10 -15
[C4mim][PF6] [C4mim][BF4] [C4mim][NTf2]
[C4mim][DCA]
окисление
восстановление
Хинон + 2е = гидрохинон
-2,0 |
-1,5 |
-1,0 |
-0,5 |
0,0 |
0,5 |
E, V (vs Fc+/Fc)
17
Как можно нарушить равновесие в электрохимической цепи:
- создать градиент концентрации без изменения состава раствора
диффузия
- вызвать направленное перемещение ионов наложением электрического поля
миграция
- изменить состав раствора по отношению к равновесному
химическая реакция
18

Диффузия
(I закон Фика)
Поток диффузии |
Коэффициент диффузии |
Миграция
Поток миграции |
Подвижность |
19

диффузионный потенциал
|
RT |
II |
ti |
|
|
ϕдифф = − |
∫ ∑ |
d ln ai |
|||
F |
z |
||||
|
|
I i |
i |
||
j+ = j− c+ c−
ϕдифф
|
1-ый закон Фика |
|
|
zi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
||||||||||
; j = −D gradc − |
|
u c gradϕ; |
D |
|
|
|
|
|
|
u |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
i |
|
|
i |
i |
|
|
| z | |
i |
i |
|
|
|
|
i |
= |
|
| z |
|
| F |
i |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
||||||||||
|
|
|
|
диффузия |
|
i |
|
миграция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
ti |
= |
ui |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение |
|||||||
|
|
∑ui |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нернста-Эйнштейна |
|||||||||||||
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
D− − D+ |
|
|
|
cII |
= − |
|
RT t− |
+ |
t+ |
|
|
|
|
cII |
|||||||||||||||
= |
|
|
|
|
|
|
ln |
|
|
|
|
|
|
|
|
|
|
|
|
ln |
|
|
||||||||||||
|
F |
z D + | z |
− |
| D |
c |
I |
|
F |
z |
− |
z |
|
|
c |
||||||||||||||||||||
|
|
|
+ + |
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
I 20 |
|||||||||||||
