
09_10_06
.pdf146 ПАТОЛОГИЯ Глава 6 |
ИММУННАЯ СИСТЕМА В |
|
ГЛАВА |
||
НОРМЕ И ПАТОЛОГИИ |
||
6 |
||
М.А. Пальцев |
Иммуноморфология как раздел патологии сформировалась в кон це 1970 х годов, когда возможности биотехнологии позволили предложить для диагностики коммерческие АТ. Наличие широ кого спектра АТ дает возможность выявить множество Аг, важ ных для постановки диагноза или проведения дифференциальной диагностики. Использование иммуноморфологии как диагности ческого метода требует от практического врача элементарных зна ний механизмов иммунного ответа.
Организация иммунной системы
Иммунная система развилась у человека в качестве защиты про тив микробных инфекций. Она обеспечивает две формы имму нитета: специфическую и неспецифическую. Специфический им мунный ответ защищает организм от конкретного возбудителя. Он вступает в действие тогда, когда неспецифический иммунный ответ исчерпывает свои возможности.
НЕСПЕЦИФИЧЕСКИЙ ИММУННЫЙ ОТВЕТ
Нормальная кожа и всевозможные эпителиальные покровы сли зистых оболочек образуют первый, но простой и весьма эффек тивный барьер на пути инвазии патогенных возбудителей. В боль шинстве случаев в слизистых оболочках используются механизмы, облегчающие изгнание таких возбудителей. К ним относятся дви жение стенок органов, выстланных эпителием, при кашле, чиха нье и рвоте, а также постоянное движение слизи в дыхательных путях (мукоцилиарный конвейер), обеспечиваемое работой рес ничек мерцательного эпителия. Сходная функция осуществляет ся в кишечнике с помощью перистальтики. Наконец, ток сте рильной мочи способствует очищению мочевых путей, а ток слёзной жидкости — очищению глаз.
ГУМОРАЛЬНЫЕ МЕХАНИЗМЫ
Жидкости, вырабатываемые большинством тканей организма, содержат факторы, способные убивать или тормозить рост пато генных возбудителей. Так, пот, выделяемый потовыми железами кожи, обладает противомикробными свойствами, а кровь, слёзная жидкость, слюна и секреторные продукты кишечника богаты ли зоцимом, полиаминами и прочими антибактериальными агента ми. Ряд защитных белков, имеющихся в крови и других жидких средах организма, содержит компоненты комплемента, С реак тивный белок и ИФН. Кроме того, например, в состав кишеч ных секреторных продуктов входят факторы, обладающие неспе
Иммунная система в норме и патологии |
|
147 |
цифическими иммунными свойствами, — же лудочный сок, панкреатические ферменты и соли жёлчных кислот. Их наличие делает мес тную окружающую среду неприемлемой для возбудителей, попавших в кишечник.
КЛЕТОЧНЫЕ МЕХАНИЗМЫ
Различение «своего» и «чужого» — важный механизм специфического иммунного ответа, выражающийся в рас познавании компонентов собственных тканей организма и чужеродных продуктов. Состояние стабильной специ фической невосприимчивости к своим тканям — иммуно логическая толерантность. Если организм воспринимает собственные компоненты как чужеродные, развивается
аутоиммунный ответ.
В механизмах неспецифического иммунитета уча ствует множество типов клеток: все ПЯЛ (нейтро фильные, базофильные и эозинофильные), моно нуклеарные фагоциты, тучные клетки и естественные киллеры. Хорошо известно, насколь ко широко распространены в тканях клетки систе мы мононуклеарных фагоцитов. В зависимости от органной принадлежности они имеют разные на звания: в соединительной ткани и лимфоидной системе — гистиоциты, в печени — купферовские клетки, в лёгких — альвеолярные макрофаги, в го ловном мозгу — клетки микроглии, в почечных клубочках — мезангиоциты, в других тканях — мак рофаги. Лейкоциты и макрофаги способны погло щать и уничтожать возбудителей. С помощью не специфических механизмов они способны уничтожать клетки организма хозяина, инфи цированные каким либо возбудителем. Все пе речисленные механизмы действуют быстро и на ранних этапах инфекции. Подчас они фун кционируют при отсутствии специфического иммунного ответа. Но многие из них бывают инициированы или усилены компонентами иммунной системы.
СПЕЦИФИЧЕСКИЙ ИММУННЫЙ ОТВЕТ
Признаками специфического иммунного отве та, отличающими его от неспецифических им мунных реакций, являются: специфичность, иммунологическая память, различение «свое го» и «чужого».
Специфичность проявляется в том, что инфекция, выз ванная каким либо возбудителем, приводит к развитию защиты только против этого возбудителя или близко родственного агента.
Память возникает после реализации иммунного ответа на какой либо конкретный возбудитель и сохраняется, как правило, в течение всей последующей жизни в ка честве защиты от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к воспроизведению биохимического состава антигенных детерминант па тогенного возбудителя. Механизм иммунологической памяти обусловливает ускоренный и сильный ответ (вто ричный иммунный ответ) при повторной инфекции. Он является основой развития иммунизации, т.е. естествен ной или искусственно созданной иммунологической защиты против такой инфекции.
Специфические иммунные ответы запускают суб станции, обозначаемые как Аг. Эти ответы прояв ляются в гуморальных и клеточных реакциях. Гумо ральный иммунный ответ выражается в синтезе специфических АТ, которые нейтрализуют Аг, за пустивший их синтез. Защита с помощью АТ может быть создана искусственным путём: после введения сыворотки крови от иммунного (т.е. имеющего АТ) индивидуума неиммунному человеку. У последне го в этом случае развивается пассивный иммунитет.
Клеточные иммунные механизмы не зависят от выработки АТ. Они реализуются с помощью лим фоцитов.
Нормальная защитная реакция на инфекцию вклю чает обе формы иммунного ответа и является слож ным процессом, в котором происходят взаимодей ствия между разными видами лимфоцитов, а также между лимфоцитами, макрофагами и другими клет ками.
КЛЕТОЧНЫЕ ОСНОВЫ ИММУННОГО ОТВЕТА
Все специфические иммунные ответы обеспечива ются взаимодействием лимфоцитов. АТ вырабаты вают B лимфоциты,аклеточныеиммунныереакции реализуют T лимфоциты. Эти лимфоциты часто именуют В и Т клетками соответственно. Развитие Т и B клеточных клонов — сложный процесс про лиферации и дифференцировки, приводящий к воз никновению популяций эффекторных клеток. В си стеме B лимфоцитов такими эффекторными элементамиявляютсяплазматическиеклетки,авси стеме T лимфоцитов — цитотоксические Т клетки (цТЛ) иТ клетки,участвующие в реакции гиперчув ствительности. При Т клеточной дифференциров ке также образуются лимфоциты, обладающие регу ляторными функциями, — хелперные и супрессорные Т клетки. Кроме того, клональная пролиферация Т и B клеток приводит к возникно вению популяций антиген специфических клеток (клетки памяти). Их функция заключается в быст ром ответе на будущее воздействие существующего в памяти Аг, иными словами, в обеспечении вторич ного иммунного ответа. Клеточные механизмы, на
148 ПАТОЛОГИЯ Глава 6
чинающие свою работу в ходе и после распознава нияАг,реализуютсявовторичныхлимфоидныхорга нах: лимфатических узлах, селезёнке, нёбных мин далинах, пейеровых бляшках тонкой кишки и лимфатическом аппарате червеобразного отростка слепой кишки.
Рециркуляция лимфоцитов. Различные отделы лимфоидной системы не следует рассматривать по отдельности и в статическом представле нии. Между этими отделами существует посто янный обмен лимфоидными клетками (рецир куляция лимфоцитов). Такой обмен повышает возможность контакта небольшого количества антигенспецифических лимфоцитов, находя щихся в любой части организма, с Аг.
Пути специализированной рециркуляции. Лимфоидные ткани, расположенные в слизистых оболочках, не только образуют самостоятельный отдел иммунной си стемы, но некоторые из них характеризуются свои ми, присущими только им путями рециркуляции лим фоцитов. В или Т клетки, претерпевшие активацию
впейеровых бляшках или брыжеечных лимфатичес ких узлах, обладают селективной способностью миг рировать в слизистую оболочку кишечника (хоминг),
вто время как лимфоциты из других лимфоидных органов такой способностью не обладают. Несмотря на то, что это обстоятельство облегчает размещение IgA детерминированных B клеток в местах их воздей ствия в кишечной стенке, всё же в селективной миг рации также участвуют Т клетки. Поэтому такая миг рация не является IgA детерминированной, как в других слизистых оболочках, а определяется специальными молекулами адгезии — адрессинами.
ФАКТОРЫ, ВОЗДЕЙСТВУЮЩИЕ НА ИММУННЫЙ ОТВЕТ
Форма иммунного ответа зависит от природы Аг, его дозы, пути проникновения в организм, а также от генетической конституции индиви дуума.
Пути поступления Аг в организм оказывают влияние на иммунный ответ и с качественной, и с количественной сто роны. Возможно, это обусловлено различиями между клет ками, встречающими Аг и участвующими в его представле нии. Подкожный, внутримышечный и внутрикожный пути поступления, как правило, сопровождаются сильно выра женными иммунными ответами, в то время как внутривен ное попадание (или введение) Аг обычно вызывает слабое ответное образование АТ и специфическую иммунологи ческую толерантность. Небольшие объёмы растворимых Аг, поступающих per os, но избегающих разрушения пище варительными соками и потому всасываемых, как правило, тоже вызывают иммунологическую толерантность. Одна ко живые организмы и Аг из плотных частиц стимулируют активные иммунные ответы при попадании на поверхность слизистых оболочек. Иммунные реакции слизистых обо лочек обычно ограничены пределами поверхности той сли зистой оболочки, которая первой встречает Аг, в то время как парентеральный путь попадания Аг редко вызывает раз витие иммунитета слизистых оболочек.
Доза вводимого Аг. В общих чертах: чем выше доза Аг, попадающего в организм, тем сильнее иммунный ответ. Однако исключительно низкие или, наоборот, слишком большие дозы Аг могут приводить к иммунологической толерантности, толерантности низкой и высокой дозы соответственно.
Роль генетической конституции. Разнообразие специ фических иммунных ответов, которые могут проявлять ся у индивидуума, зависит от ряда генетически детер минированных факторов. Последние включают в себя различные антигенсвязывающие сайты, имеющиеся и на молекулах АТ, и на рецепторах клеточной поверх ности Т лимфоцитов. Иммунитет ко многим патоген ным возбудителям может быть также детерминирован генами, контролирующими неспецифические иммун ные факторы, например фагоцитарную и расщепляю щую функции макрофагов. Кроме того, гены специфи ческого иммунного ответа (Ir гены), расположенные внутри главного комплекса гистосовместимости (МНС), хотя и не кодируют связывающие Аг сайты АТ или Т клеток, но оказывают влияние на представление Аг этим клеткам.
Главный комплекс гистосовместимости (МНС) содержит ряд генов, кодирующих группу высокополиморфных гликопротеинов плазмолеммы. У человека эти гены называются лейкоцитассоциированными (HLA Аг). Они играют центральную роль в иммунном распознавании. Комплекс генов HLA из классов I и II кодирует белки, занимающиеся распознаванием Аг, а белки, кодируе мые генами класса III, имеют отношение к эффектор ному плечу иммунного ответа и тканевому ответу на повреждение.
ГУМОРАЛЬНЫЙ ИММУНИТЕТ
Попадание в организм человека Аг, ранее неизвестного этому индивидууму, приводит к первичному антительному ответу. Пример но через 7 дней после попадания Аг в крови появляется небольшое количество специфи ческих АТ (IgM), а через 2 нед — высокая концентрация АТ, в основном класса IgG (рис. 6 1). Повторное попадание того же Аг в организм в более отдалённый срок приво дит ко вторичному, или анамнестическому,
ответу (ответу памяти). В этом случае отно сительно быстро появляются большие коли чества специфического IgG. Такой вторичный ответ развивается примерно через 3–4 дня и может продолжаться в течение нескольких не дель.
Выработка АТ требует пролиферации и дифферен цировки (т.е. созревания) B клеток. АТ, циркули рующие в кровотоке, вырабатываются в основном плазматическими клетками селезёнки, костного мозга и лимфатических узлов. Эти клетки обнару живаются также в лимфатических образованиях слизистых оболочек, не говоря уже о том, что их бывает много и в зонах воспаления. Каждая плаз

Иммунная система в норме и патологии |
|
149 |
Ðèñ. 6-1. Организация молекул Ig различных классов. IgD, IgE, IgG представлены в форме мономеров, IgA — моно- и димеров, IgM — пентамеров [138].
матическая клетка постоянно продуцирует лёгкие цепи — κ или λ (но никогда то и другое одновре менно) — вместе с тяжёлыми цепями лишь одного класса Ig. Характеристика разных классов Ig при ведена в статье «Иммуноглобулины».
КЛЕТОЧНО-ОПОСРЕДОВАННЫЙ ИММУНИТЕТ
Различные эффекторные функции, относимые к клеточно опосредованному иммунитету, подчине ны Т клеткам, которые также играют центральную роль в регуляции специфического иммунного отве та и ответственны за стимуляцию многих неспеци фических механизмов воспаления. На Т клетки приходится около 70% лимфоцитов периферичес кой крови, но их популяция существенно разно родна.
ЭФФЕКТОРНЫЕ T КЛЕТКИ
Существуют две главные группы эффекторных Т клеток: цитотоксические T лимфоциты (цТЛ), непосредственно лизирующие соответствующие клетки мишени, способные к уничтожению не которых клеток злокачественных опухолей и трансплантатов, а также Т клетки, опосредующие ответы гиперчувствительности замедленного типа
(ГЗТ). Ответы ГЗТ осуществляются при помощи цитокинов, которые способствуют восполнению и активации клеток неспецифического воспали
тельного ответа, прежде всего макрофагов. Реак ции ГЗТ чрезвычайно важны при реализации за щитных процессов от всевозможных возбудителей, склонных к внутриклеточному паразитированию, а также при отторжении трансплантатов, при ауто иммунных реакциях.
РЕГУЛЯТОРНЫЕ T КЛЕТКИ
Имеется по меньшей мере две группы регулятор ных Т клеток. Хелперные T лимфоциты (ТH) по могают в выработке АТ в ответ на воздействия боль шинства Аг. Супрессорные Т клетки (Ts) играют роль в предотвращении аутоиммунных реакций и в регуляции общего уровня и устойчивости защит ных иммунных ответов.
РАСПОЗНАВАНИЕ АГ Т КЛЕТКАМИ
Несмотря на то, что распознавание Аг (рис. 6 2) при помощи МНС и T клеточного рецептора даёт первоначальный стимул для активации T лимфоцитов, этого ещё недостаточно, чтобы вызвать пролиферацию этих клеток. Размноже ние T лимфоцитов требует наличия определён ных неспецифических костимулирующих факто ров. Некоторые из таких факторов (цитокинов), в частностиИЛ1,вырабатываютсяантигенпредстав ляющими клетками после взаимодействия с T лимфоцитами.

150 ПАТОЛОГИЯ Глава 6
Ðèñ. 6-2. Распознавание антигена рецептором T-лимфоцита. При помощи рецептора Т-лимфоцита Т-клетка распозна¸т Аг, но только находящийся в комплексе с молекулой MHC. В слу-
÷àå ÒH-клетки (хелперы) в процессе участвует е¸ молекула —
CD4, которая свободным концом связывается с молекулой MHC. Распознаваемый Т-клеткой Аг имеет два участка: один взаимодействует с молекулой MHC, другой (эпитоп) связывается с рецептором Т-лимфоцита. Подобный тип взаимодействия,
но с участием молекулы CD8, характерен для процесса рас-
познавания TC-лимфоцитом (цитотоксический T-лимфоцит) Аг, связанного с молекулой MHC класса I [105].
Антигенпредставляющие клетки (рис. 6 3) экспрессируют Аг МНС класса II и способны поглощать и обрабатывать слож ные Аг. Среди антигенпредставляющих клеток наилучшим образом охарактеризованы интердигитирующие дендритичес кие клетки, выявляемые в Т клеточных зонах лимфоидных органов. Сходные дендритические клетки макрофагальной природы можно обнаружить и в других тканях. Одним из наи более изученных типов дендритических элементов является клетка Лангерханса эпидермиса. Дендритические клетки — не единственные антигенпредставляющие элементы, способ ные к активации Т хелперов. При определённых обстоятель ствах макрофаги сами могут действовать и как антигенпред ставляющие клетки. Поскольку макрофаги экспрессируют молекулы МНС класса II после активации медиаторами Т кле ток (например, γ ИФН), представление Аг на их поверхности происходит главным образом в очагах хронического воспале ния.
B клетки тоже способны представлять Аг Т хелперам. Это может иметь существенное значение для ин дукции большинства первичных иммунных ответов. В результате представление B лимфоцитами специ фического Аг CD4+ Т хелперам оценивается как в тысячи раз более эффективное, нежели представле ние других неспецифических Аг.
Последующее связывание рецептором CD28 на Т клетках усиливает костимулирующую функ цию. У CD4+ Т клеток такая последовательность событий быстро вызывает синтез множества медиаторов, продолжающих процесс стимуля
ции. Наиболее важным из этих цитокинов считает ся ИЛ2 — фактор роста T лимфоцитов. Он необхо дим для репликации и завершения дифференциров ки T лимфоцитов. Другой медиатор Т клеточного происхождения — ИЛ4 — обладает сходными ауто и паракринными воздействиями на некоторые T лимфоциты.
Пролиферацию Т супрессоров также регулирует ИЛ2. Однако лишь небольшая часть таких клеток выра батывает этот цитокин. Поэтому для пролиферации и дифференцировки указанных клеток требуется наличие CD4+ лимфоцитов, секретирующих ИЛ2.
В иммунном ответе T лимфоциты играют двоякую роль: эффекторную и иммунорегуляторную. Эффек торныеТ клетки,определяющиеклеточно опосредо ванный иммунный ответ, подразделяются на цито токсические T лимфоциты и T лимфоциты, вырабатывающие цитокины (Т клетки, участвую щие в ГЗТ).
ЦИТОТОКСИЧЕСКИЕ Т КЛЕТКИ
Цитотоксические Т клетки (цТЛ) — популяция пол ностью дифференцированных антигенспецифичес ких T лимфоцитов, функция которых состоит в реа лизации антигенспецифического лизиса клеток мишеней путём непосредственного межкле точного контакта. Эти цТЛ зачастую содержат не многочисленныецитоплазматическиегранулыи,как правило, но не всегда, относятся к Т клеткам, огра ниченным типом CD8+ МНС класса I.
Благодаря экспрессии МНС класса I на всех клетках, содержащихядра,испособностиМНСсвязыватьсяс эндогенно синтезированными пептидами CD8+ ци тотоксическиеT лимфоцитывыполняютважныеза щитныефункциивтканяхпривирусныхинфекциях. Болеетого,посколькумногиевирусныеАг,распозна ваемые цТЛ, синтезируются на ранних стадиях ви русной репликации, элиминация инфицированных клеток может происходить до освобождения и выде ленияинфицирующеговируса.Менееизученной,но тоже важной представляется роль цТЛ в отторжении трансплантатов и клиренсе бактериальных и парази тарных патогенных возбудителей.
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ ЗАМЕДЛЕННОГО ТИПА
Реакции гиперчувствительности замедленного типа (ГЗТ) и T лимфоциты, принимающие в них участие, относят ко второму компоненту клеточно опосре дованного иммунитета. Различные виды реакций ГЗТ будут описаны далее в этой главе, а здесь обсуж

Иммунная система в норме и патологии |
|
151 |
Ðèñ. 6-3. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор Т-хелпера (РТК) распозна¸т Аг-детерми-
нанту (эпитоп), экспрессированную на поверхности Аг-представляющей клетки вместе с молекулой класса II MHC. Во взаимодей-
ствии участвует дифференцировочный Аг Т-хелпера — CD4. В результате подобного взаимодействия Аг-представляющая клетка секретирует ИЛ-1, стимулирующий в Т-хелпере синтез и секрецию ИЛ-2, а также синтез и встраивание в плазматическую мембрану того же Т-хелпера рецепторов ИЛ-2 (ИЛ-2 также стимулирует пролиферацию Т-хелперов). Отбор В-лимфоцитов проводится при взаимодействии Аг с Fab-фрагментами АТ (Ig) на поверхности этих клеток (правая часть рисунка). Эпитоп этого Аг в комплексе с
молекулой MHC класса II распозна¸т рецептор Т-хелпера, после чего из T-лимфоцита секретируются цитокины, стимулирующие
пролиферацию В-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие АТ к данному Аг [138].
даются важнейшие их механизмы и роль указанных лимфоцитов. Типичным примером механизмов та кихреакцийиработылимфоцитовГЗТявляетсякож ная реакция на введение туберкулина. Ответы ГЗТ характеризуютсявыраженнойинфильтрациейтканей T лимфоцитами и макрофагами. Как следует из на звания, реакции развиваются медленно, в течение 24–48 ч.
ВосноветканевыхпроявленийГЗТлежатзначитель но более сложные процессы, нежели изменения при ответах с помощью цТЛ. В большинстве случаев мес тная реакция инициируется популяцией T лимфоцитов, ограниченных типом CD4+ МНС классаII.Важнейшейфункциейэтихклетокявляется выделение множества цитокинов, которые дополня ютиактивируютфункциидругихклетоквоспалитель ного инфильтрата: макрофагов, эозинофилов, базо филов и тучных клеток. Наиболее изученным из цитокинов является γ ИФН. Он важен для реализа ции эффективного клеточно опосредованного им мунного ответа. γ ИФН активирует макрофаги, сти мулируятемсамымихфагоцитарнуюактивность.Он
повышает экспрессию молекул МНС класса II и сти мулирует выработку других воспалительных цитоки нов, включая: ИЛ1, ФНОα и α /β ИФН. В результате γ ИФН усиливает не только воспалительные и анти микробныефункциимакрофагов,ноиихспособность к обработке и представлению Аг Т клеткам. γ ИФН вызываеттакжефакультативнуюэкспрессиюАгМНС класса II на тканевых клетках и обладает противови руснымииантипролиферативнымисвойствами(рис. 6 4).
БиологическаярольГЗТвыражаетсяпреждевсеговза щите от устойчивых инфекций и микробов, способ ных размножаться внутри фаголизосом макрофагов. Продукция цитокинов лежит в основе способности небольшого числа антигенспецифических Т клеток индуцировать заметный воспалительный ответ, на правленный против ограниченных количеств Аг,«ус кользающего»отлизосом.Однакосильнаяактивация такихнеспецифическихиммунныхмеханизмовтаитв себерискнежелательныхтканевыхповрежденийужев процессепервоначальногозащитногоответа.

152 ПАТОЛОГИЯ Глава 6
Ðèñ. 6-4. Механизмы антивирусного действия γ -ÈÔÍ. А — в неинфицированных вирусом клетках ИФН вызывает развитие
«антивирусного состояния», блокируя проникновение в них вирусов. Б — после проникновения вируса в клетки, обработан-
ные ИФН, вирусная РНК индуцирует образование РНК-протеинкиназы. Фермент аутофосфорилируется, а затем фосфорилирует фактор элонгации 2, нарушая сборку белковой молекулы. Двунитевая вирусная РНК индуцирует синтез 2′5′-олигоадени- лат синтетазы, катализирующей образование аденинового тринуклеотида с уникальными 2′5′-фосфодиэфирными связями. Последний активирует латентные эндонуклеазы, разрушающие вирусные мРНК [138].
Иммунная система в норме и патологии |
|
153 |
Естественные киллеры (NK) в ходе клеточно опосре дованных ответов тоже способны проявлять цито токсическую активность. NK клетки являются лим фоцитами среднего размера, содержащими цитоплазматические гранулы. Эти клетки раньше на зывали «большими гранулярными лимфоцитами». Изза отсутствия у них наиболее типичных маркёров Т и B клеток их относят к группе нулевых клеток (или «ни Т , ни B клеточных лимфоцитов», null cells). NK реа лизуют тот же механизм, что и «классические» цТЛ, но цитотоксичность NK не ограничена МНС и не являет ся антигенспецифической. Предполагается, что кил лерное воздействие NK зависит от распознавания ими группы Аг дифференцировки. Эти Аг могут иметь боль шое значение в качестве барьера, стоящего «в первой линии» иммунного надзора, направленного против вирусных инфекций. Они могут служить и как неспе цифические регуляторы лимфо и гемопоэза. Таким об разом, NK явно представляют собой третью популя цию лимфоцитов. Но выделяют ещё одну линию киллерных клеток (К), представляющих собой попу ляцию, родственную NK и тоже относимую к нулевым лимфоцитам. К клетки обладают Fc рецепторами и обес печивают своё киллерное действие посредством антите лозависимых механизмов.
Кроме механизмов цитотоксичности и реакций ГЗТ, Т клетки отвечают и за регуляцию других ком понентов иммунного ответа. Благодаря своей спо собности непосредственно активировать B клетки некоторые и нечасто встречающиеся Аг способ ны индуцировать ответ АТ при отсутствии Т кле ток. Указанные тимуснезависимые Аг обычно яв ляются полимерными молекулами, содержащими множество идентичных детерминант. Эти детер минанты позволяют им формировать перекрёст ные связи с поверхностным Ig на B клетках. По скольку тимуснезависимые Аг включают в себя многие бактериальные поверхностные молекулы (эндотоксины, полимеризованный флагеллин, пневмококковый полисахарид и др.), этот тип Т независимого антительного ответа занимает важное место в иммунитете человека.
Вместе с тем тимуснезависимые Аг встречаются ред ко и, как правило, вызывают лишь продукцию IgM. Для инициирования продукции IgG АТ и для раз вития гуморального ответа, а также воздействия на другие — уже тимусзависимые Аг нужны антигенс пецифические CD4+ клетки.
Для воспроизведения эффективного антительно го ответа необходим тесный контакт между специфическими Т хелперами (ТH) и B клетками.
действий патогенных возбудителей. Менее извест но, что иммунные ответы контролируются с целью предотвращения продолжающегося и прогрессиру ющего повреждения тканей. При нарушении ука занного контроля в организме могут начать свою работу негативные регуляторные механизмы.
В начале этого раздела упоминалось, что стабиль ная специфическая невосприимчивость организма к собственным тканям относится к иммунологичес кой толерантности. Неспособность отвечать на воздействия аутоантигенов лежит в основе пре дотвращения аутоиммунных болезней. Напом ним, что такая «аутотолерантность» зависит преж де всего от клональной селекции аутореактивных Т клеток в тимусе плода. «Безответность» ауторе активных B клеток тоже может быть частью фено мена аутотолерантности.
Способность иммунной системы к развитию при обретённой толерантности такого типа необходи ма для предотвращения реакций гиперчувствитель ности во время первоначально защитного ответа на воздействие патогенного агента. Организму выгод нее становиться толерантным к некоторым типам чужеродных Аг, нежели проявлять иммунологичес кую реактивность к ним. Например, приём через рот растворимых белковых Аг вызывает подчас пе роральную толерантность, поскольку иммунный ответ на пищевые Аг мог бы спровоцировать неже лательные реакции гиперчувствительности на по вторные контакты с Аг.
ПАТОЛОГИЯ ИММУННОЙ СИСТЕМЫ
Различают 4 основных типа патологических состо яний иммунной системы:
1) реакции гиперчувствительности — механизмы иммуно логического повреждения при ряде заболеваний;
2) аутоиммунные болезни — иммунные реакции против собственного организма;
3) синдромы иммунного дефицита, возникающие вслед ствие врождённого или приобретённого дефекта нор мального иммунного ответа;
4) амилоидоз (рассмотрен в главе 2 «Повреждения»).
Реакции
гиперчувствительности
Общеизвестно, что одной из главных функций им мунной системы является защита от пагубных воз Контакт организма с Аг приводит не только к раз
витию защитного иммунного ответа, но и к появ

154 ПАТОЛОГИЯ Глава 6
лению реакций, повреждающих ткани. Экзоген ные Аг содержатся в пыли, пыльце растений, еде, ЛС, микробах, химических веществах, во многих препаратах крови, используемых в клинической практике. Реакции гиперчувствительности могут быть инициированы взаимодействием Аг с АТ или клеточными иммунными механизмами. Иммун ные реакции, повреждающие ткани, могут быть связаны не только с экзогенными, но и эндоген ными Аг.
Болезнигиперчувствительностиклассифицируютна основе иммунологических механизмов, их вызыва ющих. При I типе реакций гиперчувствительности иммунныйответсопровождаетсяосвобождениемва зоактивных и спазмогенных веществ. При II типе АТ участвуют в повреждении клеток, делая их воспри имчивыми к фагоцитозу или лизису. При III типе реакций гиперчувствительности (иммунокомплек сных болезнях) взаимодействие АТ с Аг приводит к образованиюиммунныхкомплексов,активирующих комплемент. Фракции комплемента привлекают нейтрофилы, которые вызывают повреждение тка ни.ПриIVтипереакцийгиперчувствительностираз виваетсяклеточныйиммунныйответсучастиемсен сибилизированных лимфоцитов.
ТИП I РЕАКЦИЙ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Тип I реакций гиперчувствительности (немедлен ный, анафилактический) может развиваться мест но и быть системным. Системная реакция разви вается в ответ на внутривенное введение Аг, к которому организм хозяина предварительно сен сибилизирован. Местные реакции зависят от мес та проникновения Аг и имеют характер отёка кожи (кожная аллергия, крапивница), выделений из носа и конъюнктив (аллергический ринит и конъ
юнктивит), сенной лихорадки, бронхиальной аст мы или аллергического гастроэнтерита (пищевая аллергия).
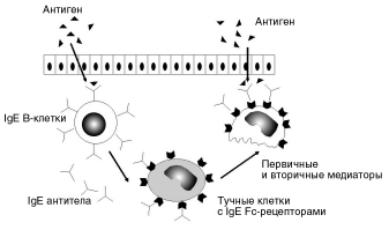
Развитие типа I гиперчувствительности у человека обеспечивают IgE. Сенсибилизированные Fc фрагментом IgE тучные клетки и базофилы ак тивируют компоненты комплемента С3а и С5а (ана филатоксины). Секрецию тучных клеток стимули руют также цитокины макрофагов (ИЛ8), некоторые ЛС (кодеин и морфин) и физические воздействия (тепло, холод, солнечный свет). Связывание моле кул IgE инициирует дегрануляцию тучных клеток (рис. 6 5) с выбросом первичных медиаторов, а так же синтез de novo и выброс вторичных медиаторов, таких как метаболиты арахидоновой кислоты. С эти ми медиаторами связано появление новых симпто мов реакции гиперчувствительности типа I.
ФАЗЫ РЕАКЦИЙ НЕМЕДЛЕННОЙ
ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Реакции гиперчувствительности типа I проходят в своём развитии две фазы (рис. 6 6). Фаза иници ального ответа развивается через 5–30 мин после контакта с аллергеном и характеризуется расшире ниемсосудов,повышениемихпроницаемости,атак же спазмом гладкой мускулатуры или секрецией желёз. Поздняя фаза наблюдается через 2–8 ч без дополнительных контактов с Аг и продолжается несколько дней. Она характеризуется интенсив ной инфильтрацией тканей эозинофилами, нейт рофилами, базофилами и моноцитами, а также по вреждением эпителиальных клеток слизистых оболочек.
Гистамин и лейкотриены быстро выделяются из сенсибилизированных тучных клеток и базофилов,
Ðèñ. 6-5. Дегрануляция тучных клеток. На поверхности тучных клеток молекулы IgE связаны Fc-рецепторами. Аг взаимодействует с Fab-фрагментами IgE. Активированная этим сигналом тучная клетка подвергается дегрануляции [105].
Иммунная система в норме и патологии |
|
155 |
Ðèñ. 6-6. Реакция гиперчувствительности типа I (немедленная).
обеспечивая реакции ГНТ, характеризующиеся отё ком слизистой оболочки, секрецией слизи, спаз мом гладкой мускулатуры. Многие другие медиа торы (например, фактор активации тромбоцитов FAT и фактор некроза опухолей ФНОα ) включают ся в позднюю фазу ответа, увеличивая количество базофилов, нейтрофилов и эозинофилов. Среди клеток, которые появляются в позднюю фазу реак ции, особенно важны эозинофилы. Спектр их ме диаторов так же обширен, как и в тучных клетках (см. статью «Эозинофил»). Помимо прочих, они продуцируют главный шелочной белок МВР и ка тионный белок ЕСР, которые токсичны для эпите лиальных клеток.
АНАФИЛАКСИЯ
•Системная анафилаксия возникает после вве дения гетерологичных белков: антисывороток, гормонов, ферментов, полисахаридов и неко торых ЛС (например, пенициллина). Тяжесть состояния зависит от уровня предварительной сенсибилизации. Шоковая доза Аг, однако, может быть исключительно мала.
•Местная анафилаксия называется иногда атопи ческой аллергией. Около 10% населения страдает от местной анафилаксии, возникающей в ответ на попадание в организм аллергенов: пыльцы расте ний, перхоти животных, домашней пыли и т.п. К заболеваниям,восновекоторыхлежитместнаяана филаксия,относяткрапивницу, ангионевротичес кий отёк, аллергический ринит (сенную лихорад ку) и некоторые формы астмы. Существует семейная предрасположенность к этому типу ал лергии.
ТИП II РЕАКЦИЙ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
При II типе гиперчувствительности в организме по являются АТ, направленные против компонентов собственных тканей, выступающих в роли Аг (рис. 6 7). Антигенные детерминанты могут быть связа ны с плазмолеммой или представляют собой экзо генный Аг, адсорбированный на поверхности клет ки. В любом случае реакция гиперчувствительности возникает как следствие связывания АТ с нормаль ными или повреждёнными структурами клетки. Известны три антителозависимых механизма разви тия реакции этого типа.
•Комплементзависимые реакции. Существует 2 механизма, с помощью которых АТ и комплемент могут вызывать гиперчувствительность типа II: прямой лизис и опсонизация. В первом случае АТ (IgM или IgG) реагирует с Аг на поверхности клетки, вызывая активацию системы комплемен та (рис. 6 8). Это приводит в действие мембрано атакующий комплекс, который нарушает целост ность мембраны. Во втором случае (рис. 6 9) клетки фагоцитируются после фиксации АТ или компонента комплемента С3b к поверхности клетки (опсонизация).
Клинически такие реакции возникают: при переливании крови несовместимого донора и реакции с АТ хозяина; при эритробластозе плода и антигенных различиях между ма терью и плодом, когда АТ (IgG) матери проникают сквозь плаценту и вызывают разрушение эритроцитов плода; при аутоиммунной гемолитической анемии (АИГА), агрануло цитозе и тромбоцитопении, когда происходит образование АТ против собственных клеток крови, которые затем раз рушаются; при некоторых реакциях на ЛС, когда образую щиеся АТ реагируют с ЛС и формируют комплексы с эрит роцитарным Аг.
