
09_10_01
.pdfГЛАВА
1
МЕТОДЫ ИССЛЕДОВАНИЯ В ПАТОЛОГИИ
А.А. Иванов, В.С. Пауков
Цели, стоящие перед любой наукой, могут быть достигнуты только в том случае, если она владеет методами и методиками, адекват ными поставленным задачам. Поэтому и патология на протяже нии столетий разрабатывала и совершенствовала свои методики. Именно новые возможности, которые возникали с появлением новых методов исследования, позволяли делать открытия, ради кально менявшие взгляды на патологию, начинать качественно новые этапы её развития.
Патологическая анатомия использует три основных метода ис следования — вскрытие трупов людей, умерших от болезней (1); микроскопические методы изучения тканей (2); эксперимент, позволяющий моделировать на животных патологические про цессы и болезни (3). Каждый из этих методов имеет множество методик, которые в совокупности позволяют наблюдать патоло гические процессы не только на уровне организма, но и на кле точном, субклеточном и молекулярном уровнях. Благодаря этим методам патолог может наблюдать единство структуры и функ ции и в физиологических условиях, и в условиях патологии, что качественно отличает современную патологию от патологичес кой анатомии и патологической физиологии даже первой поло вины ХХ в.
Описанию методов и методик, используемых в патологии, по священа многочисленная специальная литература, поэтому в дан ной главе будут описаны лишь принципы основных методов ис следования, позволяющие представить возможности современного патолога.
АУТОПСИЯ
Вскрытие трупов (аутопсия) — один из наиболее старых методов морфологического исследования. С древних времён вскрытие (сначала отдельных органов, а затем и трупов) использовали для определения причин болезней и выявления тех изменений орга нов и тканей, которые возникают при заболевании и приводят больного к смерти. Именно вскрытие трупов умерших позволяет говорить о том, что представляет собой болезнь, какой морфологи ческий субстрат соответствует нарушениям функций и клини ческим проявлениям болезни в её динамике, при выздоровле нии, инвалидизации или смерти больного. По изменениям органов и тканей, обнаруженным при вскрытии, можно судить об эффективности тех или иных лечебных мероприятий, об инду цированном патоморфозе болезней, а также о врачебных ошиб ках и ятрогениях. Нередко лишь на вскрытии возникают подо
10 ПАТОЛОГИЯ Глава 1
зрения на то или иное инфекционное заболе вание, что позволяет провести соответствующие исследования совместно с инфекционистами, эпидемиологами, фтизиатрами и другими спе циалистами. Иногда во время вскрытия трупа обнаруживаются погрешности в оперативном вмешательстве или в проведённых манипуля циях, а также криминальные причины смерти. Наконец, именно результаты вскрытия, тща тельное исследование всех изменений органов
исистем умершего позволяют составить наи более полное и объективное представление о том заболевании, которым страдал больной при жизни. Поэтому вскрытие обязательно предус матривает составление патологоанатомического диагноза, который строится по тем же прин ципам, что и клинический диагноз. Это по зволяет сравнивать клинический и патолого анатомический диагнозы, констатировать их совпадение или расхождение и в последнем случае оценивать значение врачебной ошибки
иискать вместе с клиницистами её причину. Тем самым вскрытие трупов умерших служит целям контроля лечебно диагностической дея тельности больницы или поликлиники и повы шения квалификации врачебного персонала.
Вместе с тем результаты аутопсии, зафиксиро ванные в протоколе вскрытия, позволяют про водить анализ ведения больного в клинике в тех случаях, когда речь может идти о врачеб ных преступлениях, дают возможность вести научные исследования и разрабатывать стати стические данные. По результатам патолого анатомических исследований медицинская ста тистика анализирует причины и характер смертности населения.
В связи с указанным аутопсия не теряет своего значения и при широком использовании био псийной диагностики заболеваний. Только вскрытие трупа позволяет увидеть и оценить всю историю болезни человека от начала и до конца, вместе с клиницистами проанализиро вать все этапы лечения больного, суммировать как положительный, так и отрицательный опыт врачей и обсудить все аспекты лечения и оши бок на клинико анатомических конференциях лечебных учреждений.
Патологоанатомические вскрытия трупов про изводит врач прозектор в патологоанатомичес ком отделении больницы. Иногда прозекторов называют патологоанатомами. Здесь нет прин ципиальных различий, но патологоанатомами официально являются преподаватели кафедр патологической анатомии и сотрудники соот
ветствующих подразделений научно исследо вательских институтов. В управлениях и ко митетах здравоохранения городского уровня, а также в министерствах здравоохранения обла стного, краевого и республиканского уровней имеется патологоанатомическая служба и дол жность главного патологоанатома.
Результаты аутопсии во многом зависят от ме тода вскрытия трупа. Существует несколько методов, которые использует патологоанатом в зависимости от конкретной ситуации и ус ловий, в которых производится аутопсия. Од ним из первых специальный метод вскрытия предложил Рудольф фон Вирхов, извлекавший органы по отдельности. При этом, однако, на рушаются анатомические связи между органа ми, что в ряде случаев может привести прозек тора к ошибке. Позднее А.И. Абрикосов предложил вести вскрытие, следуя топографи ческому расположению органов, которые при этом делятся на пять систем и извлекаются в пять приёмов. Недостатком метода является то, что он приводит к расчленению анатомо фи зиологических систем на фрагменты. Иногда при этом приходится рассекать опухоль или оперированные органы. Наибольшее распрос транение в практике получил способ Г.В. Шора, при котором органы выделяют не поодиночке, а целым органокомплексом. При эвисцерации сохраняются естественные связи между орга нами, а также изменения в их топографии, воз никшие в результате операции, определяются пределы прорастания опухоли и т.п. Исполь зование метода вскрытия по Шору не препят ствует применению специальных способов вскрытия отдельных систем организма (напри мер, эндокринной). Особенности различных способов вскрытия трупов описаны в специ альной литературе.
БИОПСИЯ
Биопсия — прижизненное взятие тканей, ор ганов или взвеси клеток для микроскопичес кого исследования с диагностической целью, а также для изучения динамики патологичес кого процесса и влияния на него лечебных мероприятий. В зависимости от способа взя тия материала выделяют инцизионную, пунк ционную, эндоскопическую и аспирационную биопсии.
Инцизионнаябиопсия
При инцизионной биопсии часть ткани из орга на или целый орган иссекают хирургическим
путём. Биоптат фиксируют в растворе формали на или другой фиксирующей жидкости, после чего проводят гистологическое исследование. Нередко характер патологического процесса (например, характер опухоли) необходимо ус тановить во время операции. В этих случаях показана срочная биопсия.
Ткань фиксируют быстро, обычно путём заморажива ния её в жидком азоте или с помощью углекислого газа. Затем из биоптата готовят гистологические срезы, ок рашивают и исследуют под микроскопом с целью сроч ной диагностики. Это чрезвычайно важно для опреде ления объёма оперативного вмешательства.
Пункционная биопсия
При пункционной биопсии столбик ткани из органа получают с помощью специальной иглы или троакара. Разновидностью пункционной биопсии является трепанобиопсия, при кото рой получают ткань костей или костного моз га с помощью специального инструмента — трепана.
Эндоскопическая биопсия
Благодаря развитию эндоскопических мето дов исследования появилась эндоскопичес кая биопсия. Особенно широкое распрост ранение получила эндоскопическая биопсия желудка, кишечника и бронхов. Объём мате риала, полученного с помощью эндоскопа, очень мал, поэтому высокая степень верифи кации патологического процесса может быть обеспечена только при исследовании 4–6 био птатов.
Аспирационная биопсия
Аспирационную биопсию применяют для ис следования жидкого содержимого полых орга нов или аспирата, полученного из полостей тела с помощью специальных инструментов. С этой же целью изучают диализный раствор из брон хов, желудка, плевральной или брюшной поло стей, из полости матки. Полученный материал подвергают в основном цитологическому ис следованию.
Подготовка материала
Полученные тем или иным путём кусочки тка ни для последующей световой микроскопии (СМ) обычно фиксируют в 10% нейтральном забуференном формалине. Для выявления от дельных компонентов клеток используют спе циальные фиксирующие жидкости — Буэна, Карнуа и др. Фиксированный материал режут
Методы исследования в патологии |
|
11 |
на микротоме, после чего применяют обзор ные окраски срезов или проводят различные гистохимические реакции. Для электронной микроскопии (ЭМ) существуют специальные методы приготовления биопсийного материа ла, который затем режут на ультратоме, доби ваясь толщины среза в 30–50 нм.
Биопсию применяют и в поликлинике, где широ кое распространение получили инцизионные био псии шейки матки, кожи, пункционные биопсии поверхностно расположенных опухолей, аспираци онные биопсии содержимого полости матки, верх нечелюстных (гайморовых) пазух и некоторых дру гих полостей.
Биопсийный материал может быть получен и для ЭМ изучения. Этот метод наиболее широко ис пользуют в онкологии. Иногда только исследова ние ультраструктуры клеток опухоли позволяет ус тановить её гистогенез.
МИКРОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Микроскопические методы исследования — спо собы изучения различных объектов с помощью мик роскопа. В биологии и медицине этими методами изучают строение микроскопических объектов, раз меры которых лежат за пределами разрешающей спо собности глаза человека. Основу микроскопических методов исследования составляют СМ и ЭМ. СМ имеет несколько разновидностей, каждая из кото рых использует различные свойства света: фазово контрастная, интерференционная, люминесцен тная, поляризационная, стереоскопическая, ультрафиолетовая, инфракрасная. В ЭМ изображе ние объектов исследования возникает в результате направленного потока электронов.
Световая микроскопия
СМ основывается на таких определяющих факто рах, как разрешающая способность микроскопа, направленность светового луча, а также особенно сти изучаемого объекта, который может быть про зрачным и непрозрачным. В зависимости от свойств объекта изменяются физические свойства света — его цвет и яркость, связанные с длиной и амплитудой волны, фаза, плоскость и направление распространения волны. Для СМ биологические объекты обычно окрашивают для выявления тех или иных их свойств. При этом ткани должны быть фиксированы, так как окраска выявляет определён ные структуры только погибших клеток. В живой клетке краситель обособляется в цитоплазме в виде вакуоли и не прокрашивает клеточные структуры. Тем не менее в СМ можно изучать и живые биоло
12 ПАТОЛОГИЯ Глава 1
топлазме в виде вакуоли и не прокрашивает клеточные структуры. Тем не менее в СМ мож но изучать и живые биологические объекты (витальная микроскопия). В этом случае при меняют тёмнопольный конденсор.
Фазово контрастная микроскопия применяется для исследования живых и неокрашенных био логических объектов. Она основана на диф ракции луча света в зависимости от особенно стей объекта изучения, от которых зависит изменение длины и фазы световой волны. В патологии фазово контрастная микроскопия находит применение при исследовании про стейших, клеток растений и животных, при подсчёте и дифференцировке клеток костного мозга и периферической крови, при изучении клеток культуры тканей и др.
Поляризационная микроскопия позволяет изучать биологические объекты в свете, образованном двумя лучами, поляризованными во взаимно перпендикулярных плоскостях, т.е. в поляри зованном свете. Этого достигают с помощью плёнчатых поляроидов или призм Николя, ко торые помещают в микроскопе между источ ником света и препаратом. Поляризация меня ется при прохождении (или отражении) лучей света через различные и оптически разнород ные структуры. В так называемых изотропных структурах скорость распространения поляри зованного света не зависит от плоскости поля ризации, а в анизотропных структурах скорость его распространения меняется в зависимости от направления света по продольной или попереч ной оси объекта. Если показатель преломления света вдоль структуры больше, чем в поперечном направлении, возникает положительное двой ное лучепреломление, при обратных взаимоот ношениях — отрицательное двойное лучепре ломление. Многие биологические объекты имеют строгую молекулярную ориентацию, яв ляются анизотропными и обладают положитель ным двойным лучепреломлением. Такими свой ствами обладают миофибриллы, реснички мерцательного эпителия, коллагеновые волокна и др. Сопоставление характера лучепреломления поляризованного света и величины анизотропии объекта позволяет судить о молекулярной орга низации его структуры. Поляризационная мик роскопия является одним из гистологических, а также цитологических методов исследова ния, способом микробиологической диагнос тики и др. Важно, что в поляризованном све те можно исследовать как окрашенные, так и неокрашенные и нефиксированные (натив ные) срезы тканей.
Люминесцентная микроскопия основана на свойстве многих веществ давать свечение — люминесценцию в УФ лучах или в сине фи олетовой части спектра света. Ряд биологичес ких веществ, таких как простые белки, кофер менты, некоторые витамины, лекарственные средства (ЛС) обладают собственной (первич ной) люминесценцией. Другие вещества начи нают светиться при добавлении к ним специаль ных красителей — флюорохромов (вторичная люминесценция). Флюорохромы могут распре деляться в клетке диффузно, но могут избира тельно окрашивать отдельные клеточные струк туры или определённые химические соединения. На этом основано использование люминесцен тной микроскопии в цитологических и гисто химических исследованиях. Иммунофлюоресцен ция в люминесцентном микроскопе позволяет выявлять различные Аг и их концентрацию в клетках, при этом возможна идентификация вирусов, определение АТ и иммунных комплек сов, гормонов, различных продуктов метаболиз ма и др.
Люминесцентную микроскопию применяют для диагностики вирусных инфекций, с помо щью вторичной люминесценции диагностиру ют злокачественные опухоли в гистологических и цитологических препаратах, определяют оча ги ишемии мышцы сердца при ранних сроках инфаркта миокарда, выявляют амилоид в био птатах тканей и т. д.
Ультрафиолетовая и инфракрасная микроско пия основана на способности поглощения УФ и инфракрасных лучей определённых длин волн некоторыми веществами, входящими в состав живых клеток, микроорганизмов или фиксированных, но не окрашенных тканей, прозрачных в видимом свете. Свойством по глощать УФ лучи обладают высокомолекуляр ные соединения, такие как нуклеиновые кис лоты, белки, ароматические аминокислоты (тирозин, триптофан, метилаланин), пурино вые и пиримидиновые основания и др. С по мощью УФ микроскопии изучают локализа цию и количество таких веществ, а при исследовании живых объектов — их измене ния в процессе жизнедеятельности. Инфра красная микроскопия применяется в медицине преимущественно в нейроморфологии и офтальмологии.
Для специальных целей в патологии исполь зуются и другие микроскопические методы —
интерференционная, аноптральная, стерео скопическая микроскопия и др.
Электроннаямикроскопия
ЭМ применяют для изучения структуры клеток, микроорганизмов и вирусов на субклеточном и макромолекулярном уровнях. Значительную раз решающую способность ЭМ обеспечивает по ток электронов, проходящих в вакууме через электромагнитные поля, создаваемые электро магнитными линзами. При трансмиссионной ЭМ электроны проходят через структуры ис следуемого объекта, а при сканирующей ЭМ они отражаются от этих структур, отклоняясь под разными углами. В результате возникает изображение на люминесцирующем экране микроскопа. При трансмиссионной (просве чивающей) ЭМ получают плоскостное изобра жение внутриклеточных структур, при скани рующей — объёмное. Весьма полезно сочетание ЭМ с другими методами — авторадиографией, гистохимическими, иммунологическими мето дами. Возникает возможность наблюдать тече ние биохимических и иммунологических про цессов в клетке в сочетании с изменениями внутриклеточных структур.
ЭМ требует специальной химической или фи зической фиксации тканей. Для исследования берут в основном биопсийный материал. Мо жет быть использован и секционный матери ал, но в максимально короткие сроки после смерти, обычно исчисляемые минутами. Пос ле фиксации ткани обезвоживают, заливают в эпоксидные смолы, режут стеклянными или алмазными ножами на ультратомах. При этом получают ультратонкие срезы тканей толщи ной 30–50 нм. Их контрастируют, переносят на специальные металлические сетки и затем изучают в ЭМ.
При ультратомировании препарата можно полу чить так называемые полутонкие срезы толщи ной 1,5 мкм, которые после окраски метилено вым синим исследуют в СМ. Это позволяет получить представление о состоянии той ткани, клетки которой будут затем изучены в ЭМ. Ме тод может иметь и самостоятельное значение.
В сканирующем (растровом) ЭМ исследуют по верхность биологических и небиологических объектов, напыляя в вакуумной камере на их поверхность электроноплотные вещества и изу чая эти реплики, повторяющие контуры объек та исследования.
Методы окрашивания
Микроскопические методы используют в ме дицине в сочетании с гистологическими мето
Методы исследования в патологии |
|
13 |
дами исследования клеток и тканей. Для это го, как правило, фиксированные тканевые сре зы должны быть окрашены с целью выявле ния различных клеточных структур. Последние воспринимают красители в зависимости от их физико химических свойств. Поэтому краси тели подразделяют на основные, кислые и ней тральные.
Основные, или базофильные, красители являют ся красящими основаниями или их солями (ге матоксилин, метиленовый синий, толуидино вый синий и др.). В цветовой гамме этих красителей преобладают оттенки синего цве та. Интенсивность окраски (базофилия) зави сит от числа кислотных групп в структурах клетки, способных взаимодействовать с основными красителями. Кислые, или ацидо фильные, красители — красящие кислоты или их соли, окрашивающие клеточные структу ры в различные оттенки красного (эозин, эрит розин, Конго красный, оранж и др.). Ней тральные, красители содержат и базофильные, и ацидофильные вещества (например, смесь Романовского–Гимзы). Такие красители мо гут обладать способностью растворяться в оп ределённых веществах, окрашивая их (судан III, шарлах и др.). Нередко для контрастиро вания структур клеток или тканей использу ют методы, основанные на способности этих тканей удерживать или восстанавливать соли тяжёлых металлов (серебра, золота, осмия, свинца и др.). Эти методы контрастирования называются импрегнацией, они используются как в СМ, так и в ЭМ.
С помощью различных красителей в повседнев ной и научной практике применяют обзорные окраски для составления общего представле ния о состоянии исследуемой ткани (гематок силин и эозин, азур фукселин и др.), а также специальные окраски для выявления особен ностей процессов, протекающих в тканях и клетках. Так, используют окраску суданом III для выявления жировой дистрофии клеток, Конго красным — для определения отложений амилоида, импрегнацию серебром – для ис следования нервной ткани и т.п. Живые и нео крашенные объекты исследуют с помощью специальных микроскопических методов, опи санных выше.
Гистохимические методы
Гистохимические и гистоферментохимические методы позволяют проследить и оценить об мен веществ в тканях и клетках в норме и в

14 ПАТОЛОГИЯ Глава 1
условиях патологии; избирательно оценить метаболизм белков, липидов, углеводов и дру гих метаболитов, локализацию и активность ферментов и гормонов, проанализировать осо бенности окислительно восстановительных процессов, протекающих в клетках и тканях в условиях патологии, при приспособлении и компенсации. Диапазон применения гистохи мических методов в патологии необычайно широк. Для гистохимических исследований используют срезы свежезамороженных тканей, приготовленные в криостате, что позволяет сохранить прижизненную локализацию того или иного химического соединения. Гистохи мические методы часто сочетают с другими методами СМ и ЭМ. Для количественной оцен ки результатов гистохимических реакций при меняют гистофотометрию, цитофотометрию, микрофлюорометрию и др.
Цитологическое исследование мазков, соскобов
и отпечатков
Традиционными методами, используемыми па тологоанатомами для диагностики различных заболеваний, являются цитологическое иссле дование мазков, соскобов и отпечатков тка ни из различных органов и морфологическое изучение замороженных или заключённых в парафин биоптатов органов и тканей. Цито логические исследования позволяют дать пред варительный диагноз в течение 20–30 мин, они широко применяются в поликлинической и хирургической практике. Однако при цитоло гическом исследовании нарушаются взаимо отношения между различными клетками и внеклеточным матриксом. Кроме того, в ци тологическом образце могут отсутствовать от дельные типы клеток. Поэтому цитологичес кие данные часто носят предварительный характер, а окончательный диагноз ставят после морфологического исследования биоптата че рез 4–5 дней. Использование срезов, получен ных из замороженной ткани (криостатных сре зов), позволяет ускорить обработку материала до 1–2 ч, но за счёт ухудшения морфологичес кой картины. В связи с этим исследование биопсийного материала, заключённого в парафин, остаётся основным подходом в патологоанатомической диагностике. Очень информативна иммуноцитохимия. Используя специфические АТ и эффективные системы их визуализации, можно получить данные, опре деляющие выбор терапии заболевания и его прогноз. Особенно эффективно использование этих методик при диагностике опухолей, им
мунных, аутоиммунных и воспалительных про цессов.
Авторадиография
Близка к гистохимическим методам исследова ния авторадиография, основанная на выявле нии в клетках и в субклеточных структурах в СМ или ЭМ локализации радиоактивных изо топов. Метод позволяет визуально оценить ин тенсивность метаболизма в клетках и во внут риклеточных структурах, а также в структурах различных микробных и вирусных возбудите лей болезней. Авторадиография позволяет на блюдать динамику процессов метаболизма, так как α и β частицы используемых изотопов, локализуясь и перемещаясь в определённых структурах, оставляют след на фотоэмульсии, которой покрывают гистологический или ультратонкий срез ткани.
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ МЕТОДЫ
Бурное развитие и прогресс в области имму нологии, генетики, биотехнологии, клеточной и молекулярной биологии привели к дальней шему совершенствованию методического ар сенала патолога. В области цитологии появи лись цитологические центрифуги (цитоспины), позволяющие сконцентрировать клетки из раз личных биологических жидкостей и получить качественный клеточный монослой, пригодный для цитологического и иммуноцитологического исследований в минимальные сроки.
Проточная цитофлюориметрия
Важным достижением в области цитологии явилось использование проточной цитофлюо риметрии (рис. 1 1).
Ðèñ. 1-1. Проточный флюориметр.

Проточный цитофлюориметр — прибор, по зволяющий производить качественный и ко личественный анализы физических и биоло гических параметров клеток, фенотипирование лейкоцитов, ДНК анализ. Прибор автоматичес ки измеряет количество света из флюорохро ма, связанного со специфическими АТ (CD3, CD4, CD8, CD19 и т.д.) или определёнными веществами (например, этидиумом бромида — 4’,6 диамидино 2 фенилиндолом [DAPI]), ок рашивающими ДНК или РНК. Используя раз личные флюорохромы, можно получить мно гопараметровые данные из одного образца. Сигнал из каждой клетки собирается в течение нескольких микросекунд при прохождении клетки через лазерный пучок, обрабатывается компьютером и представляется на дисплее в виде количественных данных. Образцы, содер жащие суспензию или мелкие агрегаты клеток, готовятся в течение 2–3 ч. Наиболее широко проточная цитофлюориметрия стала использо ваться в цитологической практике после раз вития ультразвуковой диагностики и примене ния техники тонкоигольчатой аспирационной биопсии. В отличие от обычной биопсии, тон коигольчатая аспирационная биопсия менее травматична, не требует специальной подго товки больного и стерильных условий. Из по лучаемого аспирационного материала готовят мазок для цитологического исследования и клеточную суспензию для проточной цито флюориметрии. Недостатком тонкоигольчатой аспирационной биопсии является её меньшая информативность и невозможность получения суспензии клеток из солидных тканей для про точной цитофлюориметрии.
Метод двойной или тройной метки
Совершенствование систем визуализации флю оресцентных и ферментных меток позволило использовать несколько помеченных разными метками различных АТ на одном препарате при иммуногистохимическом исследовании. Это метод двойной или тройной метки (рис. 1 2).
Этот методический подход особенно важен при исследовании гетерогенной по составу ткани и позволяет выявить распределение различных популяций клеток при инфильтративном росте опухолей, развитии локального иммунного от вета и т.д. При определённых условиях одна и та же клетка может экспрессировать несколько Аг (коэкспрессия), выявляемых обычно на раз личных клетках. В таких случаях используют флюоресцентный микроскоп, изображение с которого передаётся в компьютер со специаль
Методы исследования в патологии |
|
15 |
|
|
|
|
|
|
Ðèñ. 1-2. Принцип двойной метки на одном срезе. Àã «À»
клетки связывается с первичным АТ, меченным определ¸н-
ной меткой (например, пероксидазой хрена); Аг «Б» этой же
клетки (или соседней на том же срезе) связывается с другим
первичным АТ, меченным другой определ¸нной меткой (например, щелочной фосфатазой). Различное окрашивание
позволяет выявить распределение этих Аг на одном срезе.
ной программой для анализа локализации не скольких флюоресцентных меток. Ещё более эффективно исследование таких препаратов с помощью конфокальной сканирующей лазер ной микроскопии. Монохромный источник освещения (лазер) не даёт оптических искаже ний и позволяет сканировать клетки в срезе или мазке в одной плоскости на различной глубине. Специальная компьютерная программа позво ляет совмещать изображения одних и тех же участков, содержащих клетки с различными флюорохромами, и анализировать распреде ление различных меток на клетках. При совпа дении меток и наложении их друг на друга по является псевдоцветное свечение жёлтого цвета.
Гибридизация in situ
В последнее десятилетие в патологии активно используют гибридизационную иммуногисто химию, или гибридизацию in situ. Эта техника, в отличие от описанных выше, способна про демонстрировать распределение специфичес ких последовательностей ДНК или РНК в индивидуальных клетках на срезах ткани, в мазке, в культуре клеток, хромосомных препа ратах (рис. 1 3).
Гибридизация in situ способна определять 20–50 копий определённых последовательностей ДНК или РНК в одной клетке. Таким обра зом, этот метод позволяет судить о биосинте тической активности отдельных клеток при их прямой визуализации и широко используется в диагностике инфекционных заболеваний и неопластических процессов, включая онкоге ны, гены супрессоры, ростовые факторы и
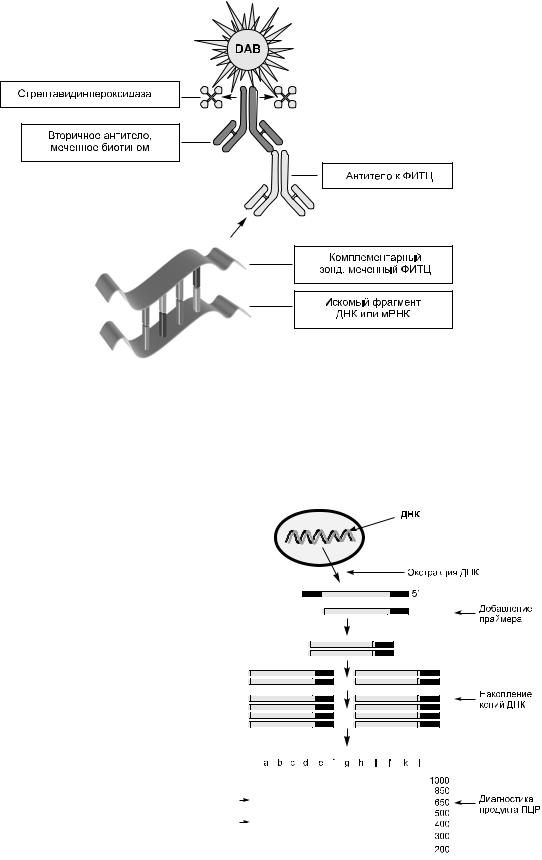
16 ПАТОЛОГИЯ Глава 1
Ðèñ. 1-3. Принцип гибридизации in situ. Специфическая последовательность ДНК или РНК, ответственная за продукцию
определ¸нного биологически активного вещества (рецептор, гормон, цитокин и т.д.), связывается с зондом, несущим харак-
терную для этого вещества комплементарную последовательность. Зонд метят каким-либо веществом (например, флюоресцеин изотиоцианатом — ФИТЦ). Первичные АТ к этому веществу выявляют вторичным АТ, меченным определ¸нной меткой (например, пероксидазой хрена), которая, в свою очередь, выявляется диаминбензидином (DAB).
факторы, регулирующие клеточный цикл. Напри мер, эта техника используется для идентифика ции экспрессии РНК в опухолях эндокринной системы, негативных при иммуногистохимичес кой окраске. Гибридизация in situ является также важным инструментом в мониторинге генной терапии, поскольку позволяет выявлять лока лизацию и распределение терапевтических ге нов, трансфецированных вирусными или плаз мидными векторами в клетки или органы. Недостатком гибридизации in situ является её относительно низкая чувствительность. Этот недостаток с успехом компенсируется исполь зованием полимеразной цепной реакции.
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР) — метод, в основе которого лежит ферментное накопле ние специфических ДНК последовательностей. В ПЦР используются олигонуклеотидные прай меры (короткие ДНК последовательности), ко торые располагаются сбоку от цепи ДНК и тем самым определяют интересующую область в исследуемой ДНК (рис. 1 4).
Процедура включает повторные серии циклов, каждый из которых состоит из шаблонной де Ðèñ. 1-4. Полимеразная цепная реакция.
натурации, отжига праймера и удлинения прай мера термостабильной ДНК полимеразой до создания экспоненциального накопления спе цифического фрагмента ДНК, конец которого определяется 5’ концом праймера. После 20 циклов количество копий возрастает в 106–108 раз. Для ПЦР, помимо ДНК, может быть в качестве стартового материала использована РНК. Эта процедура известна как ПЦР с обратной транскрипцией. При помощи обрат ной транскрипции происходит построение ком плементарной ДНК, которая и определяется ПЦР. ПЦР является чрезвычайно чувствитель ным методом, способным увеличивать 1–2 ко пии генов до уровня, легко определяемого гельэлектрофорезом или блот гибридизацией по Э. Саузерну (англ. название метода — southern blotting). Эта повышенная чувствительность ПЦР часто способна давать ложноположитель ные результаты при контаминации образцов. Современная лабораторная техника максималь но предотвращает подобное загрязнение. Наи более важным правилом ПЦР является раздель ное проведение пре и пост ПЦР этапов. Кроме того, каждая ПЦР включает негативный ПЦР контроль (добавляются все реагенты без проведения денатурации) для мониторинга контаминации реагентов.
В настоящее время ПЦР получила дальней шее развитие в виде ПЦР в реальном времени, способной давать количественную оценку ис следуемых нуклеиновых кислот. При прове дении ПЦР требуется разрушение клеток и тканей для изоляции нуклеиновых кислот и перевода их в жидкую фазу. Следовательно, результаты ПЦР невозможно связать с конк ретным гистологическим типом клетки, оп ределить процент клеток, содержащих иссле дуемую последовательность.
Молекулярная техника, объединившая высо кую чувствительность ПЦР и клеточную лока лизацию последовательностей, выявляемых гибридизацией in situ, получила название ПЦР in situ. Часто эта техника используется для оп ределения вирусных или провирусных после довательностей нуклеиновых кислот. Помимо этого, ПЦР in situ применяют для изучения эндогенных последовательностей ДНК, вклю чая перестроение клеточных генов, хромосом ные транслокации и картирование геномных последовательностей с небольшим числом ко пий в метафазных хромосомах. Однако эта тех ника не находит широкого применения из за лёгкости получения псевдоположительного
Методы исследования в патологии |
|
17 |
результата и необходимости проведения боль шого количества контролей, сложности интер претации полученных результатов и их низкой воспроизводимости.
Микродиссекция
В связи с вышеизложенным был предложен метод микродиссекции, позволяющий выре зать отдельные идентифицированные клетки или группы клеток с последующим их анали зом с помощью обычной ПЦР. Первые шаги в этом направлении были сделаны путём вы резания бритвой или соскобов интересующих участков ткани на срезе под микроскопом. В дальнейшем стали использовать микромани пуляторы, позволяющие точно выделить от дельные скопления клеток. В обоих методах процесс микродиссекции очень долог и во многом зависит от мастерства оператора. В настоящее время для точной и воспроизводи мой микродиссекции всё чаще используют ла зеры. В ряде приборов применён принцип ла зерной микропучковой микродиссекции, когда точно сфокусированным пучком ультрафио летового лазера вырезают клетки или область, защищённую фотопигментом, предотвращаю щим разрушение ДНК в УФ свете. В других приборах используют принцип лазерного за хвата. Этот принцип основан на селективном прилипании выбранных клеток или фрагмен тов ткани к термопластической мембране, ак тивированной пульсами низкоэнергетическо го инфракрасного лазера. Этапы процедуры приведены на рис. 1 5.
Термопластическая мембрана, используемая для переноса выбранных клеток, имеет диа метр около 6 мм и располагается на дне опти чески прозрачной крышки, которая закрывает 0,5 мл микроцентрифужную пробирку с раство ром для экстракции ДНК или РНК. Морфо логия вырезанных клеток хорошо сохраняется и может быть документирована на всех стади ях процедуры. Поскольку микродиссекция с лазерным захватом не разрушает окружающие ткани, 2–3 участка, содержащие разнородные морфологические структуры (нормальные, пограничные и опухолевые клетки), могут быть взяты для анализа с одного препарата. В настоящее время микродиссекция с лазер ным захватом широко используется для ана лиза генетических изменений ДНК, определе ния потери гетерозиготности в инвазивных опухолях, изучения предопухолевых изменений в эпителии различных органов.

18 ПАТОЛОГИЯ Глава 1
Ðèñ. 1-5. Лазерная микродиссекция.
Таким образом, современный патолог обладает возможностью использовать значительный арсе нал методов, начиная с рутинных и заканчивая молекулярно биологическими, для диагности ки цитологического и биопсийного материалов.
Выбор тех или иных методов обусловливается видом материала (мазок, криостатный или па рафиновый срез), особенностями его фиксации, гистоархитектурными особенностями ткани и конечными целями исследования.
