
Диагностика и лечение респираторного дистресс-синдрома (РДС) недоношенных - часть 1
Проект методических рекомендаций Российской ассоциации специалистов перинатальной медицины (РАСПМ)
Байбарина Елена Николаевна, г. Москва, Верещинский Андрей Миронович, г. Нижневартовск, Горелик Константин Давидович, г. С-Петербург, Гребенников Владимир Алексеевич, г. Москва, Дегтярев Дмитрий Николаевич, г. Москва, Иванов Сергей Львович, г. С-Петербург, Ионов Олег Вадимович, г. Москва, Любименко Вячеслав Андреевич, г. С-Петербург, Мостовой Алексей Валерьевич, г. С-Петербург, Мухаметшин Фарид Галимович, г. Екатеринбург, Панкратов Леонид Геннадьевич, г. С-Петербург, Пруткин Марк Евгеньевич, г. Екатеринбург, Романенко Константин Владиславович, г. Челябинск, Фомичев Михаил Владимирович, г. Нижневартовск, Шведов Константин Станиславович, г. Нижневартовск
При участии:
Антонова Альберта Григорьевича (г. Москва), Бабак Ольги Алексеевны (г.Москва), Воронцовой Юлии Николаевны (г.Москва), Романенко Владислава Александровича, (г. Челябинск), Русанова Сергея Юрьевича (г.Екатеринбург)
ВВЕДЕНИЕ
Первые методические рекомендации и протоколы лечения новорождённых с респираторным дистресс синдромом (РДС) были разработаны членами Российской ассоциации специалистов перинатальной медицины более 10 лет назад. Последний раз эти рекомендации пересматривались экспертами РАСПМ в сентябре 2002 г. За прошедшие годы благодаря практическому использованию основных положений методических рекомендаций существенно улучшилось качество респираторной терапии новорождённых детей с РДС, почти в 1,5 раза снизилась летальность при этом заболевании. Вместе с тем, в последнее десятилетие отечественными неонатологами накоплен положительный опыт выхаживания детей с очень низкой и экстремально низкой массой тела, внедрены новые методы профилактики и лечения респираторных расстройств у глубоконедоношенных детей, в том числе CPAP через биназальные канюли и неинвазивная ИВЛ. Всё это потребовало существенной переработки, дополнений и изменений первоначальных рекомендаций по тактике ведения детей с РДС. Представленный ниже проект разработан группой специалистов в области неонатологии и респираторной терапии из разных регионов Российской Федерации - городов Екатеринбурга, Нижневартовска, Москвы, С-Петербурга, Челябинска, работающих как в научных федеральных центрах, так и в муниципальных медицинских учреждениях. В настоящее время разработанный документ имеет статус проекта и распространяется среди членов РАСПМ с целью всестороннего обсуждения. Любые замечания и предложения будут с благодарностью приняты. Утверждение нового протокола ведения новорождённых с РДС, с учётом сделанных замечаний и предложений, планируется провести на 2-м Конгрессе специалистов перинатальной медицины "Новые технологии в перинатологии" 1-2 октября 2007 года в г. Москве. К участию в обсуждении протокола и работе конгресса приглашаются все заинтересованные врачи.
Президент РАСПМ, Академик РАМН, профессор, д.м.н.
Н.Н. Володин
Определение РДС и вопросы терминологии
Синдром дыхательных расстройств или "респираторный дистресс синдром" новорождённого представляет тяжёлое расстройство дыхания у детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта. В соответствии с МКБ-10 (Класс XVI "Отдельные состояния перинатального периода", код P22.0) термин "синдром дыхательных расстройств" (СДР) в настоящее время рассматривается как синоним термина "болезнь гиалиновых мембран" (БГМ). Деление СДР на 2 типа имеет историческое значение и в настоящее время в неонатологии не используется. Согласно МКБ-10, исторически 2-й тип СДР обозначается термином "транзиторное тахипное новорождённых" (код P22.1). В случаях отсутствия дополнительной информации о причине дыхательных расстройств в первые часы жизни может быть использован термин "дыхательное расстройство неуточненное" (код P22.9). Однако на практике его можно применять только в качестве предварительного диагноза. Другие причины дыхательных расстройств у новорождённых, классифицированные в МКБ-10, представлены в таблице 1 (см. приложение). Следует помнить, что в ряде случаев, расстройства дыхания могут быть вторичными и являться клиническими проявлениями врождённых и перинатальных поражений других органов и систем (диафрагмальная грыжа, ВПС, генерализованная инфекция, геморрагический шок и др.). Вместе с тем, в отдельных отечественных руководствах все причины дыхательных нарушений были объединены под общим названием "синдром дыхательных расстройств", что противоречит принципам международной классификации болезней. Во избежание терминологической путаницы, далее в методических рекомендациях РАСПМ для обозначения СДР и БГМ, в качестве синонима этого заболевания, будет использован термин "респираторный дистресс синдром" (РДС).
Эпидемиология.
РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребёнка при рождении. Однако на его частоту сильно влияют методы пренатальной профилактики при угрозе преждевременных родов. У детей, родившихся ранее 30 недель гестации и не получавших пренатальной профилактики стероидными гормонами, его частота составляет около 65%, при наличии пренатальной профилактики - 35%; у детей, родившихся на сроке гестации 30-34 недели без профилактики - 25%, при наличии профилактики - 10%. У недоношенных детей, родившихся на сроке более 34 недель гестации, его частота не зависит от пренатальной профилактики и составляет менее 5%. В 2005 году в России было зарегистрировано 26 800 случаев РДС, т.е. заболеваемость РДС составила около 1,9%.
Этиология.
Заболевание полиэтиологично. Основными причинами развития РДС у новорождённых являются: 1) нарушение синтеза и экскреции сурфактанта альвеолоцитами 2-го типа, связанное с незрелостью легочной ткани; 2) врождённый качественный дефект структуры сурфактанта; Назначение беременной женщине глюкокортикоидов за 2-7 суток до предполагаемых преждевременных родов в период с 24 до 35 недель гестации существенно снижает риск развития РДС (Подробнее см. раздел "Профилактика РДС").
Патогенез.
Ключевым звеном патогенеза РДС является дефицит сурфактанта, возникающий вследствие структурно-функциональной незрелости лёгких. Сурфактант - группа поверхностно-активных веществ липопротеидной природы, препятствующих спадению альвеол на выдохе, способствующих мукоцилиарному клиренсу и участвующих в регуляции микроциркуляции в легких и проницаемости стенок альвеол. Сурфактант обладает бактерицидной активностью против грамположительных микробов и стимулирует макрофагальную реакцию в легких. Сурфактант состоит из фосфолипидов (фосфатидилхолин, фосфатидил-глицерол), нейтральных липидов и белков (протеины А, В, С, D). Сурфактант начинает вырабатываться у плода альвеолоцитами II типа с 20-24 недели внутриутробного развития и образует на поверхности альвеол тонкую плёнку, уменьшающую поверхностное натяжение. Наличие сурфактанта предупреждает спадение альвеол во время выдоха и тем самым способствует поддержанию адекватного газообмена. Эта функция сурфактанта обеспечивается комплексом фосфатидилхолин-протеинов В и С. К другим важным функциям сурфактанта относятся: бактерицидная, иммуномодулирующая и мембраностабилизирующая. При дефиците (или сниженной активности) сурфактанта повышается проницаемость альвеолярно-капиллярных мембран, развивается застой крови в капиллярах, диффузный интерстициальный отек и перерастяжение лимфатических сосудов; происходит спадение альвеол и формирование ателектазов. Вследствие этого уменьшается функциональная остаточная ёмкость, дыхательный объём и жизненная ёмкость легких, увеличивается мёртвое анатомическое пространство и соотношение мёртвого анатомического пространства к легочному объёму. Как следствие, усиливается работа дыхания, возникает внутрилегочное шунтирование крови, нарастает гиповентиляция легких. На фоне прогрессирующей дыхательной недостаточности развиваются нарушения функции сердечно-сосудистой системы: вторичная легочная гипертензия с право-левым шунтом крови через функционирующие фетальные коммуникации, транзиторная дисфункция миокарда правого и/или левого желудочков; венозный застой и/или системная гипотензия.
Патоморфологичекая картина.
При патологоанатомическом исследовании трупа ребёнка, умершего от РДС, лёгкие безвоздушные, тонут в воде. При микроскопии отмечается диффузный ателектаз и некроз клеток альвеолярного эпителия. Многие из расширенных терминальных бронхиол и альвеолярных ходов содержат эозинофильные мембраны на фибринозной основе. Следует отметить, что гиалиновые мембраны редко обнаруживают у новорождённых, умерших от РДС в первые часы жизни.
Диагностика РДС.
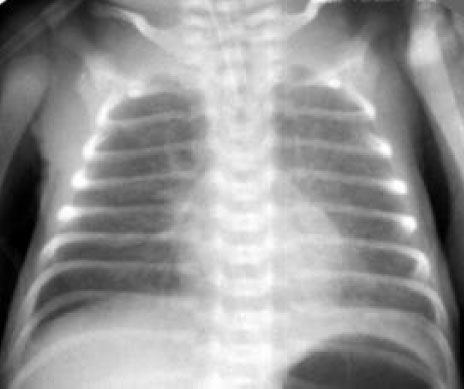
Предрасполагающими факторами развития РДС, которые могут быть выявлены до рождения ребёнка или в первые минуты жизни, являются: 1. Развитие дыхательных расстройств у сибсов. 2. Сахарный диабет у матери (при невынашивании - в 4-6 раз чаще, чем у детей аналогичного гестационного возраста от матерей без диабета); 3. Тяжёлая форма гемолитической болезни плода; 4. Преждевременная отслойка плаценты; 5. Преждевременные роды (наиболее значимо: до завершения 34 недели беременности, при отсутствии антенатальной профилактики РДС); 6. Мужской пол плода при преждевременных родах (РДС у мальчиков встречается в 2 раза чаще, чем у девочек); 7. Рождение ребёнка вторым и последующим при многоплодной беремености; 8. Кесарево сечение до начала родовой деятельности; 9. Асфиксия плода и новорождённого (оценка по Апгар ниже 7 баллов); 10. Гипотермия; 11. Преэклампсия. Все вышеперечисленные факторы позволяют выделить новорождённого ребёнка в группу высокого риска по развитию РДС. К факторам, статистически значимо уменьшающим риск развития РДС, относятся: гипертензионные состояния беременных, серповидно-клеточная анемия у матери, наркотическая зависимость матери, ЗВУР и длительный (более 24 часов) безводный промежуток, наличие у матери хорионамнионита. (Важно отметить, что при этом возрастает риск других перинатальных заболеваний). Ранними признаками РДС являются: • Одышка (более 60 дыханий в минуту), возникающая в первые минуты -первые часы жизни; • Экспираторные шумы ("стонущее дыхание") - обусловлены развитием компенсаторного спазма голосовой щели на выдохе для увеличения функциональной остаточной ёмкости легких, препятствующей спадению альвеол; • Западение грудной клетки на вдохе (втягивание мечевидного отростка грудины, подложечной области, межреберий, надключичных ямок) с одновременным возникновением напряжения крыльев носа, не уменьшающегося после оксигенотерапии, раздувания щек (дыхание "трубача"); • Цианоз при дыхании воздухом; • Ослабление дыхания в легких, крепитирующие хрипы при аускультации; Рентгенологичиские признаки РДС (я подберу ренгенограммы для каждой фазы); • Умеренное снижение пневматизации легких, различимы воздушные бронхограммы, границы сердца чёткие (Рис. 1).
Рисунок 1
Рентгенограмма грудной клетки в прямой проекции в горизонтальном положении

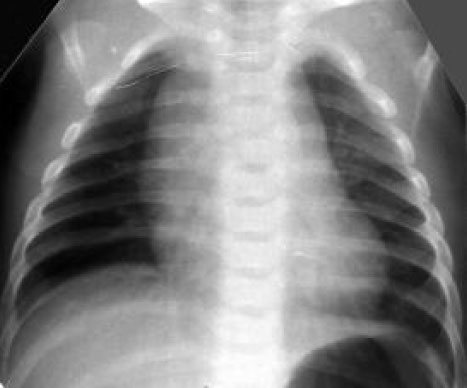
• Снижение пневматизации легких, воздушные бронхограммы, границы сердца на рентгенограмме ещё различимы (Рис. 2). Рисунок 2

РДС. Рентгенограмма в прямой проекции, в горизонтальном положении. Верхние доли легких и средняя доля справа неоднородно слабоинтенсивно затемнены, корни легких расширены, не структурны. Сосудисто-интерстициальный рисунок легких деформирован, усилен, размыт. Тень средостения с нечетким контуром, проекционно смещена влево за счет подворота
• Выраженное снижение пневматизации легких, воздушные бронхограммы, границы сердца практически не различимы, стёрты (Рис. 3).
Рисунок 3

РДС. Рентгенограмма грудной клетки в прямой проекции, в горизонтальном положении. Интенсивное мелкоточечное затемнение легочных полей - с-м "матового стекла", на фоне которого не дифференцируется тень средостения. Визуализируются линейные просветления, обусловленные заполненными воздухом бронхами - "воздушная бронхограмма". • Резкое снижение пневматизации легких, воздушные бронхограммы, границы сердца не различимы, "белые лёгкие" (Рис. 4).
Рисунок 4

РДС. Рентгенограмма грудной клетки в прямой проекции, в горизонтальном положении. Интенсивное мелкоточечное затемнение легочных полей - с-м "матового стекла", на фоне которого не дифференцируется тень средостения. Визуализируются линейные просветления, обусловленные заполненными воздухом бронхами - "воздушная бронхограмма". Дифференциальная диагностика • Транзиторное тахипноэ новорождённых (синдром влажных легких, респираторный дистресс - синдром II типа). Диагноз ставится на основании данных анамнеза (кесарево сечение, астма у матери, избыточное назначение жидкости) и характерной рентгенологической картины (Рис. 5). Заболевание чаще всего протекает доброкачественно и не требует инвазивной респираторной поддержки.
Рисунок 5
Синдром задержки жидкости в легких. Рентгенограмма в прямой проекции, в горизонтальном положении. Сосудисто-интерстициальный рисунок легких размыт на фоне симметричного слабоинтенсивного снижения прозрачности легочных полей. Контуры средостения нечёткие. • Сепсис, врождённая пневмония. Диагноз ставится на основании данных анамнеза (хорионамнионит, лихорадка у матери в родах, положительный тест на носительство стрептококка группы В из отделяемого половых путей матери) и данных лабораторного обследования новорождённого (лейкоцитоз или лейкопения в общем анализе крови, тромбоцитопения, может быть полезным количественное определение С-реактивного белка). При бактериоскопии нативного мазка отделяемого из трахеобронхиального дерева будут определяться лейкоциты и, возможно, бактерии. • Синдром острого легочного повреждения (респираторный дистресс - синдром взрослого типа (Рис. 6)). Всегда осложнение другого заболевания (пневмония, мекониальная аспирация, сепсис, шок, длительное экстракорпоральное кровообращение).
Рисунок 6

РДС взрослого типа. Рентгенограмма в прямой проекции, в горизонтальном положении. Визуализируется слабоинтенсивное затемнение верхней и средней доли правого лёгкого и нижней доли слева. На фоне затемнения дифференцируются более плотные участки, сосудисто-интерстициальный рисунок нечёткий • Идиопатическая легочная гипертензия новорождённых (синдром персистирующего фетального кровообращения) (Рис. 7). Диагноз ставится на основании рентгенологической картины (обеднение сосудистого рисунка, "синдром чёрных легких") и данных эхокардиографии (право - левый шунт или бидиректоральный ток крови по фетальным коммуникациям).
Рисунок 7
Персистирующая легочная гипертензия новорождённого. Рентгенограмма грудной клетки в прямой проекции. Тень средостения расширена в верхнем этаже, имеет чёткие, не ровные контуры • Врождённый порок сердца. Диагноз часто ставится на основании данных пренатальной эхокардиографии. После рождения обращает на себя слабая реакция на кислородотерапию. Шума часто нет. На рентгенограмме грудной клетки может быть обеднение сосудистого рисунка, изменение формы или размеров сердца. Окончательный диагноз может быть поставлен при эхокардиографии. • Полицитемия. Диагноз ставится на основании значений гематокрита в крови, полученной из центральной вены/артерии, если значение "центрального" гематокрита более 70%. • Врождённый альвеолярный протеиноз (врождённый дефицит сурфактантного белка SP-B). Заболевание встречается крайне редко. Характеризуется крайне тяжёлым течением, непродолжительной реакцией на введение экзогенного сурфактанта. Определение степени риска развития РДС в родильном зале строится на анализе акушерских факторов риска и результатах первого врачебного осмотра новорождённого, учитывающего, в том числе, признаки морфо-функциональной незрелости. Правильная оценка факторов риска по развитию РДС позволяет более полно подготовиться и организовать эффективную медицинскую помощь новорождённым высокого риска. В свою очередь, своевременное проведение профилактических и лечебных мероприятий, способствует уменьшению тяжести дыхательных нарушений и снижению частоты осложнений при РДС.
Пренатальная профилактика.
При угрозе преждевременных родов предпочтительнее антенатальное введение бетаметазона. Его использование продемонстрировало более быструю стимуляцию "созревания" в легких плода системы синтеза сурфактанта. Максимальный профилактический эффект при использовании бетаметазона наблюдается на 24 часа раньше, чем при использовании дексаметазона (через 48 часов против 72 часов от начала курсового введения). В отличие от дексаметазона, в многоцентровых исследованиях показана профилактическая эффективность однократного введения бетаметазона (неполный курс) и относительная безопасность при повторных курсах антенатального лечения. Кроме того, антенатальное введение бетаметазона способствует снижению частоты ВЖК и ПВЛ у недоношенных детей с гестационным возрастом более 28 недель, приводя к достоверному уменьшению их перинатальной заболеваемости и смертности.
Рекомендации по антенатальному назначению кортикостероидов.
1. Всем беременным со сроком гестации 24-34 недели при угрозе преждевременных родов назначается один курс кортикостероидов и могут использоваться 2 схемы пренатальной профилактики РДС: Бетаметазон - 12мг В/М через 12 часа, всего 2 дозы на курс Дексаметазон - 6мг В/М через 6 часов, всего 4 дозы на курс 2. Лечение должно ограничиваться одним курсом. Показано, что повторные курсы дексаметазона увеличивают риск развития ПВЛ и тяжёлых нервно-психических нарушений к 2-х летнему возрасту. При возникновении преждевременных родов в сроке 24-34 недели гестации следует предпринять попытку торможения родовой деятельности путём применения токолитиков. При этом преждевременное излитие околоплодных вод не является противопоказанием к торможению родовой деятельности и профилактическому назначению кортикостероидов. Подробно техника острого и хронического токолиза изложена в Методических рекомендациях РАСПМ "Ведение недоношенной беременности, осложнённой преждевременным разрывом плодных оболочек".
Особенности оказания первичной и реанимационной помощи новорождённому из группы высокого риска по развитию РДС в родовом зале.
Весь комплекс медицинских мероприятий, проводимых новорождённому ребёнку в родовом зале, должен быть направлен на создание оптимальных условий адаптации недоношенного ребёнка к условиям внеутробной жизни. Оказание адекватной помощи новорождённому ребёнку в родовом зале, включая интубацию трахеи и лекарственную терапию, должно быть обеспечено любому новорождённому ребёнку в любом лечебно - профилактическом учреждении акушерского профиля, независимо от его лицензионного уровня. В связи с этим, на любых родах должен присутствовать специалист (врач, медицинская сестра, акушерка), обученный методам первичной реанимации в родовом зале. В каждом ЛПУ акушерского профиля должен быть комплект медицинского оборудования и одноразовых материалов, перечисленных в приложении к Приказу Министра здравоохранения и медицинской промышленности РФ № 372 от 28.12.1995 г. С целью повышения эффективности мероприятий, направленных на профилактику и лечение РДС в качестве обязательного оборудования родильных залов и отделений новорождённых следует рекомендовать:
Кислородный смеситель, позволяющий регулировать кислород в диапазоне от 21% до 100% с точностью не менее 5% |
Саморасправляющийся дыхательный мешок с возможностью подключения манометра и установки клапана положительного давления в конце выдоха. |
Клапан для установки положительного давления на выдохе для дыхательного мешка |
Манометр, градуированный от 0 до50 смН2О для измерения давления в дыхательных путях во время проведения ИВЛ Систему СРАР |
Стерильный пакет из термостабильного полиэтилена для предупреждения тепловых потерь у детей с экстремально недоношенным новорождённым в процессе реанимационных мероприятий |
Пульсоксиметр |
Источник медицинского воздуха (компрессор, баллон) |
Шприцевой дозатор |
В качестве дополнительного оборудования родильных залов и отделений новорожденных перинатальных центров, крупных и специализированных акушерских стационаров:
Препараты сурфактанта, пригодного для профилактического введения |
Разводка медицинского воздуха в родовом зале и ПИТН от центрального компрессора |
Транспортный инкубатор для транспортировки новорождённых из родового зала в палату интенсивной терапии, оборудованный аппаратом ИВЛ и системой CPAP |
При рождении ребёнка из группы высокого риска по развитию РДС в родовый зал вызываются наиболее подготовленные сотрудники, владеющие всеми необходимыми манипуляциями, включая интубацию трахеи и лекарственную терапию. Особое внимание следует обратить на готовность оборудования для поддержания оптимального температурного режима. С этой целью в родовом зале могут использоваться источники лучистого тепла или открытые реанимационные системы. В случае рождения ребёнка, гестационный возраст которого менее 28 недель, целесообразно дополнительно использовать стерильный полиэтиленовый пакет с прорезью для головы, который позволит предотвратить избыточные потери тепла при проведении реанимационных мероприятий в родовой комнате. С этой же целью можно обернуть ребёнка бумажной пеленкой на полиэтиленовой основе. 1. Традиционная тактика Объём первичных реанимационных мероприятий определяется ЧСС, временем появления и регулярностью самостоятельного дыхания, цветом кожных покровов. В рамках этой стратегии респираторная поддержка проводится детям со вторичным апноэ и/или нерегулярным самостоятельным дыханием в соответствии с действующим протоколом реанимации новорождённых в родовом зале (приложение 1 к Приказу МЗ РФ №372). Характер и продолжительность респираторной терапии, независимо от гестационного возраста и степени риска развития РДС, определяется по принципу "оценка жизненно важных функций - решение - действие - оценка". При этом искусственная вентиляция легких детей с неэффективным самостоятельным дыханием, осуществляется через лицевую маску или эндотрахеальную трубку 90-100% кислородом. 2. Профилактика вторичных ателектазов легких у глубоконедоношенных детей путём раннего начала биназального CPAP (т.н. "Скандинавская стратегия"). С целью профилактики и лечения РДС всем детям со сроком гестации 7 32 недель, имеющим самостоятельное дыхание, канюли для проведения СРАР устанавливается в родильном зале сразу после рождения и санации ротоглотки. При отсутствии дыхания или при нерегулярном дыхании проводится масочная вентиляция с давлением на вдохе 20 см вод.ст. (может при неэффективности увеличиваться до 30-35см Н2О у детей, с весом более 1500г) и положительным давлением на выдохе - 4-5 см вод. ст. При этом вентиляция проводится с частотой 50-60 в минуту и FiO2 не более 60%, а соотношение вдоха к выдоху 1:2. Длительность эффективной масочной ИВЛ не нормирована. Исключение составляют дети менее 27 недель гестации, у которых при отсутствии самостоятельного дыхания интубация выполняется не позднее третьей минуты жизни. При появлении самостоятельного дыхания, накладываются назальные канюли и устанавливается стартовое давление на выдохе 4-5 см Н2О и FiO2 21-25%. Применение постоянного положительного давления на выдохе даже у глубоко недоношенных пациентов запускает каскад рефлекторных реакций, в подавляющем большинстве случаев стимулирующих регулярное самостоятельное дыхание. В этом случае ребёнок на CPAP переводится в ПИТН для продолжения лечения. При неэффективности масочной ИВЛ в течение 60 сек (снижении ЧСС менее 100 в 1 минуту) показана интубация трахеи и проведение ИВЛ. У пациентов с гестационным возрастом менее 29 недель, при проведении масочной ИВЛ не желательно увеличивать давление на вдохе более 20 см Н2О из-за опасности повреждения незрелой легочной ткани. Новорождённым с гестационным возрастом больше чем 32 недели, применение СРАР в родильном зале показано при выявлении в родовом зале клинических признаков дыхательных расстройств. Также как и при первичной реанимации по поводу асфиксии новорождённых, об эффективности респираторной терапии в родильном зале судят по восстановлению адекватного самостоятельного дыхания, стабилизации частоты сердечных сокращений на уровне более 100 ударов в минуту и появлению/восстановлению розового цвета кожных покровов. В качестве дополнительного критерия эффективности можно использовать динамику оценки по Апгар. Увеличение бальной оценки новорождённого в процессе респираторной терапии свидетельствует об адекватно проводимых реанимационных мероприятиях; сохранение суммарной оценки менее 7 баллов в течение всего периода пребывания в родильном зале (в первые 10-15 минут), напротив, свидетельствует об их недостаточной эффективности. Сразу по окончанию комплекса первичных и/или реанимационных мероприятий дети из группы высокого риска из родильного зала перемещаются на пост интенсивной терапии (в небольших акушерских стационарах - постиндивидуального наблюдения). Во время транспортировки очень важно обеспечить адекватный температурный режим и продолжить респираторную терапию, начатую в родовом зале. К моменту перевода ребёнка, требующего интенсивного наблюдения или интенсивной терапии из родового зала, на посту индивидуального наблюдения или в палате интенсивной терапии новорождённых (ПИТН) должны быть подготовлены к работе: оборудование для респираторной поддержки, инкубатор или источник лучистого тепла, пульсоксиметр или полифункциональный монитор. Сразу после поступления в ПИТН налаживается непрерывное наблюдение за состоянием жизненно важных функций организма ребёнка и продолжается респираторная терапия. Через 20-30 минут от момента поступления (после согревания и стабилизации АД и ЧСС) проводится катетеризация одной из периферических или пупочной вены, начинается инфузионная терапия. Наиболее важным для недоношенных детей из группы высокого риска развития РДС, является профилактика постнатальной гипоксии, поддержание нормального температурного режима, стабильного артериального давления и нормогликемии. В случае нестабильных показателей центральной гемодинамики (низкое среднее АД, выраженная тахи- и брадикардия, положительный симптом бледного пятна) проводится экстренная катетеризация пупочной вены и осуществляется стандартная противошоковая терапия. Дети с клиническими признаками РДС в связи с высокой вероятностью развития бактериальной инфекции, как правило, нуждаются в раннем назначении антибактериальной терапии. При тяжёлом течении РДС у новорождённых детей нередко развивается сердечно-сосудистая и острая почечная недостаточность, могут формироваться тяжёлые гипоксически-ишемические и гипоксически-геморрагические поражения ЦНС, происходят нарушения функции других органов и систем. Принципы поддерживающей терапии, а также этиопатогенетическое лечение сопутствующих перинатальных заболеваний описаны в современных руководствах по неонатологии, детской реаниматологии и интенсивной терапии.
Основные методы респираторной терапии РДС новорождённых.
Диапазон методов поддержания газообмена у детей с дыхательными расстройствами достаточно широк и поэтому требует систематизации. Все методы респираторной терапии можно подразделить на несколько групп и, по мере увеличения их интенсивности, расположить в следующем порядке: 1) Оксигенотерапия - повышение концентрации кислорода во вдыхаемом воздухе, направлена исключительно на устранение гипоксемии и почти не оказывает влияния на параметры вентиляции. Использование данного вида лечения при РДС патогенетически не обоснованно, хотя и может использоваться у почти доношенных детей с нетяжелыми формами РДС. 2) повышенное давление в дыхательных путях широко используется как при спонтанном дыхании (CPAP), так и в процессе ИВЛ (PEEP). В зависимости от используемых устройств положительное давление в дыхательных путях можно поддерживать как в течение всего дыхательного цикла, так и в отдельные его фазы. При любом способе CPAP неизбежно возникают колебания давления, но оно остаётся постоянно выше атмосферного. Действие метода направлено главным образом на стабилизацию легочных объёмов, но в то же время СРАР оказывает существенное влияние на механические свойства легких и вентиляционные показатели. 3) механическая вентиляция легких, которую принято подразделять на традиционную и высокочастотную. К традиционным относят такие методы вентиляции легких, при проведении которых используются параметры (частоты, объёмы) близкие к физиологическим. Высокочастотная вентиляция легких отличается тем, что проводится с частотой, более, чем в 4 раза выше физиологической и дыхательными объёмами, как правило, не превышающими величины мёртвого пространства. В неонатологической практике используется преимущественно метод осцилляторной высокочастотной ИВЛ (ВЧО ИВЛ).
Применение CPAP в терапии РДС новорождённых.
Определение и принцип действия. СРАР - continuous positive airway pressure - постоянное (т.е. непрерывно поддерживаемое) положительное давление в дыхательных путях. Препятствует спадению альвеол и развитию ателектазов. Может быть установлено в качестве положительного давления в конце выдоха при проведении ИВЛ или являться самостоятельным методом респираторной поддержки у новорождённых с сохранённым спонтанным дыханием. Постоянное положительное давление увеличивает функциональную остаточную ёмкость легких (ФОЕ), снижает резистентность дыхательных путей, улучшает растяжимость легочной ткани, способствует стабилизации и синтезу эндогенного сурфактанта. Применение СРАР возможно в медицинских учреждениях любого уровня. Для проведения респираторной поддержки методом СРАР в стационаре требуется следующий набор медицинского оборудования: • Источник медицинского кислорода и воздуха со скоростью потока не менее 4 литров в минуту. • Смесителя для газов (блендера) • Ротаметра (флоуметра) • Увлажнителя для воздушно-кислородной смеси Существует большое количество специального оборудования для проведения СРАР у новорождённых. СРАР может проводиться через: • Интубационную трубку, установленную в трахеи (в настоящее время не рекомендуется) • Мононазальную канюлю (назофарингеальную трубку) • Назальную маску • Биназальные канюли По данным рандомизированных исследований проведение СРАР через биназальные канюли или назальную маску обеспечивает наименьшую работу дыхания у новорождённого. Специализированные системы разделяют на классические полуоткрытые и открытые. В полуоткрытых системах СРАР выдох производится в дыхательный контур, который запирается клапаном выдоха, создающий положительное давление в дыхательных путях. Таким устройством может быть механический клапан или обычный сосуд с водой. В открытых системах выдох производится во внешнюю среду и положительное давление создаётся за счёт противопотока, т.е. выдох совершается против основного потока, поступающего к пациенту. Постоянное положительное давление может генерироваться: • Аппаратом ИВЛ • Водяным замком (Buble CPAP) (Рис. 8) • Генератором вариабельного потока
Рисунок 8
