6.Реальные газы
.doc
6.1.*
Показать, что зависимость сил притяжения
в потенциале Леннарда-Джонса зависит
от расстояния между молекулами как
~![]() .
[]
.
[]
6.2. Какой физический смысл константы Ван-дер-Ваальса? []
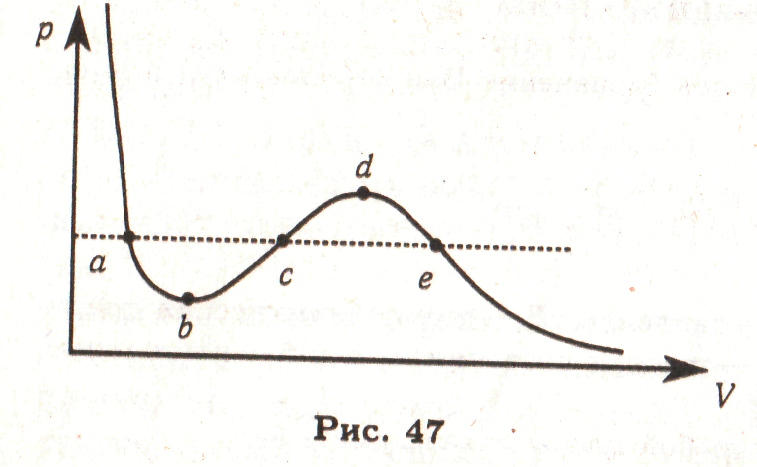
6.3.* (Правило Максвелла). Доказать равенство площадей фигур abc и cde на изотерме Ван-дер-Ваальса (рис. 47). []
6.4. В каких единицах системы СИ выражаются постоянные a и b, входящие в уравнение Ван-дер-Ваальса? []
6.5.
Пользуясь данными о критических величинах
![]() и
и
![]() для некоторых газов
(см. Прил. XIV),
найти для них постоянные а
и b,
входящие в уравнение
Ван-дер-Ваальса. []
для некоторых газов
(см. Прил. XIV),
найти для них постоянные а
и b,
входящие в уравнение
Ван-дер-Ваальса. []
6.6. Какую температуру Т имеет масса т=2 г азота, занимающего объем V=820 см3 при давлении р=0,2 МПа? Газ рассматривать как: а) идеальный; б) реальный. []
6.7. Масса m=10 г гелия занимает объем V=100 см3 при давлении р=100 МПа. Найти температуру Т газа, считая его: а) идеальным; б) реальным. []
6.8. В
закрытом сосуде объемом V=0,5
м3
находится количество
![]() =0,6
кмоль углекислого газа при давлении
р=3
МПа. Пользуясь уравнением Ван-дер-Ваальса,
найти, во сколько раз надо увеличить
температуру газа, чтобы давление
увеличилось вдвое. []
=0,6
кмоль углекислого газа при давлении
р=3
МПа. Пользуясь уравнением Ван-дер-Ваальса,
найти, во сколько раз надо увеличить
температуру газа, чтобы давление
увеличилось вдвое. []
6.9. Количество =1 кмоль кислорода находится при температуре t=27 °С и давлении р=10 МПа. Найти объем V газа, считая, что кислород при данных условиях ведет себя как реальный газ. []
6.10. Найти
эффективный диаметр
![]() молекулы азота двумя
способами: а) по данному значению средней
длины свободного пробега молекул при
нормальных условиях
молекулы азота двумя
способами: а) по данному значению средней
длины свободного пробега молекул при
нормальных условиях
![]() =95
нм; б) по известному значению постоянной
b
в уравнении Ван-дер-Ваальса.
[]
=95
нм; б) по известному значению постоянной
b
в уравнении Ван-дер-Ваальса.
[]
6.11. Найти среднюю длину свободного пробега молекул углекислого газа при нормальных условиях. Эффективный диаметр молекулы вычислить, считая известными для углекислого газа критические значения и . []
6.12. Найти коэффициент диффузии D гелия при температуре t=17 °С и давлении р=150 кПа. Эффективный диаметр атома вычислить, считая известными для гелия критические значения и . []
6.13.
Построить изотермы
![]() для количества
=1
кмоль углекислого газа
при температуре t=0°С.
Газ рассматривать как: а) идеальный; б)
реальный. Значения V
(в л/моль) для реального
газа взять следующие: 0,07, 0,08, 0,10, 0,12, 0,14,
0,16, 0,18, 0,20, 0,25, 0,30, 0,35 и 0,40; для идеального
газа – в интервале 0,2≤V≤0,4
л/моль. []
для количества
=1
кмоль углекислого газа
при температуре t=0°С.
Газ рассматривать как: а) идеальный; б)
реальный. Значения V
(в л/моль) для реального
газа взять следующие: 0,07, 0,08, 0,10, 0,12, 0,14,
0,16, 0,18, 0,20, 0,25, 0,30, 0,35 и 0,40; для идеального
газа – в интервале 0,2≤V≤0,4
л/моль. []
6.14. Найти
давление
![]() ,
обусловленное силами
взаимодействия молекул, заключенных в
количестве
=1
кмоль газа при нормальных условиях.
Критическая температура и критическое
давление этого газа равны
=417
К и
=7,7
МПа. []
,
обусловленное силами
взаимодействия молекул, заключенных в
количестве
=1
кмоль газа при нормальных условиях.
Критическая температура и критическое
давление этого газа равны
=417
К и
=7,7
МПа. []
6.15. Для
водорода силы взаимодействия между
молекулами незначительны; преимущественную
роль играют собственные размеры молекул.
Написать уравнение состояния такого
полуидеального газа.
Какую ошибку мы допустим при нахождении
количества водорода
,
находящегося в некотором
объеме при температуре
![]() =0
°С и давлении р=280
МПа, не учитывая собственного объема
молекул? []
=0
°С и давлении р=280
МПа, не учитывая собственного объема
молекул? []
6.16. В сосуде, объемом V=10 л находится масса т=0,25 кг азота при температуре =27 °С. Какую часть давления газа составляет давление, обусловленное силами взаимодействия молекул? Какую часть объема сосуда составляет собственный объем молекул? []
6.17.
Количество
=0,5
кмоль некоторого газа занимает объем
![]() =1
м3.
При расширении газа до объема
=1
м3.
При расширении газа до объема
![]() =1,2
м3
была совершена работа против сил
взаимодействия молекул А=5,684
кДж. Найти постоянную а,
входящую в уравнение
Ван-дер-Ваальса. []
=1,2
м3
была совершена работа против сил
взаимодействия молекул А=5,684
кДж. Найти постоянную а,
входящую в уравнение
Ван-дер-Ваальса. []
6.18.*
Получить выражение для
работы А,
совершаемой молем
ван-дер-ваальсовского газа при
изотермическом расширении от объема
до объема
.
Температура газа
![]() ,
постоянные Ван-дер-Ваальса
а и
b.
Сравнить с работой
идеального газа. []
,
постоянные Ван-дер-Ваальса
а и
b.
Сравнить с работой
идеального газа. []
6.19.* Моль
кислорода, занимавший объем
=1
л при температуре
=173
К, расширился изотермически до объема
=9,712
л. Найти: а) приращение внутренней энергии
газа
![]() ;
б) работу А,
совершенную газом; в)
количество тепла Q,
полученное газом.
[]
;
б) работу А,
совершенную газом; в)
количество тепла Q,
полученное газом.
[]
6.20.* Получить для ван-дер-ваальсовского газа уравнение адиабаты в переменных V и Т, а также в переменных V и р. Сравнить результаты с аналогичными уравнения для идеального газа. []
6.21. Масса
m=20
кг азота адиабатически расширяется в
вакуум от объема
=1
м3
до объема
=2
м3.
Найти понижение
![]() температуры при этом расширении, считая
известной для азота постоянную а,
входящую в уравнение
Ван-дер-Ваальса (см. ответ 6.5). []
температуры при этом расширении, считая
известной для азота постоянную а,
входящую в уравнение
Ван-дер-Ваальса (см. ответ 6.5). []
6.22. Количество =0,5 кмоль трехатомного газа адиабатически расширяется в вакуум от объема =0,5 м3 до объема =Зм3. Температура газа при этом понижается на =12,2 К. Найти постоянную a, входящую в уравнении Ван-дер-Ваальса. []
6.23. Какое
давление р
надо приложить, чтобы
углекислый газ превратить в жидкую
углекислоту при температурах
![]() =31
°С и
=31
°С и
![]() =50
°С? Какой наибольший объем
=50
°С? Какой наибольший объем
![]() может занимать масса
m=1
кг жидкой углекислоты? Каково наибольшее
давление
может занимать масса
m=1
кг жидкой углекислоты? Каково наибольшее
давление
![]() насыщенного пара жидкой углекислоты?
[]
насыщенного пара жидкой углекислоты?
[]
6.24. Найти плотность водяного пара в критическом состоянии, считая известной для него постоянную b, входящую в уравнение Ван-дер-Ваальса (см. ответ 6.5). []
6.25. Найти плотность гелия в критическом состоянии, считая известными для гелия критические значения и . []
6.26. Количество v=1 кмоль гелия занимает объем V=0,237м3 при температуре t=–200 °С. Найти давление р газа, пользуясь уравнением Ван-дер-Ваальса в приведенных величинах. []
6.27. Во сколько раз давление газа больше его критического давления, если известно, что его объем и температура вдвое больше критических значений этих величин? []
6.28.*
Определить для
ван-дер-ваальсовского газа разность
молярных теплоемкостей
![]() .
Сравнить с соотношением
Майера. []
.
Сравнить с соотношением
Майера. []
6.29.* Построить графики зависимостей внутренней энергии U моля ван-дер-ваальсовского газа от: а) температуры Т при V=const; б) объема V при Т=const. Сравнить эти кривые с аналогичными для идеального газа. []
6.30.* Найти выражение для энтропии моля ван-дер-ваальсовского газа (как функцию от Т и V). Сравнить с выражением для энтропии идеального газа. []