
Методы мол-ген иссл
.pdf21
В зависимости от ГЦ-состава и размера праймеры имеют определенную температуру плавления (Тm – температура, при которой половина ДНК-матриц образует комплекс с олигонуклеотидным праймером в присутствии фермента – полимеразы). При соблюдении оптимальных условий (температура отжига праймеров близка по значениям к температуре плавления) праймер образует стабильную комплементарную связь с матрицей. Если же температура реакционной смеси ниже Тm, то возможен неспецифический отжиг праймера на матрицу, образование димеров. Если в данный момент активный фермент в реакционной смеси отсутствует, то элонгация образовавшегося неспецифического комплекса не происходит, что позволяет избежать ложноположительных результатов ПЦР.
2.ПЦР с обратной транскрипцией (ОТ-ПЦР, RT-PCR) используется для идентификации известной последовательности РНК. Суть реакции – синтез двухцепочечной ДНК на матрице одноцепочечной РНК. Для этого одноцепочечную молекулу РНК превращают в реакции обратной транскрипции (ОТ, англ. RT, reverse transcription) в комплементарную ДНК (кДНК) и далее амплифицируют уже ДНК-матрицу, используя традиционную ПЦР.
3.Мультиплексная (мультипраймерная) ПЦР – одновременная ампли-
фикация двух и более искомых последовательностей ДНК в одной пробирке. Каждая пара праймеров для мультиплексной ПЦР должна обладать строгой специфичностью по отношению к соответствующей искомой мишени, а условия циклирования должны обеспечивать равноэффективный отжиг всех участвующих в реакции пар праймеров, чтобы выход амплифицируемых продуктов был по возможности одинаковым.
Преимуществом данного метода является возможность проведения скрининговых исследований с минимальными затратами на расходные материалы. Кроме того, из одного образца можно получить максимум информации в рамках одной постановки ПЦР. Тем не менее мультиплексная ПЦР существенно ограничивает возможности при идентификации низкокопийных образцов: если набор реагентов позволяет выявить четыре искомые мишени + внутренний контроль и все четыре мишени присутствуют в исследуемом образце, то в случае преобладающего количества ДНК одной или двух мишеней основной объем компонентов РС будет расходоваться именно на них (конкуренция за компоненты РС). В случае сомнительных результатов мультиплексной ПЦР рекомендуется провести анализ образца с использованием наборов реагентов, предназначенных для выявления одной конкретной мишени. Важно, чтобы мультиплексный и моноплексные наборы реагентов, используемые для проверки сомнительных результатов, были одного производителя.
4.Гнездовая (вложенная, англ. nested PCR) ПЦР применяется для уменьшения числа побочных продуктов реакции. Используют две пары
22
праймеров и проводят две последовательные реакции. Вторая пара праймеров амплифицирует участок ДНК внутри продукта первой реакции.
5.ПЦР инвертированная используется в том случае, если известен лишь небольшой участок внутри нужной последовательности. Этот метод полезен, когда нужно определить соседние последовательности после вставки ДНК в геном. Для этого проводят ряд разрезаний ДНК рестриктазами с последующим соединением фрагментов.
6.Асимметричная ПЦР проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной ДНК. Используется в некоторых методиках секвенирования и гибридизационного анализа. Сама ПЦР проводится как обычно, за исключением того, что один из праймеров берется в большом избытке.
7.Метод молекулярных колоний. Данная модификация основана на использовании акриламидного геля, который до начала ПЦР полимеризуют со всеми 21 ее компонентами на поверхности. В процессе реакции в точках, содержащих анализируемую ДНК, происходит амплификация с образованием молекулярных колоний.
8.ПЦР длинных фрагментов (англ. long-range, PCR) – вариант ПЦР для амплификации протяженных участков ДНК (10 тысяч и более оснований). Для реализации данного подхода используют смесь двух полимераз: Taq-полимеразы, которая характеризуется высокой процессивностью и способна за один проход синтезировать длинную цепь ДНК; Pfuполимеразы, которая обладает с 3' 5'- экзонуклеазной активностью и необходима для удаления некомплементарных нуклеотидов.
9.Групп-специфическая ПЦР (англ. group-specific PCR) – ПЦР с исполь-
зованием консервативных праймеров к последовательностям ДНК для родственных групп внутри одного или между разными видами. В основе метода – подбор универсальных праймеров, например, к рибосомальным генам 18S и 26S для амплификации видоспецифического межгенного спейсера.
10.ПЦР с быстрой амплификацией концов кДНК (RACE-PCR).
23
4. ДЕТЕКЦИЯ РЕЗУЛЬТАТОВ ПЦР
Существует несколько основных способов детекции результатов ПЦР:
АМПЛИФИКАЦИЯ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
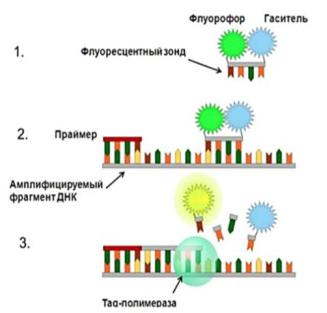
Основные этапы ПЦР «в реальном времени» (рис. 2):
1.В состав реакционной смеси наряду с праймерами и остальными компонентами реакции добавлены специальные флуоресцентные метки (зонды). Флуоресцентный зонд представляет собой олигонуклеотид, комплементарный внутренней последовательности амплифицируемого фрагмента ДНК возбудителя. На 3’-конце зонда находится флуоресцентная молекула
– флуорофор, а на 5’-конце расположена молекула-«гаситель» флуоресценции. За счет близости флуорофора и «гасителя» вся энергия, поглощенная флуорофором, переходит на «гаситель» по принципу флуорес- центно-резонансного переноса энергии. При этом сигнал флуоресценции отсутствует.
2.В ходе ПЦР при повышении температуры происходит денатурация ДНК возбудителя, и зонд наряду с праймерами гибридизуется с комплементарным участком ДНК.
3.В процессе синтеза новой цепи ДНК, фермент ДНК-полимераза расщепляет этот зонд. При расщеплении зонда флуорофор отделяется от «гасителя», расстояние между ними увеличивается, процесс тушения флуоресценции становится невозможным. В этот момент можно зарегистрировать флуоресцентный сигнал от флуорофора.
Рис. 2. Основные этапы ПЦР «в реальном времени».
В результате такого принципа неспецифическая амплификация не обнаруживается.

24
ПЦР «в реальном времени» имеет ряд значительных преимуществ:
1)Объединение этапов амплификации и детекции результатов. Появляется возможность оценить кинетику процесса, которая зависит от начального количества исследуемого материала
2)Существенное снижение риска контаминации и ошибок при анализе результатов
3)Высокая специфичность реакции за счет использования высокоспецифичных флуоресцентных зондов.
4)Высокая производительность
5)Упрощение требований к организации ПЦР-лаборатории
6)Возможность количественной оценки исходной ДНК матрицы
Регистрация и учет данных в электронном формате ПЦР «в реальном времени» характеризуется возможностью проведения качественного и количественного анализа.
Регистрируемое в процессе амплификации нарастание сигнала от отделенного флуорофора прямо пропорционально увеличению концентрации синтезированных специфических продуктов и отражает концентрацию ДНК в исходной матрице.
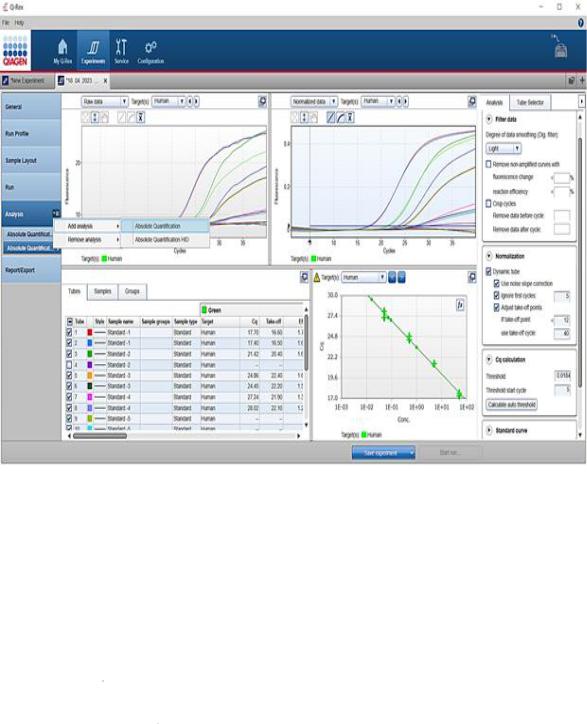
Программное обеспечение приборов позволяет сопоставлять кинетику реакции в исследуемых и стандартных образцах и вычислять концентрацию исходной матрицы ДНК (в присутствии стандартных образцов с известной концентрацией анализируемой ДНК) (рис. 3). При выявлении ДНК возбудителей инфекционных заболеваний целесообразно использовать данный метод в количественной оценке только тех инфекционных агентов, количественное содержание которых в анализируемом образце действительно имеет клиническую значимость. Определение количественных характеристик инфекции позволяет судить о динамике и стадии заболевания, а также об эффективности проводимой терапии.
Принципиальной особенностью полимеразной цепной реакции в реальном времени является возможность детекции накопления продуктов амплификации непосредственно во время проведения амплификации. Так как кинетика накопления ампликонов напрямую зависит от числа копий исследуемой матрицы, это позволяет проводить количественные измерения ДНК и РНК инфекционных агентов. В отличие от других методов количественного определения ДНК матрицы в пробе, ПЦР в реальном времени не требует дополнительных манипуляций, связанных с раститровкой ДНК исследуемой пробы или полученных в ходе ПЦР ампликонов, которые усложняют постановку анализа и могут приводить к появлению ложноположительных результатов, Подобный подход позволяет отказаться от стадии электрофореза, что ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации, а также позволяет снизить требования, предъявляемые к ПЦР лаборатории.
25
Рис. 3. Анализ данных ПЦР программного обеспечения Q-REX на ам-
плификаторе Rotor Gene Q5 plex HRM (Qiagen).
Для анализа в режиме «реального времени» используют специальные ДНК-амплификаторы с оптическим блоком, позволяющие детектировать флуоресценцию внутри реакционной пробирки в ходе реакции.
Сигнал флуоресценции в ходе ПЦР возрастает пропорционально количеству продукта амплификации. Мониторинг сигнала позволяет построить кинетическую кривую реакции, при этом, момент заметного увеличения сигнала и отрыва его от фонового - так называемый пороговый цикл — зависит от исходного количества ДНК-мишени. Чем больше количество ДНК в образце, тем раньше наблюдается начало роста сигнала флуоресценции и тем меньше пороговый цикл. Главным преимуществом детекции результатов ПЦР в режиме реального времени является возможность проведения количественного анализа. При количественном исследовании образцов каждая серия экспериментов сопровождается постановкой амплификации с контрольными образцами, в которых заведомо известно количество копий ДНК (калибровочные образцы). Сравнение кинетики накопления продуктов амплификации в экспериментальных и контрольных образцах позволяет оценить концентрацию ДНК в диапазоне разведений контрольных препаратов ДНК.
26
Для выполнения количественного ПЦР-анализа рекомендуется использование препаратов ДНК с высокой степенью очистки, так как присутствие нежелательных примесей (ингибиторов) снижает эффективность амплификации исследуемой и контрольной ДНК.
При амплификации в реальном времени важен анализ кривых плавления, когда после окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается. При использовании кривых плавления в системах с ДНК-зондами возможно различать точечные мутации, расположенные внутри областей связывания ДНК-матрицы и зонда.
Наличие таких мутаций способно привести к изменению температуры плавления зонда и изменениям в графике кривой плавления. Использование кривых плавления не требует от оператора амплификатора никаких дополнительных манипуляций с пробирками, а интерпретация полученных данных автоматизирована и формализована.
Анализ вариантов полиморфизмов аллелей генов в образцах ДНК осуществлялся путем проведения ПЦР синтеза ДНК. Исследование выполняется на амплификаторе Rotor Gene Q5 plex HRM (Qiagen) в режиме Real time с ис-
поль зованием полимеразы Thermus aquaticus (Taq-полимераза), производства фирмы «СибЭнзим», олигонуклеотидных праймеров и зондов, синтезированных фирмой «Синтол» с дальнейшим проведением ПЦР и анализом полученных генотипов при помощи метода дискриминации аллелей.
При анализе графика распределения представляются данные по обоим каналам в виде точек, соответствующих образцам, координаты которых по соответствующим осям отражают сигнал об амплификации, регистрируемый по соответствующему каналу. Пользователь может изменять границы областей на графике, которые отвечают различным генотипам Дикий тип, Гетерозигота, Мутант. Для этого нужно кликнуть по нужной области и протащить мышь для выделения желаемой области. В окне диаграммы распределения пространство нормализовано с учетом различной степени нарастания сигнала по каждому из каналов и проведено в логарифмический масштаб, чтобы усилить различия между образцами разных генотипов.
Детекция синтеза ДНК проводится методом дискриминации аллелей. Представленный график разделен вертикальной и горизонтальной линиями на четыре зоны, две из которых соответствуют для одного из гомозиготных гено типов, одна - для гетерозигот и одна зона без реакции - контрольный образец. Если образец определяется выше горизонтальной, но правее вертикальной линии — генотип гетерозиготен (GC); если образец выше горизонтальной, но левее вертикальной линии — генотип гомозиготен по аллелю G (по оси Y); если образец ниже горизонтальной, но правее вертикальной — генотип гомозиготен по аллелю С (по оси X); если же образец зафиксирован ниже горизонтальной, но левее вертикальной — определение генотипа не
27
представляется возможным, в данном случае его рассматриваем как отрицательный контроль.
МЕТОД ГОРИЗОНТАЛЬНОГО ЭЛЕКТРОФОРЕЗА
Для визуализации результатов амплификации используют различные методы. Наиболее распространенным на сегодняшний день является метод электрофореза, основанный на разделении молекул ДНК по размеру. Для этого готовят пластину агарозного геля, представляющего собой застывшую после расплавления в электрофорезном буфере агарозу в концентрации 1,5- 2,5% с добавлением специального красителя ДНК, - например, бромистого этидия. Застывшая агароза образует пространственную решетку. При заливке с помощью гребенок в геле формируют специальные лунки, в которые в дальнейшем вносят продукты амплификации. Пластину геля помещают в аппарат для горизонтального гель-электрофореза и подключают источник постоянного напряжения. Отрицательно заряженная ДНК начинает двигаться в геле от минуса к плюсу. При этом более короткие молекулы ДНК движутся быстрее, чем длинные. На скорость движения ДНК в геле влияет концентрация агарозы, напряженность электрического поля, температура, состав электрофорезного буфера и, в меньшей степени, ГЦ-состав ДНК.
Все молекулы одного размера движутся с одинаковой скоростью. Краситель встраивается (интеркалирует) плоскостными группами в молекулы ДНК. После окончания электрофореза, продолжающегося от 10 мин до 1 часа, гель помещают на фильтр трансиллюминатора, излучающего свет в ультрафиолетовом диапазоне (254, 310 нм). Энергия ультрафиолета, поглощаемая ДНК в области 260 нм, передается на краситель, заставляя его флуоресцировать в оранжево-красной области видимого спектра (590 нм).
МЕТОД ВЕРТИКАЛЬНОГО ЭЛЕКТРОФОРЕЗА
Метод вертикального электрофореза принципиально схож с горизонтальным электрофорезом, но для приготовления геля используют полиакриламид. Его проводят в специальной камере для вертикального электрофореза. Электрофорез в полиакриламидном геле имеет большую разрешающую способность по сравнению с агарозным электрофорезом и позволяет различать молекулы ДНК разных размеров с точностью до одного нуклеотида. Приготовление полиакриламидного геля несколько сложнее агарозного. Кроме того, акриламид является токсичным веществом. Поскольку необходимость определить размер продукта амплификации с точностью до 1 нуклеотида возникает редко, то в рутинной работе этот метод не используют.
Анализ конформационного полиморфизма одноцепочечной ДНК (SSCP
– single strand conformation polymorphism). SSCP-анализ – наиболее часто ис-
пользуемый метод для выявления точковых замен внутри фрагмента ДНК (как правило размером от 50 до 300 п.н.), полученного в результате ПЦР. Этот метод основан на регистрации различий электрофоретической подвижности одноцепочечной ДНК исследуемого и контрольного образцов одина-
28
ковых по длине, но различающихся по нуклеотидному составу. Различие в нуклеотидной последовательности обуславливает разницу вторичной конформации одноцепочечных фрагментов, образующихся при денатурации (химической или температурной). Именно от вторичной конформации зависит электрофоретическая подвижность молекул ДНК в полиакриламидном геле. На процесс конформации также влияют различные внешние факторы - температура, концентрация акриламида и глицерина в геле, ионная сила буферных растворов. После обнаружения фрагмента с измененной электрофоретической подвижностью, как правило проводится секвенирование первичной последовательности ДНК мутантного фрагмента для определения конкретной нуклеотидной замены.
Рис. 4. Детекция электрофореза НК в полиакриламидном геле.
Гетеродуплексный анализ (HA – heteroduplex analysis). Метод НА поз-
воляет идентифицировать мутации, находящиеся в компаунде (мутации в гомологичных генах различные по молекулярной природе и внутригенной локализации) или в гетерозиготном состоянии. Метод основан на выявлении различий электрофоретической подвижности гомодуплексов и гетеродуплексов, полученных при ПЦР. При амплификации небольших фрагментов генов гетерозигот и гомозиготных компаундов образуются три типа молекул ДНК: два типа гомодуплексов – из двух нормальных и из двух мутантных аллелей, и молекулы, несущие мутацию лишь в одной из цепей (гетеродуплексы). Отличие электрофоретической подвижности гетеродуплексных молекул ДНК от обоих типов гомодуплексов обусловленно конформационными особенностями вследствии наличия мест несовпадения нуклеотидов.
Денатурирующий градиентный гель-электрофорез (DGGE – denaturation gradient gel electrophoresis). Метод DGGE основан на различиях в усло-
виях и характере денатурации нормальных и мутантных двухцепочечных фрагментов ДНК, выявляемых путем сравнения их электрофоретической подвижности в полиакриламидном геле с линейно возрастающим градиентом
29
концентрации денатурирующих агентов (мочевина и формальдегида). Скорость денатурации зависит от соотношения А-Т/G-C пар в исследуемых фрагментах (G-C связь более устойчива). К достоинствам этого метода, отличающим его от SSCP и HA, следует отнести возможность его использования для анализа крупных амплифицированных фрагментов ДНК (до 600 п.н.) и высокую чувствительность (позволяет улавливать точковые мутации, возникающие даже в одной из 100 обработанных мутагеном клеток)
СЕКВЕНИРОВАНИЕ
Секвенирование – определение нуклеотидной последовательности фрагмента ДНК путем получения серии комплементарных молекул ДНК, различающихся по длине на одно основание. Существует два основных метода секвенирования: метод Максама-Гилберта (основан на химическом расщеплении ДНК по одному основанию) и метод Сангера (дидезоксиметод).
Метод Сангера надежен и прост в исполнении и на практике его использую чаще на автоматических генетических анализаторах или секвенаторах. В настоящее время широкое распространение получила методология автоматического ДНК-сиквенирования с использованием меченных различными флуорохромами дидезоксинуклеотидов – электрофорез в этом случае проходит на одной дорожке и на электрофореграмме каждому из нуклеотидов соответствует свой цвет полосы, которую сканируют в луче лазера, занося данные в компьютер, который сопоставляет их и идентифицирует, выводя на экран нуклеотидную последовательность. Этот метод широко применялся в ходе реализации программы «Геном человека».
Пиросеквенирование «секвенирование путем синтеза». Основной смысл этого типа секвенирования заключается в последовательном синтезе ДНК на ДНК-фрагментах изучаемого организма в специальных пиколитровых «реакторах». В ходе синтеза дочерней цепочки ДНК детектируют пирофосфаты, высвобождающиеся при включении нуклеотида в синтезируемую на матрице (участке молекулы ДНК, служащим матрицей для синтеза) комплементарную цепь.
Секвенирование «нового поколения» - next-generation sequencing (NGS). За последние полтора десятилетия были разработаны, коммерциализированы и продолжают успешно развиваться совершенно новые технологии определения последовательности НК, в основе которых лежит стремление к миниатюризации, автоматизации, увеличению объема получаемых данных, а также удешевлению процесса. Появление NGS впервые позволило значительно ускорить и удешевить определение полной последовательности миллионов геномов организмов, начиная от бактерий и заканчивая человеком. Более того, появилась реальная возможность единовременно оценивать экспрессию (работу) тысяч генов в организмах, тканях и единичных клетках (се-
30
квенирование транскриптомов), а также анализировать регуляцию их активности (анализ экспрессии микроРНК и метилирования генома).
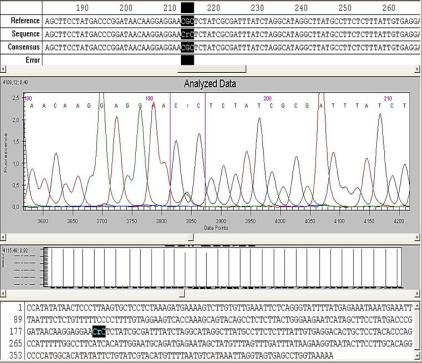
Рис. 5. Секвенирование экзона гена CFTR
В настоящее время на рынке представлено сразу несколько разработок, позволяющих определять последовательность полных геномов организмов, проводить анализ экспрессии генов и метилирования генома. Эти подходы реализуются на секвенаторах нового поколения производства коммерческих компаний Illumina, Thermo Fisher Scientific, Pacific Biosciences и Oxford Nanopore Technologies.
Появление высокопроизводительных технологий секвенирования сопровождается прогрессом программного обеспечения — создаются алгоритмы с открытым программным кодом, появляются открытые источники дан-
ных |
и платформы |
для |
вычислений. |
Новые |
математические |
|
и информационные технологии |
позволяют |
геномике развиваться быстрее |
||||
и использовать более сложные алгоритмы. |
Эти алгоритмы могут включать |
|||||
в себя |
сразу несколько |
приложений и программ и позволяют работать |
||||
с очень большим объемом данных (биоинформатика).
Суть метода заключается в следующем - к обоим концам предварительно фрагментированной ДНК лигируют адаптеры, необходимые для ПЦР и последующего секвенирования на молекулярных кластерах. Полученные ДНК-библиотеки иммобилизуют на поверхности проточной ячейки, где и проводят циклический процесс секвенирования. Реакционная смесь для синтеза комплементарной ДНК подается на поверхность проточной ячейки и содержит ферменты, олигонуклеотиды, а также четыре типа флуоресцентно меченых дезоксинуклеозидтрифосфатов. После включения в синтезируемую
