
- •Электрохимическое осаждение металлов и полупроводников
- •Электрохимическое осаждение (electrochemical deposition, electroplating)
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое осаждение
- •Электрохимическое
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
- •Электрохимическое оксидирование
Электрохимическое осаждение металлов и полупроводников
Электрохимическое осаждение (electrochemical deposition, electroplating)
Электрохимическое осаждение состоит в нанесении материала на токопроводящую поверхность подложки за счет пропускания тока через контактирующую с ней жидкую среду, содержащую химические элементы осаждаемого материала. Оно позволяет формировать как однородные по составу, так и многокомпонентные аморфные и наноструктурированные покрытия из металлов, их сплавов и полупроводников с хорошей адгезией к подложке.
Электрохимическое осаждение
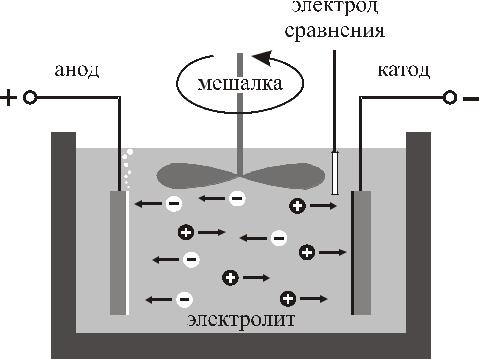
Электролитическая ячейка
Три электрода помещаются в ванну, заполненную жидкой электропроводящей
средой – электролитом. Один электрод (катод) – подложка, на которую производится осаждение материала.
На нее подается отрицательное по полярности напряжение по отношению к другому электроду – аноду. Контролируемое пропускание тока по цепи анод- электролит-катод и обеспечивает электрохимическое осаждение материала.
Электрохимическое осаждение
Электролитическая ячейка
Анод может быть двух типов: жертвенный анод (расходуемый анод) или инертный анод (нерасходуемый анод). Расходуемые аноды изготавливаются из материала, который необходимо осадить на катоде. Нерасходуемые аноды предназначены только для замыкания электрической цепи. В качестве материала инертных анодов используют платину или углерод (графит). Третий электрод – электрод сравнения (ртутный, каломельный и хлорсеребряный электроды), служит для контроля потенциала катода во время процесса осаждения. Т.к. их собственные потенциалы отличаются друг от друга, за точку отсчета принимается потенциал стандартного водородного электрода, который принимается равным нулю. Потенциалы указанных выше электродов сравнения относительно водородного электрода, представляющие собой справочные данные, учитываются в реальных измерениях.
Электрохимическое осаждение
Потенциал электрода, измеренный относительно стандартного водородного электрода называют
стандартным электродным потенциалом (standard electrode potential). Если расположить все металлы в ряд по мере возрастания величины стандартного электродного потенциала получается так называемый ряд напряжений металлов, который характеризует их способность отдавать и принимать электроны в электрохимических процессах.
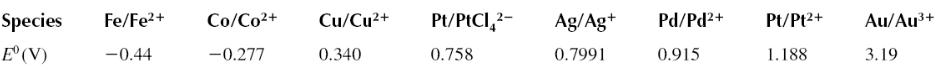
Электрохимическое осаждение
Ряд напряжений металлов
2H+/H2 → 0,000 В
Все металлы, расположенные в электрохимическом ряду напряжений до водорода, то есть имеющие электродный потенциал меньше, чем у водорода, в стандартных условиях могут быть окислены ионами Н+. По этой причине эти металлы могут вытеснять водород из воды или растворов кислот. Металлы, расположенные после водорода, то есть имеющие электродный потенциал больше, чем у водорода, не вытесняют водород из растворов кислот.
Электрохимическое осаждение
Типичный электролит представляет собой проводник, в котором электрический заряд переносится ионами (проводник второго рода). В электролитической ячейке электролит замыкает внутреннюю электрическую цепь между анодом и катодом. При протекании электрического тока через электролит положительно заряженные ионы – катионы, а это обычно ионы металлов, перемещаются к катоду, а отрицательно заряженные – анионы, к аноду. Когда катионы достигают катода, поступающие к нему из внешней цепи электроны нейтрализуют положительный заряд катионов, приводя к осаждению металла на катоде.
Электрохимическое осаждение
Законы Фарадея
Количественно электрохимическое осаждение материалов описывается закономерностями, открытыми М. Фарадеем.
Первый закон Фарадея: при электрохимическом осаждении количество вещества, участвующего в химических превращениях, пропорционально количеству электричества, проходящему через электролит.
Второй закон Фарадея: массы различных веществ, выделяемых или растворяемых одним и тем же количеством электричества, пропорциональны их электрохимическим эквивалентам (или химическим эквивалентным массам).
Количество электричества, соответствующее превращению одного химического эквивалента вещества, получило название числа или постоянной Фарадея, F.

Электрохимическое осаждение
Законы Фарадея
Толщина d металла, осажденного в идеальных условиях, то есть без побочных реакций, приводящих к отклонениям от законов Фарадея, может быть оценена из выражения
d M J (t)dt nF
где M – атомный вес, а – объемная плотность металла; n
– количество электронов, принимающих участие в единичном акте восстановления; J(t) – плотность электрического тока, при которой осуществлялось катодное осаждение.
Электрохимическое осаждение
Эффективность по току (current efficiency, current yield) – это доля количества носителей заряда, прошедших через электролит и израсходованная на осаждение металла. Она определяется как отношение количества реально осажденного на катоде (или растворенного на аноде) металла к количеству металла, которое могло бы быть (согласно законам Фарадея). Величина данного показателя отличная от 100 % свидетельствует о протекании в электролите и на электродах побочных реакций. Основными параметрами электрохимического осаждения, определяющими структуру и свойства катодных покрытий, являются состав и температура электролита, плотность пропускаемого электрического тока и продолжительность процесса осаждения, условия перемешивания электролита. На качество осаждаемых покрытий влияет поверхность катода и свойства электролита.
