
Биохимический анализ крови, ферменты крови. Амилаза, липаза, АЛТ, АСТ, лактатдегидрогеназа, щелочная фосфатаза - повышение, снижение показателей. Причины нарушений, расшифровка анализа.
Печать
Содержание статьи:
-
Амилаза крови
-
Норма амилазы крови
-
Повышение амилазы крови
-
Снижение амилазы крови и мочи
-
Как сдать анализ на амилазу?
-
Липаза
-
Норма липазы крови
-
Когда липаза крови повышена?
-
Когда уровень липазы крови понижен?
-
Как подготовится к анализу на липазу?
-
-
Лактатдегидрогеназа (ЛДГ)
-
Норма лактатдегидрогеназы (ЛДГ) крови
-
Причины повышенной ЛДГ крови
-
Как сдать анализ на ЛДГ?
-
-
Аланинаминотрансфераза (АЛТ, АлАТ)
-
Норма Аланинаминотрансферазы (АЛТ / АлАТ) крови
-
Причины высокого АлАТ (АлАТ)
-
Как сдать анализ на АЛТ (АлАТ)?
-
-
Аспартатаминотрансфераза (АСТ, АсАТ)
-
Норма Аспартатаминотрансферазы (АСТ / АсАТ)
-
Почему Аспартатаминотрансфераза (АСТ, АсАТ) повышена?
-
-
Щелочная фосфатаза (ЩФ)
-
Норма щелочной фосфотазы крови
-
Причины повышения щелочной фосфотазы
-
Причины низкого уровня щелочной фосфотазы
-
Как сдать анализ на щелочную фосфотазу?
-
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача.
В
биохимическом анализе крови часто
используют определение активности ферментов.
Что представляют собой ферменты?Фермент –
это белковая молекула, которая ускоряет
протекание биохимических реакций в
организме человека. Синонимом понятия
фермент является термин энзим.
В настоящее время оба эти термина
используются в одном значении в качестве
синонимов. Однако наука, изучающая
свойства, строение и функции ферментов,
называется энзимологией.
Рассмотрим,
что же представляет собой данная сложная
структура – фермент. Фермент состоит
из двух частей – собственно белковой
части и активного центра фермента.
Белковая часть называется апофермент,
а активный центр – кофермент.
Вся молекула фермента, то есть апофермент
плюс кофермент носит название голофермент.
Апофермент всегда представлен
исключительно белком третичной
структуры. Третичная структура означает,
что линейная цепочка аминокислот
преобразуется в структуру сложной
пространственной конфигурации. Кофермент
может быть представлен органическими
веществами (витамин
В6,
В1, В12, флавин, гем и
т.д.) или неорганическими (ионы металлов
– Cu, Co, Zn и т.д.). Собственно ускорение
биохимической реакции производится
именно коферментом.
Что
такое фермент? Как работают
ферменты?
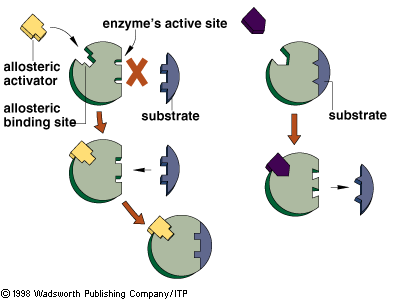 Вещество,
на которое фермент действует,
называется субстратом,
а вещество, которое получается в
результате реакции, называется продуктом.
Часто названия ферментов образуются
путем прибавления окончания – аза к
названию субстрата. Например,
сукцинатдегидрогеназа –
расщепляет сукцинат (янтарную кислоту),
лактатдегидрогеназа – расщепляет
лактат (молочную кислоту) и т.д.Ферменты
делятся на несколько видов в зависимости
от типа реакции, которую они ускоряют.
Например, дегидрогеназы проводят
окисление или восстановление, гидролазы
проводят расщепление химической связи
(трипсин, пепсин – пищеварительные
ферменты) и т.д.
Каждый фермент
ускоряет только одну определенную
реакцию и работает в определенных
условиях (температура, кислотность
среды). Фермент имеет сродство к своему
субстрату, то есть может работать только
с этим веществом. Узнавание «своего»
субстрата обеспечивается апоферментом.
То есть процесс работы фермента можно
представить таким образом: апофермент
узнает субстрат, а кофермент ускоряет
реакцию узнанного вещества. Данный
принцип взаимодействия был назван лиганд
– рецепторным или взаимодействием
по принципу ключ – замок.То
есть, как и к замку подходит индивидуальный
ключ, так и к ферменту подходит
индивидуальный субстрат.
Вещество,
на которое фермент действует,
называется субстратом,
а вещество, которое получается в
результате реакции, называется продуктом.
Часто названия ферментов образуются
путем прибавления окончания – аза к
названию субстрата. Например,
сукцинатдегидрогеназа –
расщепляет сукцинат (янтарную кислоту),
лактатдегидрогеназа – расщепляет
лактат (молочную кислоту) и т.д.Ферменты
делятся на несколько видов в зависимости
от типа реакции, которую они ускоряют.
Например, дегидрогеназы проводят
окисление или восстановление, гидролазы
проводят расщепление химической связи
(трипсин, пепсин – пищеварительные
ферменты) и т.д.
Каждый фермент
ускоряет только одну определенную
реакцию и работает в определенных
условиях (температура, кислотность
среды). Фермент имеет сродство к своему
субстрату, то есть может работать только
с этим веществом. Узнавание «своего»
субстрата обеспечивается апоферментом.
То есть процесс работы фермента можно
представить таким образом: апофермент
узнает субстрат, а кофермент ускоряет
реакцию узнанного вещества. Данный
принцип взаимодействия был назван лиганд
– рецепторным или взаимодействием
по принципу ключ – замок.То
есть, как и к замку подходит индивидуальный
ключ, так и к ферменту подходит
индивидуальный субстрат.
Амилаза крови
 Амилаза
вырабатывается поджелудочной железой
и участвует в расщеплении крахмала и
гликогена до глюкозы. Амилаза – это
один из ферментов, участвующих в
пищеварении. Наибольшее содержание
амилазы определяется в поджелудочной
железе и слюнных железах.
Существует
несколько видов амилазы –
α-амилаза, β-амилаза, γ-амилаза, из которых
наибольшее распространение получило
определение активности α-амилазы. Именно
концентрацию этого вида амилазы
определяют в крови в лаборатории.
В
крови человека содержится два типа
α-амилазы – Р-тип и S-тип. В моче присутствует
65% Р-типа α-амилазы, а в крови до 60%
составляет S-тип. Р-тип α-амилазы мочи в
биохимических исследованиях называют
диастаза, во избежание путаницы.
Активность
α-амилазы в моче в 10 раз выше, чем
активность α-амилазы в крови. Определение
активности α-амилазы и диастазы используют
для диагностики панкреатитов и
некоторых других заболеваний поджелудочной
железы. При хронических и подострых
панкреатитах используют определение
активности α-амилазы в соке двенадцатиперстной
кишки.
Амилаза
вырабатывается поджелудочной железой
и участвует в расщеплении крахмала и
гликогена до глюкозы. Амилаза – это
один из ферментов, участвующих в
пищеварении. Наибольшее содержание
амилазы определяется в поджелудочной
железе и слюнных железах.
Существует
несколько видов амилазы –
α-амилаза, β-амилаза, γ-амилаза, из которых
наибольшее распространение получило
определение активности α-амилазы. Именно
концентрацию этого вида амилазы
определяют в крови в лаборатории.
В
крови человека содержится два типа
α-амилазы – Р-тип и S-тип. В моче присутствует
65% Р-типа α-амилазы, а в крови до 60%
составляет S-тип. Р-тип α-амилазы мочи в
биохимических исследованиях называют
диастаза, во избежание путаницы.
Активность
α-амилазы в моче в 10 раз выше, чем
активность α-амилазы в крови. Определение
активности α-амилазы и диастазы используют
для диагностики панкреатитов и
некоторых других заболеваний поджелудочной
железы. При хронических и подострых
панкреатитах используют определение
активности α-амилазы в соке двенадцатиперстной
кишки.
Норма амилазы крови
|
название анализа |
норма в мккатал/л |
единицы измерения в Ед/л (Е/л) |
|
16-30 мккатал/л |
20-100 Ед/л |
|
28-100 мккатал/л |
до 1000 Ед/л |
Повышение амилазы крови
Повышение активности α-амилазы в крови называется гиперамилаземия, а повышение активности диастазы мочи –гиперамилазурия. Повышение амилазы крови выявляется при следующих состояниях:
-
в начале острого панкреатита, максимум достигается через 4 часа от начала приступа, а снижается до нормы на 2-6 сутки от начала приступа (повышение активности α-амилазы возможно в 8 раз)
-
при обострении хронического панкреатита (при этом активность α-амилазы возрастает в 3-5 раз)
-
при наличии опухолей или камней в поджелудочной железе
-
острая вирусная инфекция – свинка
-
алкогольная интоксикация
-
внематочная беременность
Когда амилаза мочи повышена? Повышение концентрации амилазы в моче развивается в следующих случаях:
-
при остром панкреатите происходит увеличение активности диастазы в 10-30 раз
-
при обострении хронического панкреатита активность диастазы возрастает в 3-5 раз
-
при воспалительных заболеваниях печени наблюдается умеренное повышение активности диастазы в 1,5-2 раза
-
острый аппендицит
-
холецистит
-
кишечная непроходимость
-
алкогольная интоксикация
-
кровотечения из язвы желудочно-кишечного тракта
-
при лечении сульфаниламидными препаратами, морфином, мочегонными средствами и оральными контрацептивами
При развитии тотального панкреонекроза, раке поджелудочной железы и хроническом панкреатите активность α-амилазы может не увеличиваться.
Снижение амилазы крови и мочи
Существуют состояния организма, при которых активность α-амилазы может снижаться. Низкая активность диастазы мочи выявляется при тяжелом наследственном заболевании – муковисцидозе. В крови снижение активности α-амилазы возможно после приступа острого панкреатита, при панкреонекрозе, а также при муковисцидозе. Несмотря на то, что α-амилаза присутствует в почках, печени и поджелудочной железе, определение ее активности в основном используют в диагностике заболеваний поджелудочной железы.
Как сдать анализ на амилазу?
Для определения активности амилазы сдается кровь из вены, утром, натощак или средняя порция утренней мочи. Накануне перед сдачей анализа необходимо избегать жирной и острой пищи. При остром приступе панкреатита кровь из вены и моча сдаются в независимости от времени суток.В настоящее время в большинстве лабораторий используются ферментативные методы определения активности амилазы. Этот метод достаточно точен, высоко специфичен и занимает недлинный промежуток времени.
Липаза
 Строение,
виды и функции липазы
Липаза
– это один из пищеварительных ферментов,
который участвует в расщеплении жиров.Для
работы данного фермента необходимо
присутствие желчных кислот и кофермента,
который называется колипаза. Липаза
вырабатывается различными органами
человека – поджелудочной железой,
легкими, лейкоцитами.
Наибольшее
диагностическое значение имеет липаза,
которая синтезируется в поджелудочной
железе. Поэтому определение активности
липазы применяют преимущественно в
диагностике заболеваний поджелудочной
железы.
Строение,
виды и функции липазы
Липаза
– это один из пищеварительных ферментов,
который участвует в расщеплении жиров.Для
работы данного фермента необходимо
присутствие желчных кислот и кофермента,
который называется колипаза. Липаза
вырабатывается различными органами
человека – поджелудочной железой,
легкими, лейкоцитами.
Наибольшее
диагностическое значение имеет липаза,
которая синтезируется в поджелудочной
железе. Поэтому определение активности
липазы применяют преимущественно в
диагностике заболеваний поджелудочной
железы.
Норма липазы крови
|
Норма активности липазы |
||
|
13 - 60 |
Ед/мл |
В моче здорового человека липаза отсутствует!
Липаза в диагностике заболеваний поджелудочной железы Для диагностики заболеваний поджелудочной железы липаза является более специфичным тестом, чем амилаза, поскольку ее активность остается нормальной при внематочной беременности, остром аппендиците, свинке и заболеваниях печени. Поэтому при возникновении подозрения на наличие панкреатита целесообразно определять активность липазы и амилазы одновременно.Повышение активности липазы сыворотки крови при остром панкреатите возможно от 2 до 50 раз относительно нормы. Для выявления именно острого алкогольного панкреатита используют соотношение активности липазы и амилазы, причем если данное соотношение больше 2, то данный случай панкреатита, несомненно, алкогольного происхождения.Повышение активности амилазы в крови происходит через 4-5 часов после приступа острого панкреатита, достигает максимума через 12-24 часа и остается повышенной в течение 8-12 дней. При развитии острого панкреатита активность липазы в сыворотке крови может увеличиваться раньше и значительнее, чем активность амилазы.
