
8447
.pdf
50
термодинамических параметров (рис. 1.1). Точка на плоскости определяется двумя координатами - термодинамическими параметрами, а третий параметр в данном случае также фиксирован и может быть найден из уравнения состояния. Термодинамика изучает в основном равновесные состояния, и поэтому ее правильней было бы назвать термостатикой.
∙ Состояние системы будет не равновесным}, если параметры системы меняются с течением времени. При этом термодинамические параметры разных частей системы могут быть различными, то есть система не может полностью быть охарактеризована определенным значением термодинамического параметра. Например, если температура в разных точках тела различна, то такое состояние неравновесно. Если такое тело изолировать от других тел, то температура выравняется и примет одинаковое значение T во всех точках - тело перейдет в равновесное состояние.
Первый исходный постулат термодинамики, вытекающий из опыта, состоит в том, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может.
Процесс перехода системы из неравновесного состояния в равновесное называется процессом релаксации, или просто релаксацией, а время перехода к равновесному состоянию называют временем релаксации. Процессы
релаксации выходят за рамки обычной термодинамики – их изучением занимается неравновесная термодинамика, или кинетика. В качестве примеров кинетических явлений можно назвать – такие, как теплопроводность,
диффузию, внутреннее трение в жидкостях и газах.
РАВНОВЕСНЫЙ ПРОЦЕСС. Равновесное состояние неизолированной
системы может изменяться в результате взаимодействия с внешними телами. Переход системы из одного состояния в другое называется процессом. Процесс будет равновесным, если при его течении система проходит через
последовательные равновесные состояния. Обычно равновесные процессы вызываются медленными изменениями внешних условий, так что очередное равновесное состояние успевает установиться (то есть когда характерное время изменения внешних условий должно быть много больше, чем соответствующее время релаксации). Ясно, что равновесный процесс в плоскости термодинамических параметров изобразится линией, каждая точка которой соответствует равновесному состоянию. Эта линия представляет собой график равновесного процесса. На рис. 1.1. изображен график процесса перехода из состояния 1 в состояние
1  2
2
V
Рис. 1. График равновесного процесса

51
∙Равновесный процесс является обратимым процессом, поскольку он может быть проведен в обратном направлении, когда система проходит через те же равновесные состояния в обратной последовательности. На графике процесса (рис. 1) этому соответствует движение в обратном направлении от точки 2 к точке 1.
∙Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом, или циклом. График
кругового процесса представляет собой замкнутую кривую (рис. 2). ТЕМПЕРАТУРА является одним из основных термодинамических
параметров, определяющих состояние системы. Существование такого параметра, определяющего направление самопроизвольной передачи тепла, является вторым постулатом термодинамики.
Поскольку температура определяет состояние системы вместе с другими термодинамическими параметрами, для ее определения можно следить за какими-либо термодинамическими параметрами, которые можно легко измерять. В большинстве термометров (например, в жидкостных) используется свойство тел увеличивать свой объем с ростом температуры. Если за ноль температуры принять температуру таяния льда, а температуру кипения воды при атмосферном давлении - за 100 градусов, получим температурную шкалу Цельсия, наиболее применимую в быту. Более точно можно измерять температуру, если в качестве термометрического тела использовать газ и следить за его давлением в заданном объеме. Тогда давление будет линейно увеличиваться с ростом температуры t :
P = P0 × (1 + α p × t) ,
где буквой t обозначена температура по шкале Цельсия, α p - так называемый термический коэффициент давления. Удивительно, что для любых достаточно разреженных газов α p имеет одно и то же значение: 1/273,16. Это позволяет ввести более удобную в теории шкалу температур T - шкалу Кельвина:
Т = t + |
1 |
= t + 273,16 |
α p |
Видим, что величина градусов в этих шкалах совпадает (увеличение t на один градус приводит к увеличению T также на один градус). Однако начало отсчета (ноль температуры) не совпадают - t = 00 C (ноль по шкале Цельсия) соответствует T=273,16 K. Удобство шкалы Кельвина видно уже из того, что зависимость давления газа от температуры при постоянном объеме (закон Шарля) становится проще: P = P0α pT .
Предложение к размышлению. Для более глубокого усвоения этого вопроса предлагаем вам самостоятельно ответить на вопрос: можно ли было бы ввести температурную шкалу Кельвина, если бы α p имел разное значение для
разных газов? Если вы затруднитесь с ответом или захотите проверить свой ответ, прочитайте сноску на стр. 12.

52
Р
1  2
2
V
Рис. 2. График равновесного цикла
ВНУТРЕННЯЯ ЭНЕРГИЯ системы является суммой всех видов энергии, заключенных в этой системе. Согласно первому постулату термодинамики внутренняя энергия изолированной системы остается постоянной, какие бы процессы в ней ни происходили. Это, в частности, означает, что каждое состояние системы характеризуется определенным значением внутренней энергии. Всякий раз, когда система оказывается в этом состоянии, внутренняя энергия принимает фиксированное значение. Другими словами, внутренняя
энергия является функцией состояния.
Внутренняя энергия обладает свойством аддитивности (от английского глагола add - добавлять, складывать), т.е. внутренняя энергия системы равна сумме внутренних энергий ее частей.
Полная энергия E любого тела может быть представлена в виде суммы
внутренней энергии U |
и механической энергии движения тела |
как целого |
Емех = Екин + Епот . Иначе |
говоря, при вычислении внутренней |
энергии не |
учитывают движение тела (системы) как целого. |
|
|
Значение других важных термодинамических терминов мы поясним по мере их появления.
1.4.Разреженный газ как термодинамическая система
Проиллюстрируем некоторые из описанных выше терминов на примере простейшей системы - разреженного газа. При этом мы вспомним основные характерные процессы в газах и уравнение состояние. Эти вопросы будут постоянно использоваться нами в дальнейшем.
1.4.1. Экспериментальные газовые законы
Состояние некоторой массы газа характеризуется следующими термодинамическими параметрами: объемом (V), давлением (p) и температурой
53
(T). Перечислим кратко изопроцессы, происходящие в газах, то есть такие
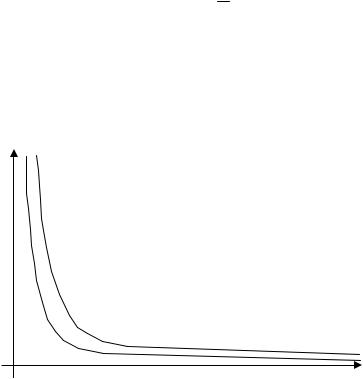
процессы, которые протекают при одном фиксированном параметре. Изотермический процесс (T=const) описывается законом Бойля -
Мариотта, установленным на основании экспериментов:
при изотермическом процессе произведение давления на объем для данной
массы газа (m=const) есть величина постоянная, т.е.
pV=const
График изотермического процесса в координатах {p,V} представляет собой
гиперболу и носит название изотермы (рис. 3).
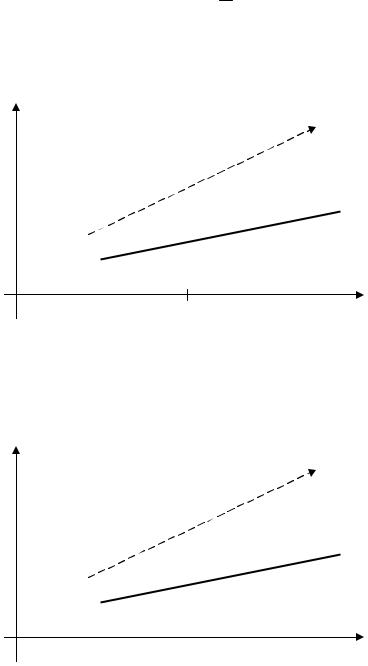
Изобарический процесс - процесс, при котором изменение состояния газа происходит при постоянном давлении (p=const). Такой процесс описывается законом Гей-Люссака, который также был установлен опытным путем:
при изобарическом процессе объем данной массы газа (m=const) пропорционален абсолютной температуре (температуре по шкале Кельвина)
V = const . T
График этого процесса представляет собой прямую линию (рис. 4). На оси температур указаны также градусы по шкале Цельсия. На вертикальной оси не указаны конкретные значения, поскольку они будут зависеть от массы m и вида данного газа. В таком виде график качественно описывает любое количество любого газа.
Р -
Т2
Т1
0 |
V |
Рис. 3. График изотермического процесса. сплошная линия – процесс при температуре Т1, пунктир соответствует температуре Т2.
Изохорический процесс - процесс, когда изменение состояния газа происходит при постоянном объеме (V=const). Такой процесс описывается опытным законом Шарля: при изохорическом процессе давление данной массы газа (m=const) пропорционально температуре по шкале Кельвина:
54
Р = const .
Т
График этого процесса изображен на рис. (5) и представляет собой прямую линию, продолжение которой выходит из начала координат.
V
p2
p1
- 273,160 С |
О |
0С |
t |
0 |
|
|
T |
273,16К
Рис. 4. График изобарического процесса в координатах {V,T}. Сплошная линия
– процесс при давлении р1, пунктир соответствует процессу при давлении р2.
р
V2
V1
- 273,160 С |
О0С |
t |
|
|
|
|
|
0 |
273,16 К |
T |
|
Рис. 5. График изохорического процесса в координатах {p,Т}. Сплошная линия
– процесс при объеме V1, пунктир соответствует процессу при объеме V2.
Важно, что независимо от массы, вида и давления, при котором
происходит процесс, продолжение графиков пересечет ось температур в точке t = −273,160 С , что позволяет принять эту точку за начало отсчета температуры
по шкале Кельвина. Эта шкала температур является абсолютной, в частности

55
потому, что она не связана с каким-либо определенным термометрическим веществом.1
1.4.2.Уравнение состояния идеального газа
Врассмотренных ранее изопроцессах, описываемых законами Бойля - Мариотта, Гей-Люссака и Шарля, один из параметров (p,V,T) газа оставался постоянным. Однако чаще всего имеют место процессы, при которых изменяются все три параметра.
Поскольку изопроцессы выражаются равенствами:
pV=const, если T=const;
V = const , если p=const;
T
p = const , если V=const,
T
нетрудно догадаться, что в общем виде должно быть:
pV |
= const . |
(1) |
|
||
T |
|
|
Действительно, эта формула в частных случаях описывает все три изопроцесса (например, если T=const, то pV=const). К этому же соотношению можно прийти без использования интуиции - путем анализа газовых процессов. Приведем эти рассуждения в качестве примера термодинамического метода исследования систем.
Ответы на вопросы тренировочного задания, сформулированные на стр.
1) Т2>Т1. Если провести вертикальную прямую, соответствующую некоторому объему V*, она пересечет нижний график в точке a и верхний - в точке b. Поскольку давление в точке b больше, чем в точке a, значит, согласно закону Шарля состояние, соответствующее точке b, отвечает большей температуре.
2) р2 < р1. Точки a и b обоих графиков на рис. 4, отвечающие одной и той же температуре, имеют разный объем. Согласно закону Бойля - Мариотта больший объем соответствует меньшему давлению. В точке b объем больше, а, значит, давление меньше.
3) V2<V1. В точках a и b на рис. 5 температура одинакова, а давление разное. Используя закон Бойля - Мариотта, делаем вывод, что поскольку давление в точке b больше, чем в точке a, объем в точке a будет больше, чем в точке b.
1 Это связано с тем, что термический коэффициент давления α p имеет одно и то же значение для
всех разреженных газов. Если бы α p зависел от рода газа, то, приняв ноль температур для одного
термометрического вещества, мы не получили бы упрощения вида законов для других газов.

56
Пусть в результате какого-то процесса изменились все три параметра (были p1, V1, T1, стали p2, V2, T2). Найдем связь между старыми и новыми параметрами газа.
Будем считать, что переход от первого состояния ко второму произошел в два этапа:
-сначала без изменения температуры T1 давление достигло значения p2 (объем тоже изменился и принял значение V');
-далее прошел изобарический процесс, в результате которого температура
иобъем достигли значений T2, V2.
Для нахождения объема V' можно воспользоваться законом Бойля -
Мариотта: |
|
|
|
р1V1=p2V′=const, т.е. V′=V1 |
p1 |
. |
(2) |
|
|||
|
p2 |
|
|
На втором этапе справедлив закон Гей - Люссака, следовательно, можно записать:
V ' = |
V2 |
= const , т.е. V '= V2 |
T1 |
. |
(3) |
|
T |
|
|||||
T |
|
|
T |
|
||
1 |
2 |
|
2 |
|
|
|
Так как левые части формул (2) и (3) равны, то должны быть равны и правые:
V |
|
p1 |
|
= V |
|
|
T1 |
|
, |
|
|
||
|
p |
|
|
2 T |
|
||||||||
1 |
|
2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
2 |
|
|
|
|
|||
что можно записать в виде: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1V1 |
= |
p2V2 |
. |
(4) |
|||||||
|
|
|
|
|
|
|
|||||||
|
|
T1 |
|
|
|
|
T2 |
|
|
|
|||
Таким образом, при любом процессе в разреженном газе начальные и конечные параметрами связаны равенством (4), а поскольку конечное состояние выбрано произвольно, можно заключить, что при любом состоянии разреженного газа произведение давления на объем, деленное на абсолютную температуру, для данной массы газа есть величина постоянная:
pV |
= B = const . |
(5) |
|
||
T |
|
|
Значение постоянной B зависит от массы и рода газа. Из формулы (5) следует, что
pV=BT. |
(6) |
Это выражение является уравнением состояния идеального газа и часто
называется формулой Клайперона - Менделеева. Замечание к процедуре вывода уравнения состояния
При получении окончательного выражения мы рассмотрели конкретный термодинамический процесс, состоящий из двух изопроцессов. Результат не изменится, если рассмотреть любой другой путь, состоящий из двух
57
изопроцессов (p1 → p2 при V=const + V1 → V2 при p=const, или T1 → T2 при V=const +V1 → V2 при T=const и т. п.). Рекомендуем вам в качестве полезного упражнения доказать, что результат не зависит от пути, который рассматривается.
Универсальная газовая постоянная. В соответствии с законом,
установленным Авогадро, моли всех газов занимают при одинаковых условиях (т.е. при одинаковых температуре и давлении) одинаковый объем - Vμ . В
частности, при так называемых нормальных условиях (н.у.), т.е. при температуре 00 C и давлении 1атм (1,01×105 Па ), объем моля любого газа Vμ =22,4л/моль= 22,4 ×10−3 м3 / моль. Это позволяет при помощи формулы (1.6)
найти константу B для одного моля газа, которая обозначается R:
R = |
pVμ |
= |
1,01×105 |
× 22,4 ×10−3 |
× |
Па × м3 |
/ моль |
= 8,31 |
Дж |
|
. |
(7) |
|
T |
|
273 |
|
|
моль× |
|
|||||||
|
|
|
К |
|
|
К |
|
||||||
Важно, что согласно закону Авогадро, величина R будет одной и той же для любого газа, поэтому ее называют универсальной газовой постоянной.От уравнения (7), записанного для одного моля газа
рVμ =RT, (8)
легко перейти к уравнению для любой массы газа m. Если один моль газа имеет объем Vμ , то ν молей при тех же условиях будут иметь объем в ν раз больший:
V=νVμ , т.е. Vμ =V/ν. Подставляя это равенство в формулу (7), получим:
рV=νRT, |
(9) |
причем число молей может быть выражено через массу газа и его молярную массу: ν=m/µ. Таким образом, уравнение состояния для любой массы идеального газа может быть записано в виде:
pV = |
m |
RT . |
(10) |
μ |
Это есть обобщенное уравнение Клайперона - Менделеева.
1.5.Основное уравнение молекулярно-кинетической теории
Как следует из названия раздела, здесь мы отойдем на время от термодинамического метода и обратим внимание на статистический подход. Задача данного раздела - количественно объяснить давление газа на стенки сосуда как результат совместного действия молекул, составляющих газ. Вы также убедитесь на примере газа, что термодинамический и статистический подходы действительно дополняют друг друга, давая новую информацию. В частности, будет найдена связь средней кинетической энергии молекул газа с температурой.

58
Физическая модель идеального газа. В разделе 1 был оценен характерный размер d молекулы (на примере воды), который оказался равным 3 ×10−10 м. Там же говорилось, что несжимаемость воды, по-видимому, связана с тем, что молекулы практически касаются друг друга, то есть размер d сравним с расстоянием между центрами молекул. В газах это, по-видимому, не так, поскольку объем может сильно уменьшаться.
Оценим среднее расстояние dср между молекулами газа при нормальных
условиях. Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает объем 22,4 10 −3 м3 /моль. Значит, на одну молекулу приходится объем в Na раз меньший:
V = |
22,4 ×10−3 |
м3 = 3,7 ×10−26 м3 . |
|
|
|||
1 |
6 |
×1023 |
|
|
|
||
Поскольку V1 dср , получим:
dср = 3  3,7 ×10−28 × м3 @ 3,3 ×10−9 × м
3,7 ×10−28 × м3 @ 3,3 ×10−9 × м
Таким образом, в газе среднее расстояние между молекулами на порядок больше характерного размера молекул: dср/d 10. Это обстоятельство позволяет принять следующую модель идеального газа:
1)Газ сильно разрежен, так что собственный объем молекул газа Vмол Nаm/μ V1 существенно меньше объема сосуда, в котором находится газ (Vмол. < V).
2)Силами взаимодействия между молекулами такого разреженного газа можно пренебречь и учитывать взаимодействие только при столкновении молекул.
3)Столкновения молекул газа между собой и со стенками сосуда являются абсолютно упругими (молекулы - упругие шарики).
4)Молекулы газа совершают беспорядочное тепловое движение, т.е. направления скоростей ориентированы в пространстве совершенно беспорядочно. Это означает, что в каждом направлении в данный момент движется одинаковое число молекул, т.е. N/6, где N - полное число молекул газа (N/3 молекул движется параллельно каждой из осей координат, причем половина из них движется в положительном направлении, а другая - в противоположную сторону).
Давление молекул на стенку сосуда. Давление согласно
определению равно силе, с которой газ воздействует на площадку единичной
площади, перпендикулярно площадке:
p = F ,
DS
где S - площадь плоской площадки, например стенки сосуда. Величина суммарной силы воздействия молекул на площадку по III закону Ньютона
59
равна суммарной силе, действующей на систему молекул со стороны площадки. Следовательно, сила может быть найдена по II закону Ньютона для системы материальных точек:
|
F = |
P , |
|
|
Dt |
где P - суммарное изменение импульса всех молекул, сталкивающихся за время |
||
t с площадкой |
S. |
|
Для того, |
чтобы вычислить P, |
необходимо, во-первых, знать число |
молекул N', которые ударяются о площадку за малое время t, и, во-вторых, изменение импульса каждой молекулы.
Если молекула массы m0 налетает в направлении, перпендикулярном площадке, со скоростью υ, то в результате абсолютно упругого удара с тяжелой площадкой (масса сосуда много больше массы молекулы) молекула отскочит с такой же скоростью в противоположном направлении (это известно из
механики). То есть изменение импульса одной молекулы равно:
DP1 = m0υ - (-m0υ) = 2m0υ .
Теперь необходимо вычислить число молекул N'. Сколько молекул столкнутся с площадкой за время t? Это будут все молекулы, расположенные в объеме V и летящие в направлении, перпендикулярном площадке. Значит, это составит 1/6 от всех молекул, содержащихся в объеме V:
N ¢ = 1 nDV ,
6
где n - концентрация молекул газа, т.е. число молекул в единице объема.
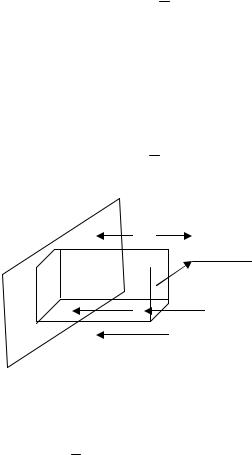
Чем определяется объем V? Это тот объем, из которого молекулы, движущиеся в сторону площадки, успевают ее достичь за время t (см. рис.6). Значит, высота равна υΔt, а основание - S, что позволяет определить V= S υΔt и записать выражение для числа столкновений:
N ¢ = 1 nDSυDt .
6
υΔt  S
S
Рис. 6. Объем V, из которого молекулы достигают площадки за время t
Поэтому P=2m0υt N'=1 nm0υ 2 × DS × Dt и окончательно получим:
3
