
6964
.pdf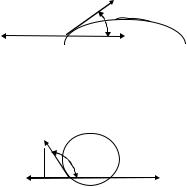
уменьшением поверхностного натяжения. В самопроизвольном процессе капля жидкости будет растекаться и покрывать поверхность твердого тела с уменьшением краевого угла θ до минимального значения. Это соответствует уменьшению поверхностного натяжения (σт-ж ) на границе твердое тело – жидкость по сравнению с поверхностным натяжением (σт-г ) твердое тело – газ:
σт-г − σт-ж> 0.
Равновесное (устойчивое) состояние (рис. 6) будет достигнуто, когда равнодействующая поверхностного натяжения трех фаз равна нулю (уравнение Юнга):
|
|
σт-г − σт-ж − σж-г cos θ = 0 или |
||
|
|
cos θ = (σт-г − σт-ж)/σж-г. |
||
|
|
|
|
|
|
Г |
|
σж-г |
θ |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Т |
σт-г |
|
σт-ж |
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
σж-г |
|
|
|
|
Г |
θ |
|
|
|
|
|
|
|
|
|
|
|
|
Т |
σт-г |
σт-ж |
|
|
|
|
|
|
б
Рис. 6. Распределение энергии поверхностного натяжения: а) на
гидрофильной поверхности (θ < 900); б) на гидрофобной поверхности
(θ > 900)
Из уравнения Юнга следует, что при σт-г − σт-ж> 0 значение cos θ > 0, и тогда θ изменяется в пределах от 00 до 900. Величина краевого угла свидетельствует об эффективности смачивания, эффективности контактного взаимодействия жидкости с поверхностью твердого тела.
Если σт-г − σт-ж < 0, то значение cos θ < 0, и θ изменяется в пределах от 900 до 1800, что означает плохое смачивание или отсутствие смачивания поверхности жидкостью. В последнем случае ярко выражено более сильное взаимодействие между молекулами внутри жидкости по сравнению с взаимодействием молекул на границе двух фаз.
Изменение степени смачивания происходит при использовании поверхностно-активных веществ (ПАВ) и означает изменение поверхностной энергии на границе раздела фаз.
2.3. Адгезия
Адгезия – это прилипание находящихся в контакте поверхностей разной природы. Явление адгезии наблюдается между поверхностями в системах: твердое тело – твердое тело, твердое тело – жидкость, жидкость – жидкость.
Адгезия между телами реализуется преимущественно за счет сил Ван-дер-Ваальса или водородных связей. Два тела прилипают при контакте поверхностями в результате уменьшения энергии поверхностного натяжения, присущего самопроизвольным, термодинамически разрешенным процессам, о которых говорилось при обсуждении явления смачивания.
Тело, которое прилипает, называют адгезивом. Тело, к которому прилипает адгезив, называется субстратом. Чаще всего субстратами являются разнообразные твердые тела (металлы, пластмасса, керамика, стекло, поверхность древесины и т.д.).
21 |
22 |
Слипание твердых частиц называют аутогезией, если слипаются частицы одного и того же вещества, например частицы порошка. В результате аутогезии изменяется их сыпучесть.
Количественно энергию (работу) адгезии удается рассчитать для систем, в которых, по крайней мере, одно из тел является жидкостью, т.к. для жидкостей существуют удобные экспериментальные методы определения поверхностного натяжения на границе раздела фаз жидкость – газ
(σж-г) и жидкость – жидкость(σж-ж).
Прилипание жидкости к твердому телу сопровождается уменьшением поверхностной энергии (выделением энергии), следовательно, для отрыва твердого тела от жидкости требуется затратить энергию − работу адгезии, Аадг. Уравнение для определения работы адгезии Аадг можно вывести, исходя из модели взаимодействия, представленной на рис. 7.
Ж
Ж
а) |
|
Г |
б) |
|
Т
Т
Рис. 7. Модель изменения поверхностного натяжения межфазных поверхностей, позволяющая вывести уравнение работы адгезии Аадг
В системе жидкость – твердое тело (рис. 7, а) отрыв твердого тела от жидкого связан с затратой энергии на образование двух новых поверхностей (рис. 7, б): жидкость – газ (σж-г) и твердое тело – газ (σт-г). При этом происходит потеря энергии (σт-ж) в результате исчезновения поверхно-
сти твердое тело – жидкость. Баланс энергетических затрат в форме работы адгезии представлен уравнением (2.4):
Аадг = (σт-г + σж-г) – σт-ж.. |
(2.4) |
Входящая в уравнение работы адгезии величина σж-г экспериментально легко определяется в отличие от величин
σт-г и σт-ж. Но значения σт-г и σт-ж можно заменить на σж-г, используя уравнение Юнга.
cos θ = (σт-г − σт-ж)/σж-г . |
(2.5) |
Разделение фаз требует совершения работы адгезии, которую можно определить, решая совместно уравнения
(2.4) и (2.5):
Аадг = σж-г (1 – cos θ). |
(2.6) |
Практическое использование явлений адгезии и смачивания
Различная смачиваемость поверхностей конденсированных тел используется в разнообразных технологических процессах, таких, как флотация, пропитка тканей, экстракция, смазка трущихся деталей, стирка (очистка поверхностей от загрязнений).
Рассмотрим примеры практического применения явлений адгезии и смачивания. В том случае, когда требуется максимально снизить смачивание и прилипание используют такие материалы, как фторопласты, полиметилметакрилат, полиэтилен, поливинилхлорид, поливинилацетат, полиамиды и ряд других органических полимеров. В операциях на кровеносных сосудах используются полимерные материалы, которые кровь не смачивает, т.е. не прилипает к стенкам и не вызывает образования тромбов.
Разделение частиц ценных минералов и пустой породы, основанное на различии смачиваемости их водой, называется флотацией. Английское слово flotation буквально означает плавание по поверхности. Сущность флотации рассмотрим на примере широко применяемого пенного ме-
23 |
24 |

тода выделения ценных минералов из руды. Измельченную руду, содержащую минералы меди, молибдена, бериллия, висмута и ряда других металлов, смешивают с водой в потоке пузырьков воздуха. Образуется трехфазная система – пульпа, состоящая из твердых частичек, жидкости и газа. Пузырьки газа (неполярная среда) будут прилипать к частичкам, имеющим гидрофобную поверхность, обеспечивая их всплытие на поверхность, и не будут прилипать к частичкам пустой породы с гидрофильной поверхностью (рис. 8). Руду, содержащую тяжелые минералы, приходится измельчать до частиц размером 0.1 – 0.2 мм, а содержащую легкие минералы до 0.2 – 3 мм, чтобы добиться максимального увеличения концентрации полезных минералов после флотации по сравнению с концентрацией минералов в руде. Так, при флотации медной руды, содержащей 1.5 – 1.7 % меди, получают концентрат, содержащий 35 % меди.
Воздух
Рис. 8. Схема флотационного метода отделения минералов от пустой породы. Частички минералов, покрытые пузырьками воздуха, всплывают, а пустая порода остается на дне ёмкости
2.4. Адсорбция
Адсорбцией называется концентрирование вещества на поверхности раздела фаз.
Физическая адсорбция – обратимый процесс концентрирования вещества на поверхности, который осуществляется под действием сил Ван дер Вальса (рис. 9, а) или в результате образования водородных связей (рис. 9, б).
а)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
H H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
б) |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si |
|
|
O |
|
|
|
|
|
|
Si |
|
|
|
O |
|
|
|
|
Si |
|
|
|
|
O |
|
|
Si |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
Si |
|
|
O |
|
|
Si |
|
|
|
O |
|
|
|
|
Si |
|
|
|
O |
|
|
Si |
|
|
O |
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si |
|
|
O |
|
|
|
|
|
Si |
|
|
|
|
O |
|
|
|
|
|
Si |
|
|
|
|
O |
|
|
Si |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
Si |
|
|
|
O |
|
|
|
Si |
|
|
|
|
|
O |
|
|
|
|
|
Si |
|
|
|
|
O |
|
|
Si |
|
|
|
O |
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
в) |
|
|
|
|
C |
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
C |
|
C |
|
C |
|
C |
|
|
|
|
|
|
|
|
|
C |
|
C |
|
C |
|
C |
|
C |
|
C |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 9. Модели взаимодействия адсорбтива с адсорбционными центрами. Физическое взаимодействие: а) дисперсионное; б) образование водородных связей. Химическое взаимодействие (в) или хемосорбция
Энергия такого взаимодействия лежит в пределах 10 ÷ 100 кДж/моль и не приводит к разрыву и образованию новых химических связей.
Химическая адсорбция – необратимая химическая реакция адсорбтива с адсорбентом на поверхности раздела фаз (рис. 9, в). Фактически адсорбтив и адсорбент выступают в роли реагентов экзотермической химической реак-
25 |
26 |

ции, сопровождающейся выделением энергии в количестве
200÷ 400 кДж/моль.
Вдальнейшем мы будем рассматривать главным образом физическую адсорбцию. Поверхность, на которой происходит концентрирование вещества, называется адсорбентом. Адсорбирующееся вещество называется адсорбтивом, если оно находится в объеме и адсорбатом, если закрепилось на поверхности адсорбента.
Адсорбция на границе жидкость – газ. Уравнение адсорбции Гиббса
Основы термодинамики адсорбции созданы американским физиком-теоретиком Дж. Гиббсом.
Рассмотрим равновесную двухфазную систему водный раствор поверхностно-активного вещества – воздух.
Поверхностно-активное вещество (ПАВ) – химическое соединение, структура которого включает неполярную углеводородную цепь, например СН3(СН2)nСН2−, соединенную с полярной группой, например такой, как
−[О(СН2)2]xOH (рис. 10).
СН3СН2(СН2)nCН2−[О(СН2)2]xOH
Оксиэтилированное
ПАВ полярная группа
неполярная группа
Рис. 10. Структура молекулы поверхностно-активного вещества
Молекулы воды вытесняют некоторую часть поверх- ностно-активного вещества на границу раздела фаз вода – воздух (газ). Полярные группы остаются в водной (поляр-
ной) среде, неполярные – в газовой фазе (неполярной среде). Так, молекулярный слой ПАВ концентрируется на границе раздела фаз.
Каждая из фаз однородна, но однородность нарушается в поверхностном слое за счет избытка количества поверх- ностно-активного вещества (адсорбтива), который концентрируется на границе раздела фаз, внедряясь между молекулами воды. В поверхностном слое изменяется концентрация молекул воды (она уменьшается) и молекул по- верхностно-активного вещества (она увеличивается) по сравнению с водным раствором ПАВ (рис. 11).
газ
х1
х2
 жидкость
жидкость
Рис. 11. Адсорбция (концентрирование) ПАВ на границе раздела фаз жидкость – газ
Внедрение неполярных углеводородных групп между молекулами воды приводит к уменьшению энергии межмолекулярного притяжения в поверхностном слое, что уменьшает поверхностное натяжение σ.
Отступление. Гиббсом введена величина Г [моль/м2] (гиббсов-
ская адсорбция), представляющая собою избыток адсорбата в объеме поверхностного слоя толщины х по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента.
27 |
28 |

Связь между гиббсовской адсорбцией Г, поверхностным натяжением σ и концентрацией адсорбтива с в растворе устанавливается на основании термодинамических расчетов.
Функция Гиббса G, отражающая состояние двухфазной системы жидкий раствор – газ, зависит от температуры Т, давления р, площади поверхности раздела фаз s, а также количества адсорбата n1 (ПАВ) и растворителя n2:
G = f(p, T, s, n1, n2),
|
∂G |
|
∂G |
|
∂G |
|
∂G |
|
|
∂G |
|
.(2.7) |
|
dG = |
|
dT + |
|
dp + |
|
ds + |
|
|
dn1 |
+ |
|
|
dn2 |
|
|
||||||||||||
dT p,s,n i |
|
|
∂s T , p,n i |
|
|
|
|
|
|
|
|
||
|
∂p T ,s,ni |
|
∂n1 T , p,s,n2 |
|
dn2 |
T , p,s,n1 |
|
||||||
При постоянной температуре и давлении (р,Т = const) уравнение (2.7) примет вид:
|
|
G |
|
|
|
G |
|
|
|
∂ |
G |
|
|
|
|
|
dG = ∂ |
|
ds |
|
∂ |
|
dn |
|
|
|
dn |
, |
(2.8) |
||
|
|
∂n |
∂n |
||||||||||||
|
|
∂s |
|
+ |
|
1 |
+ |
|
|
2 |
|
||||
|
∂G |
|
T , p,ni |
|
|
1 |
T , p,s,n2 |
|
|
|
2 |
T , p,n1 |
|
|
|
|
= σ |
− поверхностное натяжение, |
|
|
|
|
|||||||||
где |
|
|
|
|
|
||||||||||
|
∂s T , p,n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∂G |
= μ1 |
и |
|
∂G |
|
= μ2 |
− химические потенциалы адсор- |
||
|
|
|
|
|
|
|
||||
|
∂n |
|
|
|
|
∂n |
|
|
|
|
|
1 |
T , p,s,n2 |
|
|
|
|
2 |
T , p,s,n1 |
|
|
бтива и воды соответственно. |
|
|
|
dG = σds + μ1dn1 + μ2 dn2 , |
(2.9) |
|
dG = d(σs + μ1n1 + μ2n2), |
|
где |
G = σs + μ1n1 + μ2n2. |
|
Полный дифференциал функции G: |
|
|
dG = σds + sdσ + μ1dn1 + n1dμ1 + μ1dn1 + n1dμ1. |
(2.10) |
|
Принимая во внимание уравнение (2.9), получим: |
|
|
|
sdσ + n1dμ1 + n2dμ2 = 0. |
(2.11) |
Уравнение (2.11) отражает энергетическое состояние поверхностного слоя (sdσ), а также количества адсорбата n1 и растворителя n2 в поверхностном слое.
Объемная фаза раствора не зависит от энергетического состояния поверхностного слоя и уравнение (2.11) для объемной фазы имеет вид:
|
|
n10dμ1 + n20dμ2 = 0 , |
(2.12) |
где n0 |
и n0 |
количество адсорбтива и растворителя в жидкой фазе. |
|
1 |
2 |
|
|
Из уравнения (2.12) следует
0
dμ2 = − n10 dμ1 .
n2
Подставим значение dμ2 в уравнение (2.11), получим:
|
|
|
|
|
|
|
n |
n0 |
|
|
|
|
|
|
|
sdσ + n |
- |
2 |
× 1 |
dμ = 0 |
|
||||||
|
|
|
0 |
|
|||||||||
|
|
|
|
1 |
|
|
|
|
1 |
|
|
||
|
|
|
|
|
|
|
n2 |
|
|
|
|
||
или |
|
dσ |
|
|
n1 − n2 n10 / n20 |
|
|
||||||
|
|
|
|
|
, |
(2.13) |
|||||||
|
n1 − n2 n10 / n20 |
− dμ1 |
= |
|
|
|
s |
|
|
||||
|
|
|
|
|
|
|
|
||||||
где |
= Г − избыток адсорбата в объеме поверхностного |
||||||||||||
s |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
слоя толщиной |
х по сравнению с количеством адсорбтива в таком же |
||||||||||||
объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента.
Из уравнения (2.13) следует: |
|
|
|
||
Г = − |
dσ |
. |
(2.14) |
||
|
dμ1 |
|
|
|
|
Для разбавленных растворов: |
|
|
|
||
μ1 = μ10 + RT ln c1 и dμ1 = RTd ln c1 |
= RT |
dc1 |
. |
||
|
|||||
|
|
|
|
c1 |
|
Подставляя dμ1 |
= RT |
dc1 |
в уравнение (2.14), получим фундаменталь- |
||||||
|
|||||||||
|
|
c1 |
|
|
|
|
|
|
|
ное адсорбционное уравнение Гиббса: |
σ |
|
|
||||||
|
|
|
Г = − |
с |
d |
|
(2.15) |
||
|
|
|
1 |
|
. |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT dc1 |
|
|
|||
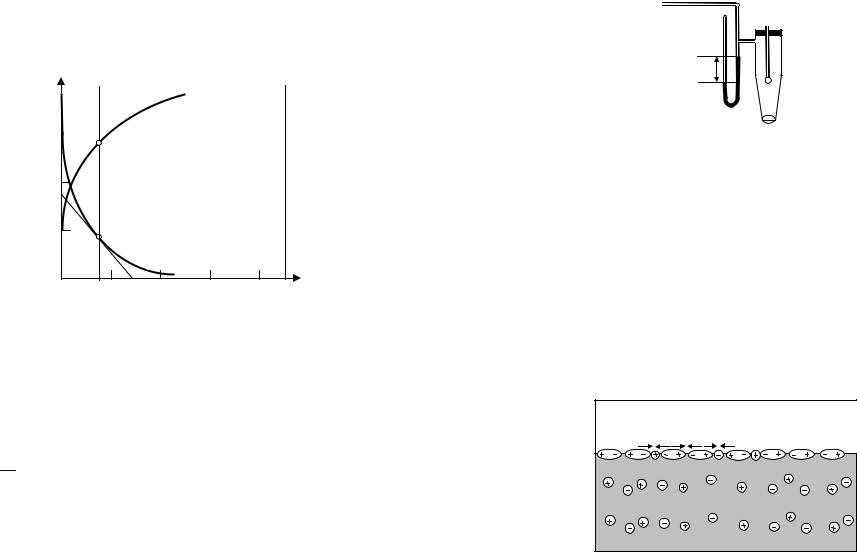
Графическая зависимость адсорбции Гиббса (Г – избыток адсорбата в поверхностном слое) и поверхностного натяжения σ от концентрации адсорбтива представлена на рис. 12.
Прямые измерения избытка адсорбата Г [моль/м2] в поверхностном слое – трудная задача. Обычно поступают следующим образом. Экспериментально определяют зависимость поверхностного натяжения σ от концентрации адсорбтива с в водном растворе и строят изотерму в координатах σ от с (рис. 12). Графически определяют величины
29 |
30 |
dσ |
для различных значений с – |
концентрации ПАВ в |
||||||||||||
|
|
|
|
|||||||||||
|
|
|||||||||||||
|
dc Т |
|
|
|
|
|
|
dσ |
||||||
|
|
|
|
|
|
|
Г = − |
с |
||||||
растворе и по уравнению |
|
|
|
|
вычисляют значения |
|||||||||
|
|
|
|
|
|
|
|
RT dc |
||||||
избытка адсорбата Г на поверхности адсорбента. |
||||||||||||||
|
|
|
|
|
σ, Дж/м2 |
|
|
|
|
|
|
|
|
|
|
|
|
Г, моль/м2 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ
Концентрация адсорбтива с моль/л
Рис. 12. Изотерма адсорбции Г и поверхностного натяжения σ от концентрации адсорбтива при Т = 298 К
Среди способов экспериментального определения поверхностного натяжения s на границе жидкость – газ рассмотрим метод наибольшего давления образования пузырьков на приборе Ребиндера (рис. 13).
Поверхностное натяжение рассчитывают по формуле:
р , где s - поверхностное натяжение водного рас-
р0
твора адсорбтива, концентрация которого с; р – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра; s0 = 71.95×10−3 Дж/м2 - табличное значение поверхностного натяжения воды; р0 – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра в чистой воде.
К прибору, создающему разрежение воздуха
р
Рис. 13. Прибор Ребиндера − вакуумная пробирка с капилляром для определения поверхностного натяжения σж-г
Наряду с поверхностно-активными веществами, уменьшающими поверхностное натяжение на границе раз-
дела фаз, существуют поверхностно-инактивные вещест-
ва, увеличивающие поверхностное натяжение. Как правило, это электролиты, соли неорганических кислот. Ионы окружены гидратными оболочками и удерживаются в объеме. Лишь незначительные количества ионов электролита проникают в поверхностный слой. Но и этого количества достаточно для увеличения поверхностного натяжения (рис. 14) на границе раздела газ – жидкость.
газ
жидкость
Рис. 14. Адсорбция поверхностно-инактивного вещества на границе раздела фаз жидкость – газ
31 |
32 |
Адсорбция на границе твердое тело – газ. Уравнение Ленгмюра
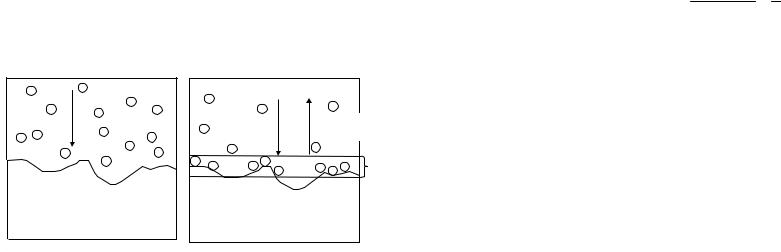
Исходя из молекулярно-кинетических представлений, американский физико-химик И. Ленгмюр предложил модель адсорбции в системе твердое тело – газ, исходя из следующих положений. Во-первых, физическая адсорбция на границе твердое тело – газ происходит не на всей поверхности, а на так называемых активных центрах – участках поверхности, активно взаимодействующих с адсорбтивом. Во-вторых, энергия адсорбции – одна и та же для молекул адсорбтива. В соответствии с этими положениями при достижении состояния динамического равновесия (рис. 15) скорость адсорбции становится равна скорости десорбции – процессу, обратному адсорбции.
G < 0 |
G = 0 |
С0 |
С |
|
адсорб десорб
х
а |
|
|
б |
|
|
||
|
|
|
|
Рис. 15. Схема процесса адсорбции газа на твердой поверхности: а) состояние системы до начала процесса адсорбции, концентрация газа с0; б) состояние динамического равновесия между адсорбцией и десорбцией, концентрация газа в газовой фазе с; х – толщина адсорбционного слоя
Для твердого адсорбента обычно остается неизвестным поверхностное натяжение sт-г и толщина поверхностного
слоя ( х), в котором концентрируется адсорбат. Чтобы преодолеть возникшее затруднение в определении параметров адсорбционного слоя, поступают следующим образом. Измеряют концентрацию адсорбтива в u [л] газовой фазы до (с0) и после (с) контакта газа с адсорбентом, когда наступит динамическое равновесие. Разность концентраций позволяет определить избыток адсорбата n [моль] на поверхности s [м2] адсорбента и величину адсорбции Гиббса:
сs = ( с – с0),
n=(с – с0)×u [моль],
Г= (с - с0 ) ×υ = n [моль/м2]. s s
Обычно поверхность s твердого пористого адсорбента неизвестна. В этом случае экспериментальную величину адсорбции Гиббса рассчитывают в моль на грамм адсорбента: Г [моль/г].
Физико-химический процесс адсорбции можно представить уравнением:
Ац + Ад Ац×Ад, где Ац – активные центры на поверхности, Ад – адсорбтив
в объеме газовой фазы, Ац×Ад – адсорбционные центры, занятые адсорбатом.
Константа равновесия адсорбции выражается уравнением:
К = [Ац×Ад]/[Ац]×[Ад], где К – константа равновесия, [Ад] = с моль/м3 – концен-
трация адсорбтива в объеме газовой фазы, [Ац×Ад] = a моль/м2 – концентрация активных центров, занятая адсорбатом, [Ац] =(a0 – a) моль/м2 – концентрация свободных активных центров на поверхности адсорбента, a0 моль/м2 – максимальная концентрация активных центров адсорбента, которые могут быть заполнены адсорбатом.
33 |
34 |
Воспользовавшись введенными обозначениями, получим выражение константы равновесия для адсорбционного процесса на поверхности:
|
|
|
К = |
α |
, |
или |
(α0 -α )× с |
||||
|
|
|
|||
α = α0 |
К × с |
(адсорбционное уравнение Ленгмюра) (2.16) |
|||
К × с +1 |
|
||||
Уравнение Ленгмюра может быть представлено в ином виде. В нем концентрация активных центров, занятая адсорбатом, выражена через давление газа:
|
Кр × р |
, |
(2.17) |
α = α0 Кр × р +1 |
|
||
где Кр = К/RT.
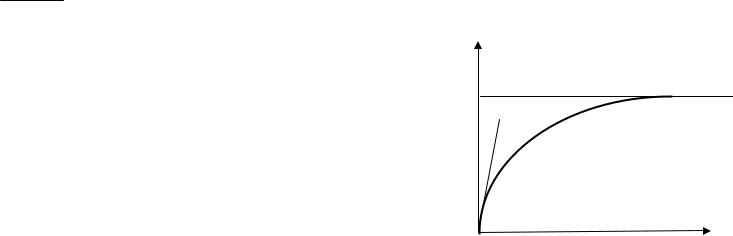
Анализ уравнения Ленгмюра показывает, что при низких давлениях (концентрациях) газа произведением Кр×р по сравнению с единицей можно пренебречь (Кр×р << 1), тогда уравнение (2.17) примет вид:
α= α0×Крр.
Всоответствии с этим уравнением наблюдается ли-
нейное нарастание количества адсорбированного вещества при увеличении давления газа.
При высоких давлениях (Кр×р >> 1) достигается практически полное заполнение активных центров адсорбента. Количество адсорбированного вещества перестает зависеть
от давления. Уравнение (2.17) принимает вид:
α = α0
Взаимодействие адсорбтива с активными центрами адсорбента является обратимым процессом при соблюдении следующих условий:
1) на каждом адсорбционном центре может располагаться только одна молекула адсорбата, поэтому поверх-
ность адсорбента покрывается мономолекулярным слоем адсорбата.
2) адсорбированные молекулы не взаимодействуют друг с другом.
Типичная изотерма адсорбции Ленгмюра представлена на рис. 16.
α моль/м2
α0
р Па
Рис. 16. Изотерма адсорбции Ленгмюра
Адсорбция на границе твердое тело – раствор. Ионообменная адсорбция
Ионообменная адсорбция – обратимый процесс сте-
хиометрического обмена ионами между ионообменной смолой и раствором электролита.
Ионообменные смолы или ионообменные сорбенты представляют собой гранулы полимера, напоминающие по внешнему виду крупный светлый или темно-коричневый речной песок. На поверхности гранул расположены функциональные группы, способные обмениваться катионами (катионообменная смола) или анионами (анионообменная смола) с водным раствором, содержащим сильный электролит. Катионообменная смола, содержащая на поверхности полимерной гранулы R сульфогруппы −SO3H, при кон-
35 |
36 |
такте с раствором электролита участвует в обмене катио-
нами:
R−SO3−H+(т) + Na+(р-р) + Cl−(р-р) → R−SO3−Na+(т) + Н+(р-р) + Сl−(р-р).
Анионообменные смолы обмениваются анионами с
водным раствором электролита, например:
R−NH3+OH−(т) + H+(р-р) + Cl−(р-р) → R−NH3+Cl−(т)+ Н2O(ж).
Если пропустить водный раствор хлорида натрия последовательно через колонки, заполненные катионо- и анионообменными смолами, – получим чистую воду (рис. 17).
O |
|
O |
S O-H++ Na+ +Cl- |
|
S O- Na+ + H+ +Cl- |
|
||
O |
|
O |

 NH3+OH- +Cl- +H+
NH3+OH- +Cl- +H+ 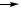

 NH3+Cl- + H2O
NH3+Cl- + H2O
Рис. 17. Получение чистой воды при пропускании раствора хлорида натрия через ионообменные колонки
Практическое использование адсорбции
Явление адсорбции широко используется в хроматографии, для хроматографического разделения различных веществ, в промышленных методах очистки газов и растворов, а также осушки газов. Наиболее широко использу-
ются в качестве адсорбентов активные (активированные) угли, цеолиты, силикагель.
Активные угли приготавливают специальной обработкой каменного и древесного угля. Получают пористые крупнозернистые порошки с удельной поверхностью 200 – 450 м2/г. Активные угли применяют, например, для улавливания оксидов серы, азота, выбрасываемых предприятиями цветной металлургии, для очистки воздуха помещений промышленных предприятий от сероуглерода, сероводорода, ацетона, бензола и других вредных веществ.
Кроме активного угля используют также углеродистые волокнистые адсорбенты. Их получают высокотемпературной обработкой природных и синтетических волокон в среде водяного пара или СО2 при 600 – 1000 0С. Углеродистые волокнистые адсорбенты имеют удельную поверхность 500 – 2000 м2/г. Такие адсорбенты используются для изготовления средств индивидуальной защиты органов дыхания. Они нашли широкое применение в медицине для очистки крови и других биологических жидкостей, а также
вповязках при лечении ран и ожогов. В качестве лекарственного средства этот адсорбент используется при отравлениях (поглотитель ядов).
Цеолиты – специально прогретые белые, иногда бесцветные порошки алюмосиликатов, являются молекулярными ситами – микропористыми материалами, способными избирательно поглощать вещества, размеры молекул которых меньше размеров микропор. Цеолиты используют
впромышленности для выделения и очистки химических соединений.
Для получения синтетических цеолитов алюмосиликатные горные породы быстро нагревают при высокой температуре, в результате чего алюмосиликаты превращаются в пузырчатый материал, насыщенный микропорами.
Природные и синтетические цеолиты способны избира-
37 |
38 |
тельно поглощать вещества. Благодаря такому свойству в зону адсорбционной полости попадает только определенный сорт молекул.
Порошки силикагеля (аморфная форма оксида кремния) имеют удельную поверхность 5 – 800 м2/г. Силикагель как адсорбент применяют для осушки газов и органических жидкостей от влаги. Бумажные пакетики с силикагелем можно обнаружить в упаковке бытовых приборов. Они положены туда с целью защиты приборов от сырости.
Ионообменные смолы используют для умягчения воды, используемой в теплоснабжении. Известно, что растворимые в воде соли Ca(НСО3−)2 и Mg(НСО3−)2 при нагревании распадаются с образованием нерастворимых в воде осадков CaСО3 и MgСО3, покрывающих внутренние стенки котлов и трубопроводов. Прежде, чем использовать жесткую воду в качестве теплоносителя, её с помощью ионообменных смол освобождают от ионов Ca2+ и Mg2+.
Краткий итог темы
1.Любое конденсированное тело содержит в поверхностном слое микрочастицы, равнодействующая сил межмолекулярного (ионного) взаимодействия которых направлена внутрь тела, что создает поверхностное натяжение.
2.Следствием межмолекулярного взаимодействия на поверхности раздела фаз являются такие процессы, как смачивание, адгезия и адсорбция.
3.Для проявления смачивания необходимо, чтобы жидкость вступала во взаимодействие с твердым телом в присутствии газа или другой жидкости, которая не смешивается с первой.
4.Явление адгезии (прилипания) наблюдается в случае, когда между телами реализуется преимущественно ван-дер-ваальсово взаимодействие или водородные связи.
Два тела прилипают при контакте поверхностями в результате уменьшения энергии поверхностного натяжения.
5.Физическая адсорбция – процесс концентрирования вещества на поверхности, который осуществляется под действием сил Ван дер Вальса или в результате образования водородных связей.
6.Химическая адсорбция отличается от физической адсорбции необратимостью вследствие того, что адсорбат участвует в химической реакции с активными центрами поверхностного слоя адсорбента.
7.Ионная адсорбция происходит в результате обратимого ионного обмена.
Термины для запоминания
Адгезив – тело, которое прилипает.
Адгезия – это прилипание находящихся в контакте поверхностей разной природы.
Адсорбат – адсорбированное вещество.
Адсорбентом называется тело, на поверхности которого происходит концентрирование вещества из объема. Адсорбтивом называется вещество, которое находится в объеме жидкой или газовой фазы, способное адсорбироваться на поверхности.
Адсорбция – концентрирование вещества на поверхности раздела фаз.
Активные (активированные) угли приготавливают спе-
циальной обработкой каменного и древесного угля. Получают пористые крупнозернистые порошки с удельной поверхностью 200 – 450 м2/г.
Волокнистые углеродистые адсорбенты имеют удель-
ную поверхность 500 – 2000 м2/г. Используются для изготовления средств индивидуальной защиты органов дыхания.
39 |
40 |
