
6222
.pdf11
Выполнение работы:
Опыт №1: Окислительные свойства KMnO4.
В три пробирки помещают по 5-6 капель раствора KMnO4. В первую – добавляют 3 капли раствора H2SO4 (1:1), во вторую – такое же количество 2М раствора KOH, в третью – дистиллированную воду. Затем в каждую пробирку по каплям вводят 0,1М раствораNa2SO3.
а) Зафиксируйте наблюдаемые внешние эффекты.
б) Запишите ионные и молекулярные уравнения протекающих реакций, используя метод полуреакций.
Задание 8. В какой среде (кислой, щелочной, нейтральной) перманганат калия является более сильным окислителем?
Опыт №2: Взаимодействие Cr3+ с пероксидом водорода (H2O2).
В пробирку помещают 5-6 капель 1М раствора нитрата хрома(3), добавляют 2М раствор KOH до растворения выпадающего осадка Cr(OH)3:
Cr(NO3)3+ 3KОН = Cr(OH)3↓ + 3KNO3
Cr(OH)3 ↓+ KОН = K[Cr(OH)4] тетрагидроксохромат (3) калия Отметьте изменение окраски по мере протекания реакций. Докажите, чтоыые реакции не относятся к ОВР.
Краствору тетрагидроксохромат (3) калия добавляют по каплям раствор пероксида водорода (H2O2) до образования раствора коричнего цвета. Расставьте коэффициенты в уравнение реакции методом полуреакций:
[Cr(OH)4]- + ОН- + H2O2 → CrO42- + H2O
Кполученному раствору добавляют 5-6 капель эфира, аккуратно встряхивают содержимое пробирки, чтобы эфирный слой окрасился в коричневый цвет. После расслоения эфира и водного раствора осторожно по каплям вводят 2М раствор H2SO4 для нейтрализации избытка KOH. При этом хромат переходит в бихромат: 2CrO42- + 2H+ ↔ Cr2O72- + H2O
Ккакому типу взаимодействий относится эта реакция?
12
Если в растворе остался избыток H2O2, то он начинает окислять Cr2O72-
до надхромовой кислоты (H3CrO8), о чём сигнализирует появление синей окраски водного слоя. Так как H3CrO8 в водном растворе неустойчива, то после появления синей окраски в водном слое, надхромовая кислота экстрагирует из водного слоя в эфирный.
Подберите коэффициенты в уравнение реакции окисления бихромат-
иона до надхромовой кислоты методом полуреакций:
Cr2O72- + H2O2 + H+ → H3CrO8 + H2O
Эта реакция служит для идентификации соединений хром (Cr3+; CrO42-; Cr2O72-) в водных растворах, т.е. является качественной реакцией на хром.
Задание 9. Какое соединение KMnO4 или K2Cr2O7 является более сильным окислителем? Может ли перманганат калия взаимодействовать с пероксидом водорода в кислой среде? Если вы затрудняетесь ответить на эти вопросы,
изучите раздел 4 данного методического пособия.
4. Окилительно-восстановительный потенциал
Мерой окислительной или восстановительной способности веществ в водных растворах является окислительно-восстановительный потенциал
(редокспотенциал). Редокспотенциал – это потенциал инертного электрода,
опущенного в раствор, содержащий окисленную или восстановленную формы одного и того же вещества. Например, платиновый электрод,
погруженный в раствор смеси ионов Fe2+ и Fe3+ равных концентраций, имеет потенциал +0,77 В; в растворе, содержащий ионы MnO4- и Mn2+ (кислая среда) потенциал +1,52 В.
Величины редокспотенциалов измерены относительно нормального водородного электрода, потенциал которого условно принят равным нулю.
Редокспотенциалы, измеренные при концентрациях всех участников реакции, равных 1 моль/л, называются стандартными редокспотенциалами
(Е0 ок./восст.). Их значения сведены в таблице окислительно-восстановительных
13
потенциалов (см. «Справочник химика», «Справочник по аналитической химии», «Справочник электрохимических величин» и т.п.).
Пользуясь таблицей редокспотенциалов, можно получить следующую информацию:
1.Сравнить окислительно-восстановительную способность разных веществ в водных растворах;
2.Установить, окислителем или восстановителем является вещество в данной реакции;
3.Установить, как изменяется величина потенциала данного вещества в зависимости от характера среды;
4.Установить, какое число электронов участвует в окислительно-
восстановительном процессе;
5.Предсказать, возможна данная реакция или нет, в каком направлении она будет протекать;
6.Определить, какие вещества будут реагировать в первую очередь, и какие продукты образуются;
7.Быстро и точно составить уравнение окислительно-
восстановительной реакции;
8.Вычислить ЭДС реакции.
При сравнении редокспотенциалов разных пар необходимо помнить,
что численное значение редокспотенциалов относится к процессу восстановления, т.е. характеризует окислительную способность вещества
Ок.1 + n ē = Восст., Е0 ок./восст.
Например, полуреакции Cr2O72- + 14H+ + 6 ē = 2Cr3+ + 7H2O cоответствует редокспотенциал Е0 (Cr2O72-/2Cr3+) = +1,33 В
Для полуреакции SO42- + 4H+ + 2 ē = H2SO3 + H2O Е0(SO42-/SO32-) = +0,17 В.
Сравнивая редокспотенциалы Cr2O72-/2Cr3+ и SO42-/ SO32- можно сделать вывод, что бихромат-ион является более сильным окислителем, чем сульфат-
ион.
14
В реакции между этими парами первая будет окислителем, а вторая – восстановителем: Cr2O72- + H2SO3 + 2H+ = 2Cr3+ + 3SO42- + 4H2O
С помощью величин редокспотенциалов можно судить о возможности протекания и направления редокспотенциалов.
Окислительно-восстановительная реакция протекает самопроизвольно
втом направлении, в котором электродвижущая сила (ЭДС)
электрохимического элемента, составленного из двух окислительно-
восстановительных электродов (полуэлементов) имеет положительное значение.
ЭДС = Еок. – Евосст.,
где Еок. – электродный потенциал, возникающий в результате протекания процесса восстановления окислителя (потенциал катода); Евосст. –
электродный потенциал, возникающий в результате протекания процесса окисления восстановителя (потенциал анода).
Между ЭДС электрохимического элемента и изменением энергии Гиббса окислительно-восстановительной реакции, протекающей в нем,
существует соотношение:
Gr = – n F E , где
E – ЭДС электрохимического элемента, В; F – постоянная Фарадея (F =
96500 Кл/моль = 96500 Дж/В моль); n – число электронов, переносимых в окислительно-восстановительной реакции.
Для стандартных условий:
Gr0 = – n F E0
Пример: сделайте вывод о возможности самопроизвольного протекания при стандартных условиях реакции:
2Br-(р-р) + F2(г) = Br2(ж) + 2F- (р-р)
Решение: представим данную окислительно-восстановительную реакцию в виде двух полуреакций и найдём для каждой (по таблице
«Стандартные окислительно-восстановительные потенциалы») значения стандартных потенциалов: Е0ок. и Е0восст.

15
2Br-(р-р) – 2 ē = Br2(ж), Е0 (Br2/ Br-) = 1,09 – анод, в-ль F2 (г) + 2 ē = 2F- (р-р), Е0 (F2/ F-)= 2,87 – катод, ок-ль
2Br-(р-р) + F2 (г) = Br2(ж) + 2F- (р-р)
Е0 = Е0ок. - Е0восст. = 2,87 – 1,09 = 1,78 (В)
В реакции происходит перенос двух электронов (n = 2) Gr0 = -n F E0.
Gr0 = -2·96500·1,78 = -3,44·105 Дж = -344 кДж
Вывод: реакция окисления бромид-иона фтором идёт самопроизвольно при стандартных условиях, т.к.
Gr0 < 0; E0 > 0.
Стандартное изменение энергии Гиббса реакции связано с константой равновесия реакции уравнения:
Gr0 = -2,3 R T lgK,
следовательно
-n F E0 = -2,3 R T lgK, E0 = 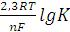
Если Т=298 К, R =8,31 Дж/моль·К, F = 96500 Кл/моль, то
E0 =
K= 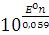
Задание 10. Вычислите константу равновесия при Т=250С реакции:
O2(г) + 4H+(р-р) + Fe2+(р-р) = 4Fe3+ + 2H2O
Сделайте вывод об устойчивости ионов Fe2+ в водном растворе,
содержащим кислород.
Ответ: К = 2·1031
16
Лабораторная работа №2
Определение активного хлора в хлорной извести
Цель работы: определить процентную концентрацию активного хлора в хлорной извести.
Активный хлор хлорсодержащих соединений определяется по количеству газообразного хлора, эквивалентному количеству кислорода,
выделяющегося при разложении этих соединений. Хлор, не участвующий в окислении органических и неорганических примесей, называется связанным.
Содержание активного хлора в товарной хлорной извести должно быть не менее 30 %. Бактерицидное действие хлорной извести основано на реакции взаимодействия её с водой: 2CaCl2O + 2H2O = CaCl2 + 2HClO + Ca(OH)2
Образующаяся хлорноватистая кислота (HClO) окисляет энзимы бактерий.
Количество хлора, идущее на окисление органических и неорганических примесей, определяет величину хлорпоглощаемости природной воды. Дозу обеззараживающего реагента выбирают таким образом, чтобы после окисления всех примесей в воде оставалось некоторое его избыточное количество – так называемый остаточный хлор.
Остаточный хлор в питьевой воде при предварительном осветлении воды определяют каждый час. Активный хлор в хлорсодержащих соединениях, остаточный хлор в питьевой воде и хлорпоглощаемость воды источника водоснабжения определяют методом иодометрии.
Определение основано на взаимодействии хлорной извести с йодидом калия в кислой среде. Активный хлор взаимодействует с йодидом калия,
вытесняя эквивалентное количество свободного йода. Выделяющийся йод оттитровывают раствором тиосульфата крахмала.
Реакции: CaCl2O + H2SO4 = CaSO4 + Cl2 + H2O Реакции при подготовке
Cl2 + 2KI = I2 |
+ 2KCl |
пробы к титрованию |
I2 + 2Na2S2O3 |
= Na2S4O6 + 2NaI |
Реакция, идущая при титровании |
17
Ход работы.
В коническую колбу емкостью 250 мл пипеткой отбирают 2 мл 1% -
ного раствора хлорной извести, приливают 50 мл дистиллированной воды, 2
мл 2Н раствора серной кислоты и 5 мл 10% - раствора йодида калия.
Выделившийся йод отфильтровывают 0,05 Н раствором тиосульфата натрия до слабо-жёлтой окраски. Затем приливают 1 мл раствора крахмала и дотитровывают пробу, осторожно добавляя по каплям раствор тиосульфата натрия до исчезновения синей окраски йодкрахмального комплекса.
Расчёт: процентную концентрацию активного хлора в приготовленном растворе хлорной извести (Х1) рассчитывают по формуле:
Х1 = 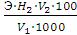
где: V2 – объем раствора тиосульфата натрия, пошедшего на титрование пробы, мл; H – нормальность раствора тиосульфата натрия, экв/л; V1 – объём раствора хлорной извести, взятый на анализ, мл; Э - эквивалентная масса Cl2
, г/экв.
Процентная концентрация активного хлора в товарном продукте (Х2):
Х2 = 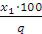
q – процентная концентрация приготовленного раствора хлорной извести.
По учебнику Н. Б. глинка «Общая химия» изучите главу «Кислородные соединения хлора». В отчёте по работе приведите конспект изученного материала. Какое из соединений хлора является более сильным окислителем?
5. Электрохимические реакции. Электролиз
Процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов,
объединяются общим названием – «электролиз».
18
При электролизе могут происходить одновременно несколько химических и электрохимических реакций. Особенность процессов электролиза – пространственное разделение реакций окисления и восстановления.
Основными процессами на электродах при электролизе водных растворах являются: на катоде – выделение водорода (Н2), восстановление ионов металлов с электрохимическим осаждением металлов на поверхности электрода (Мn+р-р + ne- = Mкр); на аноде – окисление вещества (выделение кислорода, галогенов и др.) или электрохимическое растворение металлов.
Ккатодным процессам восстановления ионов металлов,
сопровождаемым осаждением твёрдой фазы, относятся так называемые процессы электрокристаллизации металлов. Их используют для электрорафинирования металлов, для нанесения покрытий из одних металлов на поверхность других (гальваностегия), для металлизации неметаллических покрытий.
В химии водоподготовке эти процессы используют при очистке сточных вод гальванических производств от ионов цинка, никеля, меди,
кадмия и др., для электрохимического восстановления органических веществ,
при электрофлотационной очистке сточных вод; для обессоливания и опреснения природных вод методом электролиза.
Предлагаем Вам изучить один из вариантов метода очистки сточных вод цехов гальванопокрытий от ионов никеля. Необходимость очистки связана с тем, что при концентрации ионов никеля в водных средах равной 1
мг/л и выше заметно увеличивается мутность воды, 50 мг/л – придаёт воде металлический вкус, при 1000 мг/л – вода приобретает окраску. В водоёмах хозяйственно-питьевого назначения ПДК никеля = 0,1 мг/л, в
рыбохозяйственных водоёмах ПДК никеля = 0,01 мг/л.
Предполагается, что никель является канцерогенным веществом и аллергеном, вызывающим никелевую экзему и никелевую чесотку, т.к.
всасывается кожей.
19
В сточных водах, поступающих на сооружения биологической очистки, в нашей стране установлена ПДК никеля 1 мг/л. В неочищенных сточных водах различных предприятий концентрация его может достигать
400 мг/л, а иногда и 1240 мг/л.
Лабораторная работа №3
Электрокристаллизация никеля из сточных вод цехов
гальванопокрытий.
Цель работы: изучить процесс электрокристаллизации никеля из вводных растворов.
1. Установка для электролиза растворов никелирования Установка состоит из: электрической ячейки (5), в которую входят катод (1),
два анода (2), крышка ячейки с тремя прорезями для электродов и отверстия для термометра (4), термометра (3), магнитной мешалки (6), соединительных проводов (7), выпрямителя (8).
Экспериментальная часть:
1. Подготовка электродов к работе.
Катод тщательно зачистить шкуркой, обезжирить ацетоном,
высушить, обмотать 20% - серной кислотой, промыть дистиллированной водой, высушить над плиткой, взвесить. Массу катода записать в таблицу.
До рабочей части катода не дотрагиваться!
2. Сборка электрохимической ячейки и подготовка установки к работе.
Обработанный и взвешенный катод опускают в центральный прорез крышки, а два анода – в боковые прорези. Закрепляют электроды фиксаторами.
Наливают в стакан 300 мл сточной воды с известной концентрацией ионов никеля. Определяют рН среды, записывают в таблицу.
Электроды, смонтированные на крышке, опускают в стакан со сточной водой. Электрохимическую ячейку ставят на магнитную мешалку,
включают её. По площади погруженного катода рассчитывают силу тока,
20
необходимую для проведения процесса электролиза, исходя из того, что она должна быть 2 А/дм2.
3. Проведение электролиза.
Включают выпрямитель в сеть, устанавливают регулятором рассчитанную силу тока. Записывают в таблицу время начала проведения опыта, силу тока, напряжение.
Через 20 минут выключают выпрямитель, замеряют рН, вынимают катод, промывают его дистиллированной водой, высушивают над плиткой,
охлаждают, взвешивают. Результаты эксперимента заносят в таблицу:
Время. |
Т, 0С |
РII |
I, A |
U, B |
Mk, г |
η, % |
W, Вт |
СNi2+, |
∆mNi, |
мин |
|
|
|
|
|
|
с/г |
г/л |
г |
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Обработка результатов эксперимента.
После проведения эксперимента рассчитывают выход по току (ῃ),
удельные энергозатраты (W), остаточную концентрацию ионов никеля в растворе (СNi2+). Исходную концентрацию ионов никеля в растворе узнают у преподавателя.
Выход по току рассчитывают по формуле:
η = 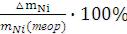 ; ∆mNi(теор) =
; ∆mNi(теор) = 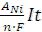
где ∆mNi – масса выделившегося на катоде никеля, г; I – сила тока, А; t – время, сек; A – атомная масса никеля, г/моль; F – число Фарадея,
95600 Кл/моль; n – число электронов, участвующих в полуреакции восстановления ионов никеля на катоде: Ni2+(р-р) + 2е- = Ni(кр) n = 2.
Удельные энергозатраты определяют по формуле:
W = 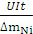 , Вт сек/г
, Вт сек/г
где U – напряжение, В; I – сила тока, А; t – время, сек
∆mNi – масса выделившегося на катоде никеля, г
Остаточную концентрацию ионов никеля в сточной воде определяют следующим образом:
