
5909
.pdfМИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования
«Нижегородский государственный архитектурно-строительный университет»
Е.А. Моралова, М.А Патова
Биохимия, биофизика и физико-химические основы жизнедеятельности
Учебно-методическое пособие
по выполнению лабораторных работ по дисциплине «Биохимия, биофизика и физикохимические основы жизнедеятельности» для обучающихся по направлению подготовки 05.03.06 Экология и природопользование,
профиль Прикладная экология и природопользование
Нижний Новгород ННГАСУ
2022
2
УДК 577.1
Моралова Е. А., Патова М.А. Биохимия, биофизика и физико-химические основы жизнедеятельности [Электронный ресурс]: учеб.- метод. пос. /Е.А. Моралова, М.А.Патова; Нижегор. гос. архитектур. - строит. ун - т – Н. Новгород: ННГАСУ, 2022. – 20 с; 1 электрон. опт. диск (CD-RW)
В пособии даются методические рекомендации по выполнению лабораторных работ обучающихся по дисциплине «Биохимия, биофизика и физико-химические основы жизнедеятельности». Работы позволяют полнее усвоить содержание лекционного курса, регламентированного учебной программой, с учетом технических возможностей кафедры экологии и природопользования. Выполнение многих из работ можно организовать в форме научного исследования. Материалы указаний помогают студентам четко формулировать задачи и выбирать способы их решения, а также приобретать умение проводить эксперимент и объяснять его результаты..
Предназначено обучающимся в ННГАСУ для подготовки к лабораторным занятиям по направлению подготовки 05.03.06 Экология и природопользование, профиль Прикладная экология и природопользование.
©Е.А. Моралова, 2022
©М.А. Патова, 2022
©ННГАСУ, 2022.
3
Содержание
Техника безопасности…………………………………………………………………………………4
Химия белков………………………………………………………………………………….....……5
Лабораторная работа № 1 . Качественные реакции на белки. Изучение явлений денатурации и ренатурации белка……………………………………..……………………………...5
Лабораторная работа №2. Качественные и количественные реакции на аминокислоты.
Изучение явления диализа……………………………………………………………………………..6
Лабораторная работа № 3. Определение изоэлектрической точки полипептидной молекулы………………………………………………………………………………………………..8
Химия углеводов……………………………………………………………………………………..10
Лабораторная работа №4. Свойства моно- и дисахаридов. Качественные реакции на моно- и дисахариды………………………………………………………………………………..10
Лабораторная работа № 5. Качественные реакции на полисахариды и декстрины…………...12
Химия липидов……………………………………………………………………………………….13
Лабораторная работа № 6. Качественные реакции на липиды…………………………………..13
Основы биофизики…………………………………………………………………………………...17
Лабораторная работа №7. Регистрация биоэлектрических реакций растительного организма… … … … … … … … … … … … … … … … … … … … … … … … . … … 1 7
Лабораторная работа № 8. Изучение процессов транспорта через мембрану…………….…….18
Список литературы……………………………………………………………………….……….…19
4
Техника безопасности
1.Все работы проводить с разрешения преподавателя.
2.При работе нельзя засасывать жидкие реактивы в пипетку ртом.
3.Работы, связанные с выделением вредных газообразных веществ, а также с использованием концентрированных щелочей и кислот необходимо проводить под тягой.
4.При разливе кислоты необходимо присыпать место разлива песком, а затем нейтрализовать раствором соды.
5.При разливе щелочи необходимо место разлива промыть большим количеством воды, а затем нейтрализовать раствором уксусной кислоты.
6.При попадании кислоты на руки необходимо промыть руки большим количеством воды, а затем нейтрализовать пораженный участок кожи раствором соды.
7.При попадании на руки щелочи необходимо промыть руку большим количеством воды, а затем нейтрализовать уксусной кислотой.
8.При аварийной ситуации связанной с битьем посуды необходимо убрать осколки стекла, а место пролива необходимо нейтрализовать раствором соды или уксусной кислоты.
9. При ожоге необходимо дезинфицировать обожженное место раствором перманганата калия, а затем обработать обожженное место жирным кремом.
10.Приборы, задействованные в эксперименте, должны быть заземлены.
5
Химия белков
Лабораторная работа №1
Качественные реакции на белки. Изучение явлений денатурации и ренатураци белка
Пояснения. При качественном обнаружении белков используются биуретовая и ксантопротеиновая реакции.
Биуретовая реакция - это реакция на пептидные связи. В присутствии CuSO4 в щелочной среде атомы азота пептидной связи образуют окрашенный в пурпурный цвет комплекс с ионами меди.
Ксантопротеиновая реакция - это реакция на циклические аминокислоты фенилаланин и тирозин. Эти аминокислоты содержат в боковом радикале бензольные кольца.
Реактивом на ароматические аминокислоты является концентрированная азотная кислота. В процессе нагревания раствора белка с кислотой наблюдается желто-оранжевое окрашивание, которое обусловлено нитрованием бензольных колец, входящих в состав циклических аминокислот белка.
Денатурацией называется процесс утраты белком своей третичной структуры. При этом молекула белка теряет способность выполнения биологических функций. Если денатурация неглубока, то белок при определенных физико-химических условиях может восстановить свою нативную структуру. Этот процесс называется ренатурацией. Таким образом, денатурация может быть обратимой и необратимой.
Денатурацию могут вызвать следующие факторы: нагревание, излучения, сильные кислоты или щелочи, тяжелые металлы, органические растворители и детергенты.
Цель работы - ознакомиться с качественными реакциями на белки, а также факторами вызывающими их денатурацию и ренатурацию.
Материалы и оборудование: пипетки, пробирки, стеклянные колбы, химические стаканы, 5% раствор КОН, 1% раствор CuSO4 концентрированная азотная кислота, 40% раствор NaCl, яичный альбумин, водяная баня.
Ход работы. Осторожно проделать в скорлупе куриного яйца отверстия с двух сторон. Вылить белок в стакан вместимостью 0,5 литра и добавить к нему 250 мл дистиллированной воды. Затем, содержимое перенести в мерный цилиндр и довести до 300 мл дистиллированной водой, после чего оставить раствор на 30 минут для образования хлопьевидного осадка глобулинов. Полученную суспензию фильтруют через складчатый фильтр и используют для выполнения качественных реакций на белки.
Впервую пробирку к 2 мл раствора белка добавить равный объем 5% раствора КОН и перемешать. После чего к содержимому пробирки добавить 2 капли 1% раствора CuSO4 и перемешать еще раз. Наблюдать развивающуюся пурпурную окраску (биуретовая реакция).
Во вторую пробирку к 2 мл раствора белка добавить несколько капель концентрированной азотной кислоты. Происходит процесс денатурации белка. Затем эту пробирку поставить на водяную баню и нагревать в течение 1-2 минут. При этом наблюдается оранжево-желтое окрашивание.
Втретью пробирку к 2 мл раствора белка добавляем 2 мл 40% раствора NaCl. Наблюдаем денатурацию белка. Однако после добавления в эту же пробирку 12 мл дистиллированной воды происходит ренатурация белка (раствор в пробирке становится светлым).

6
Лабораторная работа № 2
Качественные и количественные реакции на аминокислоты. Изучение явления диализа
Пояснения. Наиболее распространенной в аналитической практике реакцией на серу, содержащуюся в белках, является реакция Фоля. Реакция обусловлена присутствием в белке таких аминокислот как цистеин и метионин. Реакция протекает в несколько стадий.
При нагревании в присутствии едкой щелочи (NaOH) цистеиновые остатки разрушаются с образованием сульфида натрия. Затем при реакции плюмбита натрия с сульфидами образуется осадок сульфида свинца, окрашенный в черный цвет.
Рисунок 1. Схема протекания реакции Фоля
1) CH2-SH |
СН2ОН |
|
||||
|
|
|
|
|
|
|
CH-NH2 + 2NaOH |
CH2 |
|
NH2 + Na2S + H20 |
|||
|
||||||
|
|
|
|
|
|
Сульфид |
СООН |
СООН |
натрия |
||||
Цистеин |
|
Серин |
|
|||
2) (CH3COO)2Pb + 2NaOH Pb(ONa)2 + 2CH3COOH |
||||||
Ацетат свинца |
|
Плюмбит |
||||
|
|
|
|
натрия |
||
3) Na2S + Pb(ONa)2 + 2H2О |
PbS + 4NaOH |
|||||
Сульфид |
|
|
|
Сульфид |
||
натрия |
|
|
|
свинца |
||
Однако не все пептидные соединения дают такую окраску. Например, желатин, который не содержит серосодержащих аминокислот, такой окраски не дает.
Для количественного определения аминокислот в аналитической практике используется реакция с нингидрином, которая протекает в 2 стадии.
Рисунок 2. Схема протекания реакции с нингидрином
1) R |
|
O |
R |
|
O |
|
|
OH |
|
|
OH |
CH |
NH2 + |
C H + CO2 |
+NH3 + |
||
|
|
OH |
|
|
OH |
COOH |
O |
O |
|
O |
|
|
|
Окисл. |
|
|
Вос. нингидрин |
|
|
нингидрин |
|
|
|
2) |
О |
|
О |
О |
О |
|
|
ОН |
НО |
|
|
|
|
+ NH3 + |
|
|
N |
|
|
ОН |
НО |
|
|
|
О |
|
О |
О |
О |
Диализ - процесс разделения высоко- и низкомолекулярных компонентов смеси на полупрнцаемой мембране. Высокомолекулярные соединения не могут проникать через мембрану, в то время как низкомолекулярные ионы способны ее преодолевать. Диализ можно ускорить, увеличивая температуру смеси, применяя проток воды, а также электрический ток.
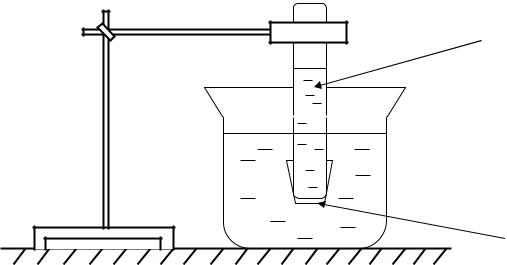
7
Рисунок 3. Схема проведения диализа белково-солевой смеси
Белково-солевая смесь
Дистиллированная  смесь
смесь
Полупроницаемая
мембрана
Цель работы - познакомиться с качественной реакцией на аминокислоты, содержащие серу, а также с реакцией количественного определения аминокислот с помощью нингидрина, изучить явление диализа и определения вязкости нативного и денатурированного белка.
Материалы и оборудование: яичный альбумин, раствор ацетата свинца, раствор сульфата аммония, раствор хлорида бария, реактив Несслера, пробирки, целлофановая пленка, вискозиметр Оствальда, 1% раствор нинигидрина в ацетоне.
Ход работы. Реакцию на серосодержащие аминокислоты проводят с раствором яичного альбумина и с раствором желатины.
В первой пробирке смешиваем 2 мл раствора желатина, 2 мл 20% раствора КОН, 2 мл раствора ацетата свинца. Во второй пробирке смешиваем 2 мл раствора яичного альбумина, 2 мл 20% раствора КОН и 2 мл раствора ацетата свинца. Обе пробирки нагреваем на водяной бане и наблюдаем образование осадка.
Реакцию с нингидрином изучают путем смешения в пробирке 2 мл раствора белка с 2 мл 1% раствора нингидрина на ацетоне. Содержимое пробирки нагревают на водяной бане при 90о С. В результате должно образоваться соединение пурпурного цвета.
Для проведение реакции диализа в пробирку с раствором яичного альбумина прибавляют раствор (NH4)2SO4. Пробирку закрывают целофановой пленкой, зажимают в штативе в перевернутом виде и помещают в стакан с дистиллированной водой. Через 30 минут с содержимым пробирки и стакана проводят качественные реакции на белок (биуретовая реакция), на ионы NH4 (с реактивом Несслера) и на ионы SO4 (с ВаС12). Объяснить разницу в результатах проведенных реакций.

8
Лабораторная работа № 3
Определение изоэлектрической точки полипептидной молекулы
Пояснения. Конформация полипептидной молекулы зависит от рН среды. Важной характеристикой белка, влияющей на его конформацию является изоэлектрическая точка белка
(ИЭТ).
ИЭТ белка - это такое значение рН раствора, при котором количество ионизированных основных групп равно количеству ионизированных кислотных групп. В изоэлектрической точке молекула белка электронейтральна. При изменении рН в кислую сторону подавляется диссоциация кислотных групп (молекула становится электроположительной). При изменении рН в щелочную сторону подавляется диссоциация основных групп (молекула становится k электроотрицательной).
Рисунок 4. Диссоциация аминокислот при разных значениях рН
Н+
1. Кислая среда R-CH-COOH  R-CH-COOH
R-CH-COOH
NH2 |
NH3 |
|
OH- |
2. Щелочная среда R-CH-COOH  R-CH-COO-
R-CH-COO-
NH2 |
NH2 |
При избытке НСl или КОН молекула свертывается в более плотный клубок.
Действие любой из нейтральных солей приводит к подавлению диссоциации ионогенных групп макромолекулы белка. При большой концентрации нейтральных солей сказывается высаливание. Высаливание снижает вязкость белкового раствора. Таким образом в изоэлектрической точке белка наблюдается минимум вязкости и светопропускания белкового раствора.
Кривая зависимости светопропускания от рН имееют седлообразную форму.
Это можно объяснить следующим образом. В изоэлектрической точке белка макромолекулы теряют заряд и становятся электронейтральными. Нейтральные макромолекулы приобретают способность к ассоциации. Это приводит к увеличению размеров частиц. Увеличение размеров частиц ведет к снижению светопропускания.
Цель работы - определить изоэлектрическую точку молекулы желатина.
Матедоалы и оборудование: 1% раствор желатина, 0,1 н. раствор КОН, 0,1 н раствор НСl, рН-метр-340, фотоэлектрический колориметр ФЭК-2, пипетки, мерные колбы.
Ход работы. В 1 литре дистиллированной воды растворяем 1 грамм кристаллического желатина. Приготовленный раствор фильтруем в горячем виде через складчатый фильтр. Затем раствор охлаждаем. Берем 5 мерных колб объемом по 50 мл. В первую колбу ничего не добавляем. Во вторую -добавляем 0,25 мл 0,1 н КОН, в третью - 0,5 мл 0,1 н КОН, в четвертую -
0,25 мл 0,1 н НС1, в пятую - 0,5 мл 0,1 н НС1.
Растворы в мерных колбах доводят до метки водой и перемешивают. Затем измеряют величину рН каждого раствора на рН-метре и светопропускание на фотоэлектроколориметре. Результаты измерений заносят в таблицу, изоэлектрической точке соответствует такое значение рН раствора, при котором значение светопропускания минимально. Строят также график зависимости светопропускания от рН.

9
Таблица 1 Величины рН и процент светопропускания в зависимости от состава исследуемого
раствора
Состав раствора |
Значения рН |
% светопропускания |
|
|
|
|
|
|
Химия углеводов
Лабораторная работа №4
Свойства моно- и дисахаридов. Качественные реакции на моно- и дисахариды
Пояснения. Углеводы являются соединениями, обладающими спиртовой группировкой, а также карбонильной группой (альдегидной или кетонной). Все углеводы разделяют на три основные группы: моно -, олиго-, и полисахариды.
Среди моносахаридов различают альдозы и кетозы. Моносахариды можно рассматривать как производные многоатомных спиртов, содержащих карбонильную группу. Простейшими представителями моносахаридов являются триозы: глицеральдегид и дигидрооксиацетон
(рис.5).
По количеству углеродных атомов в цепи, углеводы делят на триозы (три атома), тетрозы (четыре), пентозы (пять), гексозы (шесть), седогептулезы (семь). Атомы углерода в цепи нумеруют начиная с альдегидной или кетонной группировки.
Рисунок 5. Строение альдоз и кетоз |
|
|
||
|
СН2ОН |
|
|
|
|
|
|
|
|
|
СНОН |
Глицерин |
||
|
СН2ОН |
|
|
|
H-C=O |
CH2OH |
|||
|
|
|
|
|
CHOH |
C=O |
|||
|
|
|
|
|
CH2OH |
CH2OH |
|||
Глицеральдегид (альдоза) |
Дигидрооксиацетон (кетоза) |
|||
Все моносахариды обладают стереоизомерией и могут принадлежать к D и L-рядам. Природные сахара являются D-изомерами.

|
|
|
|
|
|
10 |
|
|
|
|
|
Рисунок 6. L и D-изомеры Сахаров |
|
|
|
|
|
|
|||||
|
|
COH |
|
|
COH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
OH |
HO |
|
C |
|
H |
||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|
|
CH2OH |
||||||
D-Глицеральдегид |
L-Глицеральдегид |
||||||||||
Углеводы, обладающие свободными альдегидными и кетонными группировками способны восстанавливать медь из щелочных растворов до оксида меди. При этом раствор приобретает кирпично-красный цвет. Для качественного обнаружения углеводов применяют реактив Фелинга (смесь растворов сульфата меди, гидроксида калия и сегнетовой соли).
Углеводы также можно обнаружить по реакции Подобедова-Молиша. Это реакция раствора углевода с раствором α-нафтола в присутствии концентрированной серной кислоты. В результате реакции с α-нафтолом образуется продукт конденсации красно-фиолетового цвета. Данная реакция является универсальной. Так реагируют все углеводы , включая нерастворимые.
Широко используется также реакция осмоления (карамелизации). Эта реакция, обусловлена свойством альдегидов, конденсироваться со щелочами при нагревании. В результате образуются смолообразные продукты со своеобразным запахом карамели. Окраска продуктов конденсации изменяется от желтой до коричневой. Интенсивность окраски пропорциональна концентрации образующегося продукта. Поэтому данную реакцию можно использовать для количественного обнаружения углеводов.
Цель работы - познакомиться с качественными реакциями на моно- и дисахариды.
Материалы и оборудование: лабораторная посуда, технические весы, 2% растворы глюкозы и сахарозы, реактив Фелинга, 10% спиртовой раствор α-нафтола, 1% раствор КОН, концентрированная H2S04.
Ход работы. Для проведения реакции с жидкостью Фелинга в 2 пробирки прилить по 5 мл раствора глюкозы и сахарозы, затем прибавить по 2 мл реактива Фелинга и нагревать в водяной бане до выпадения осадка. Результаты пояснить
Для проведения реакции Подобедова-Молиша в 2 пробирки прилить по 1 мл растворов глюкозы и сахарозы и добавить по 2 капли 10% спиртового раствора α-нафтола. Затем осторожно по стенкам прилить не перемешивая концентрированную серную кислоту. В результате протекания реакции образуется кольцо красно-фиолетового цвета. Это свидетельствует о наличии углеводов в растворе.
Для проведения реакции осмоления (карамелизации) в пробирки приливают по 5 мл 0,5% и 2% раствора глюкозы. Затем добавляют по 2 мл 10% раствора КОН и нагревают до изменения окраски. В зависимости от концентрации глюкозы содержимое пробирки становится желтым или светло-коричневым.
Лабораторная работа № 5
Качественные реакции на полисахариды и декстрины
Пояснения. Полисахариды широко распространены в природе и выполняют многочисленные функции, в том числе структурную (входят в состав клеточной стенки и мембран) и энергетическую (являются запасными питательными веществами растительных и животных клеток). Наиболее распространенным полисахаридом, имеющим растительное
