
книги / Химия окружающей среды
..pdfОтвет: время полувыведения оксида азота при его взаимодействии с кислородом и озоном составляет 150 лет и 1,7 мин соответственно. В приземном воздухе процесс окисления NO в основном протекает при участии озона.
ПРИМЕР 1.15. Какое максимальное количество молекул озона может образоваться в каждом кубическом сантиметре приземного воздуха при полном окислении метана в присутствии оксидов азота, если концентрация метана уменьшилась с 20 до 1,6 млн–1. Давление равно 101,3 кПа, температура воздуха 288 К.
Решение. При полном окислении метана, в присутствии оксидов азота цепочку превращений можно представить следующим суммарным уравнением реакции:
СН4 + 8О2 + 4М СО2 + 2Н2О + 4М* + 4О3.
При полном окислении каждой молекулы метана в присутствии оксидов азота может образоваться до 4 молекул озона.
При уменьшении концентрации метана в воздухе с 20 до 1,6 млн–1 концентрация образовавшегося озона при отсутствии его стока может составить
[O3] = 4(20 – 1,6) = 73,6 (млн–1).
В каждом кубическом сантиметре воздуха может образоваться n(O3) молекул озона:
n(O3) = NAα(O3) T0/(VM · 103 · Tз) (см–3),
где NА – число Авогадро; α(О3) – объёмная доля озона в воздухе: α(О3) = [О3]10–6, млн–1; VМ – молярный объём газа при нормальных условиях, л; Т0 и Тз – температура воздуха при нормальных условиях и средняя у поверхности Земли (273
и 288 К соответственно); n(O3) = 6,02 · 1023 · 73,6 · 10–6 · 273/ (22,4 · 103 · 288) = 19 · 1014 (см–3).
41
Ответ: в каждом кубическом сантиметре воздуха может образоваться до 19 · 1014 молекул озона.
ПРИМЕР 1.16. Сравните скорости выведения из атмосферы молекул метана при их взаимодействии с гидроксидным радикалом на высотах 5 и 35 км. Концентрация метана изменяется от 2 млн–1 на высоте 5 км до 0,6 млн–1 на высоте 35 км. Энергия активации и предэкспоненциальный множитель константы скорости реакции взаимодействия метана с ОН – радикалом равны 14,1 кДж/моль и 2,3 см3 · с–1 соответственно. Концентрация гидроксидных радикалов соответствует средним для этих высот значениям:
[OH]5 = 8,5 · 105 см–3 и [OH]35 = 3 · 107 cм–3.
СН4 + ОН = СН3 + Н2О.
Скорость реакции можно определить из уравнения
vH = KH [CH4]H [OH]H,
где vH и KH – скорость и константа скорости реакции для условий, характерных для атмосферного воздуха на высоте Н; [CH4] и [OH]H – концентрации молекул метана и гидроксидного радикала на высоте Н.
В соответствии с уравнением Аррениуса константа скорости химической реакции зависит от температуры:
K = Ae–E/RT,
где K – константа скорости химической реакции (размерность определяется единицами измерения концентрации и времени, а также порядком химической реакции); А – предэкспоненциальный множитель (имеет размерность константы скорости реакции); Е – энергия активации реакции, Дж/моль; R – универсальная газовая постоянная, Дж/(моль·К);
Т– температура реакции, К.
Врассматриваемом случае скорость химической реакции будет определяться значениями концентраций реагентов
42
и температурой воздуха на заданных высотах. Температура воздуха на высоте 5 км
Т5 = 288 + (–6,5 · 5) = 256 К,
на высоте 35 км
Т35 = 217 + (35 – 11) · 1,38 = 250 К.
Константа скорости реакции на высоте 5 км составляет:
K5 = 2,3 exp[–14,1 · 103/(8,31 · 256)] = 3,04 · 10–3 (см3 · с–1),
на высоте 35 км
K35 = 2,3 ехр [–14,1 · 1000/(8,31 · 250)] =
= 2,59 · 10–3 (см3 · с–1).
Глава 2
ТРАНСФОРМАЦИЯ СОЕДИНЕНИЙ СЕРЫ В ТРОПОСФЕРЕ
Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65 %. Около 95 % из этого количества составляет диоксид серы [17].
Из природных источников поступления неорганических соединений серы следует выделить волновую деятельность в океанах, которая приводит к образованию аэрозолей. Общее количество серы, содержащейся в аэрозолях в виде сульфатов магния и кальция, оценивается в 44 млн т в год, что составляет примерно 30 % от её поступления в атмосферу в виде неорганических соединений.
Биологические процессы являются источником неорганических соединений серы преимущественно в виде сероводорода, что составляет, по различным оценкам, от 23 до 49 % всех неорганических соединений серы. Масштабы поступле-
43
ния сероводорода в атмосферу и процессы его трансформации в атмосфере изучены ещё недостаточно подробно. Имеющиеся в литературе сведения позволяют лишь грубо оценить его содержание в тропосфере. Так, над океанами концентрация Н2S колеблется от 0,0076 до 0,076 мкг·м–3.
В тропосфере происходят процессы окисления соединений серы, в которых основным окислителем выступают свободные радикалы. Сероводород, например, последовательно, в ряде стадий окисляется до SО2. Детальный механизм этого процесса ещё не установлен. Наиболее вероятным представляется протекание следующих реакций [18]:
Н2S + ОН = Н2О + НS– |
(2.1) |
НS– + О2 = SО + ОН |
(2.2) |
SО + НО2 = SО2 + ОН |
(2.3) |
Полученный в результате диоксид серы, как и SО2, поступающий из других источников, окисляется далее. Механизм этого процесса изучен более подробно. Окисление диоксида серы может протекать в газовой фазе – первый путь, в твердой фазе (окислению предшествует адсорбция) – второй путь и в жидкой фазе (окислению предшествует абсорбция) – третий путь.
Газофазное окисление (первый путь) исторически является первой попыткой объяснить процессы окисления диоксида серы в атмосфере. Долгие годы основной механизм процесса связывали с образованием диоксида серы в возбужденном состоянии, который, реагируя с молекулярным кислородом, образует SО3:
SO2 + hv = SO 2, 290 нм < λ < 400 нм, |
(2.4) |
||
SO2 + 2O2 |
= SO3 |
+ O3 |
(2.5) |
или реакцией с участием третьего тела: |
|
||
SO2 + O2 + М = SO 4 + М |
(2.6) |
||
SO42 + O2 |
= SO3 |
+ O3 |
(2.7) |
44
Образующийся серный ангидрид вступает во взаимодействие с молекулой воды с образованием серной кислоты по следующей реакции:
SO3 + H2O = H2SO4 |
(2.8) |
Рассмотренный механизм является возможным, |
но |
не основным процессом окисления SО2 в газовой фазе. Лабораторные эксперименты показали, что скорость из-
менения концентрации SО2 в фотохимических камерах, содержащих очищенный воздух, описывается кинетическим уравнением первого порядка. Значение константы скорости процесса составляет 10–3 ч–1. Квантовый выход реакции изменяется от 10–3 до 5·10–3.
Процесс окисления SО2 в фотохимических камерах значительно ускоряется, если в воздухе содержатся оксиды азота или углеводороды. В этом случае становится возможным протекание процессов с участием атомарного кислорода и свободных радикалов. Атомарный кислород окисляет молекулу SО2 при участии третьего тела:
SО2 + О + М = SО3 + М |
(2.9) |
Принимая во внимание, экспериментально найденное значение константы скорости этого процесса и концентрацию атомарного кислорода и третьего тела в атмосфере, можно утверждать, что этот процесс следует учитывать только на высоте более 10 км при концентрации SО2, равной 1 мкг·м–3. Время пребывания диоксида серы на высоте 10 км при отсутствии других процессов должно составлять примерно 1000 ч и уменьшаться на высоте 30 км до 5–10 ч.
Реакция окисления SО2 атомарным кислородом не играет существенной роли в трансформации соединений серы в тропосфере; ведущую роль играют свободные радикалы. Протекающие при этом процессы можно представить следующими уравнениями реакций:
SО2 + ОН + М = HSO3 + М |
(2.10) |
45
HSO3 + НО2 = SО3 + 2ОН |
(2.11) |
Скорость трансформации диоксида серы в воздухе, имеющем средние для тропосферы значения концентраций свободных радикалов, соответствует времени пребывания SО2 в тропосфере и составляет 5 суток. Процесс трансформации диоксида серы резко ускоряется в воздухе промышленных регионов, где увеличивается содержание свободных радикалов. Скорость в этом случае может возрасти до 1 % · ч–1.
Триоксид серы – серный ангидрид – легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты, которые, реагируя с аммиаком или ионами металлов, присутствующими в частицах атмосферной влаги, частично переходят в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция.
Твердофазное окисление. Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, присутствующих в воздухе. В этом случае стадии окисления предшествует адсорбция, часто сопровождающаяся химической реакцией (второй путь окисления диоксида серы)
SО2 + СаО = СаSО3 |
(2.12) |
или |
|
SО2 + МgО = МgSО3 |
(2.13) |
Оксиды железа, алюминия, хрома и других металлов, которые также могут находиться в воздухе, резко ускоряют процесс окисления диоксида серы. В присутствии, например, частиц Fe2O3 скорость процесса трансформации SО2 составляет примерно 100% ·ч–1.
Жидкофазное окисление. Третий путь окисления диоксида серы в тропосфере связан с предварительной абсорбцией SО2 каплями атмосферной влаги. В дождливую погоду и при высокой влажности атмосферы этот путь окисления может стать основным в процессе трансформации диоксида
46
серы. В качестве окислителя в природных условиях часто выступает пероксид водорода. При высоких значениях рН скорость окисления заметно возрастает. Конечным продуктом окисления является серная кислота, которая в дальнейшем может перейти в сульфаты:
SО2 + Н2О2 SО3 + Н2О Н2SО4 |
(2.14) |
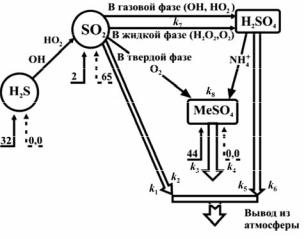
Помимо процессов химической трансформации диоксида серы в серную кислоту и сульфаты сток (вывод из атмосферы) этих соединений происходит в результате процессов мокрого (с атмосферными осадками) и сухого (при контакте с поверхностью почвы, водоёма или с растительностью) осаждения. Схема на рис. 2.1. иллюстрирует тропосферную часть цикла неорганических соединений серы.
Рис. 2.1. Тропосферная часть цикла неорганических соединений серы (в млн т элементной серы в год): сплошная стрелка – природные поступления соединений серы, пунктирная стрелка – антропогенные поступления соединений серы [18]
Скорость процессов трансформации и стока диоксида серы, серной кислоты и сульфатов принято представлять в виде кинетических уравнений первого порядка.
47
Скорость соответствующих превращений без учета процессов окисления в твердой фазе можно выразить следующими уравнениями:
v(SО2) = –d[SО2]/dt = –(K1 + K2 + K7)[SО2] |
(2.15) |
v(Н2SО4) = d[Н2SО4]/dt = K7[SО2] – (K5 + K6 + K8)Н2SО4] |
(2.16) |
v(MeSО4) = d[MeSО4]/dt = |
|
= K7[SО2] – (K5 + K6 + K8)[MeSО4] |
(2.17) |
где t – время; [SО2], [Н2SО4], [MeSО4] – концентрации диоксида серы, серной кислоты и сульфатов соответственно; K1 и K2, K3 и K4, K5 и K6 – константы скорости процессов мокрого и сухого осаждения диоксида серы, сульфатов и серной кислоты соответственно; K7 – константа скорости процесса трансформации диоксида серы в серную кислоту (учитывает общую скорость окисления в газовой и жидкой фазах); K8 – константа скорости образования сульфатов из SО2 и Н2SО4.
Решение системы уравнений позволяет определить долю отдельных компонентов, присутствующих в тропосфере в заданное время после выброса единичного объема диоксида серы в атмосферу. Графическое решение системы уравнений, полученное специалистами Института прикладной геофизики РАН А.В. Лысаком, И.М. Назаровым и А.Г. Рябошапко [19], представлено на рис. 2.2.
Основными формами, в которых сера присутствует в атмосфере, являются сернистый ангидрид (SО2) и сероводород (Н2S) в газовой фазе и сульфат–ион в конденсированной фазе. К значительным биологическим природным источникам Н2S относятся процессы восстановления сульфатного иона бактериями и распада органических веществ в анаэробных условиях. Вулканическая сера поступает в атмосферу в более окисленных формах, чем биологическая. Главным компонентом вулканических выбросов является диоксид серы. Подавляющая часть восстановленной серы окис-
48
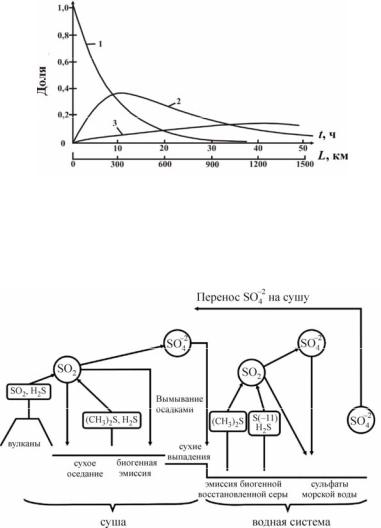
ляется в атмосфере до сульфатов, хотя определенная доля серосодержащих газов выводится путем сухого выведения. На рис. 2.3. представлен глобальный цикл серы.
Рис. 2.2. Зависимость долей серы, представленных в тропосфере в виде диоксида серы, серной кислоты и сульфатов, от времени пребывания в атмосфере t и удаленности от точечного источника выброса L при скорости ветра 30 км/ч: 1 – диоксид серы, 2 – серная кислота, 3 – сульфаты [18]
Рис. 2.3. Глобальный цикл серы [18]
49
Источником значительного количества окисленной серы служит Мировой океан (сульфаты морской воды). Большая часть этих солей тут же выпадает обратно в океан. По кислотности морские сульфаты практически нейтральны, но в результате окисления являются донорами свободных протонов и, таким образом, представляют собой источник загрязнения окружающей среды.
Примеры решения задач по химии тропосферы (сера) [16]
ПРИМЕР 2.1. Определите соотношение скоростей процессов газофазного и жидкофазного окисления SO2 при условии, что основной вклад в эти процессы вносят следующие реакции:
SO2(Г) + OH(Г) HSO3(Г)
SO2(Р – Р) + H2O(Р – Р) H2SO4(Р – Р).
Константы скоростей реакций окисления соответственно равны: K1 = 9 · 10–13 см3 · мол. · с–1; K2 = 1 · 103 л · моль–1 · с–1.
Концентрации примесей в газовой фазе:
[OH] = 5 · 106 cм–3; [SO2] = 10–4 об.%; [H2O2] = 10–7 об.%.
Расчёты провести для атмосферного воздуха, имеющего температуру 25 °С и содержащего: а) 0; б) 0,0001, в) 0,01 г свободной воды в каждом литре воздуха. Считать, что при растворении в воде концентрация SO2 в газовой фазе не меняется. Газы считать идеальными и подчиняющимися закону Генри. Давление принять равным 1 атм. Константы Генри для этих газов при 25 °С составляют:
KГ (SO2) = 5,4 моль / (л · атм)
KГ (Н2О2) = 1 · 105 моль / (л · атм).
Решение. Скорость окисления SO2 в газовой фазе можно определить по уравнению v1 = K1 [OH] [SO2], где K1 – кон-
50
