
книги / Получение и свойства тугоплавких соединений на основе титана
..pdf
Системы TiN–Ni и TiN / Ni–C. Согласно результатам ДТА-ТГ анализа [118], температура появления жидкой фазы в системе
TiN0,95–Ni равна 1440 ± 10 ºC, т.е. мало отличается от температуры плавления чистого никеля (1453 ºC). C отклонением состава
нитрида от стехиометрического она монотонно снижается (рис. 13). Процесс растворения нитрида титана в никеле может быть описан следующими реакционными схемами (на примере двух крайних составов):
TiN0,95 + Ni |
1 ч |
Ni (ℓ) + N2↑ |
|
|
Ni (ℓ) → Ni (Ti ~ 1,5 %) |
(11) |
|||
TiN0,95 + Ni |
3 ч |
Ni (ℓ) + N2↑ |
|
|
Ni (ℓ) → Ni (Ti ~ 3,5 %) |
(12) |
|||
TiN0,95 |
+ Ni |
25 ч |
Ni (ℓ) + N2↑ |
|
a) Ni (ℓ) → Ni (Ti ~ 8,0 %) |
(13) |
|||
TiN0,61 |
+ Ni |
1 ч |
TiN0,67±0,02 + Ni (ℓ) |
|
a) Ni (ℓ) → Ni (Ti ~ 4,5 %) |
(14) |
|||
TiN0,61 |
+ Ni |
3 ч |
TiN0,76±0,02 + Ni (ℓ) |
|
a) Ni (ℓ) → Ni (Ti ~ 10,0 %) + ₪ Ni/Ni3Ti |
(15) |
|||
TiN0,61 |
+ Ni |
25 ч |
TiN~0,95 + Ni (ℓ) |
|
Ni (ℓ) → Ni3Ti + ₪ Ni/Ni3Ti |
(16) |
|||
Из представленных данных видно, что взаимодействие нитрида титана с никелем фактически протекает в рамках бинарной системы Ti–Ni. Об этом свидетельствует отсутствие каких-либо выделений нитридной природы в металлической фазе даже после 25-часовой экспозиции. Очевидная причина этого – крайне низкая растворимость азота в никеле (порядка 10–3 % при 1500 ºC [118–121]). Роль азота, таким образом, сводится к замедлению процесса растворения нитридной фазы в расплаве, тем большему, чем ближе состав нитрида к стехиометрическому.
Механизм взаимодействия нитрида TiN0,95 с расплавом Ni–1%C принципиально отличается от наблюдаемого в системе TiN0,95–Ni.
21
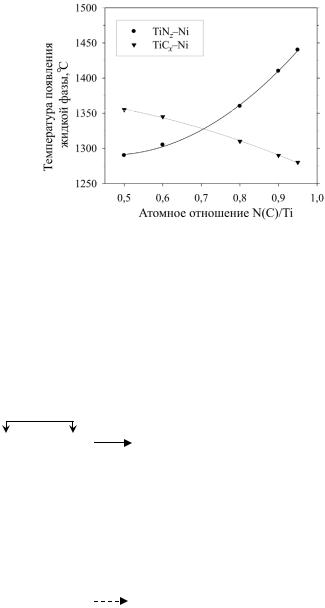
Рис. 13. Влияние состава нитрида (карбида) титана на температуру появления жидкой фазы в смеси с никелем (V = 20 град/мин)
Действительно, начальный этап взаимодействия характеризуется теперь химической реакцией растворенного в никеле углерода с металлом нитридной фазы (реакция (17)). В результате на поверхности зерен TiN0,95 образуется слой дефектного карбида TiC0,7, отделенный от сердцевины четкой границей раздела. По данным РСМА и ЛАММА карбидная фаза содержит в своем составе 15±1,0 % углерода и меньше 1 % азота:
TiN0,95 + Ni (C) 0,5 ч TiN0,95 | TiC0,7 + N2↑ + Ni (ℓ) |
|
Ni (ℓ) → Ni (Ti ~ 0, 5 %) |
(17) |
После такого «блокирования» нитридных зерен скорость перехода титана расплав резко снижается (ср. реакции (18), (19) и (11), (12)). В процессе последующей диффузионной гомогенизации состава нитридных зерен и их карбидной оболочки по неметаллам (реакция (18)) формируется и в дальнейшем отслаивается однофазный карбонитрид титана (реакция (19)).
TiN0,95 + Ni (C) 1 ч TiN0,95–zCx ↔ TiC0,7–xNz + Ni (ℓ) |
|
a) Ni (ℓ) → Ni (Ti ~ 1,0 %) |
(18) |
22

TiN0,95 + Ni (C) 25 ч TiNpCq (p > q) + Ni (ℓ) |
|
Ni (ℓ) → Ni ((Ti ~ 2,5 %) + ₪ Ni/TiC |
(19) |
Эвтектические выделения в металлической зоне образцов также имеют карбидный характер (N ≤ 0,1 %), что еще раз подтверждает вывод о фактическом неучастии азота в процессах фазообразования.
Системы TiN / Ni–Mo и TiN / Ni–Mo–C. Скорость растворения нитрида TiN0,95 в молибденсодержащем расплаве никеля заметно ниже по сравнению с чистым никелем (ср. реакции (12), (13) и (21), (22)). Однако общий характер взаимодействия при этом не изменяется – процессы фазообразования в системе TiN/Ni–Mo, как и в системе TiN-Ni, протекают без прямого участия азота, т.е. в рамках системы Ni–Mo–Ti. По данным РЭМ процесс взаимодействия сопровождается появлением крупных пор на межфазных границах, что свидетельствует о выделении азота в газовую фазу:
TiN0,95 |
+ Ni (Mo) 1 ч |
Ni |
(ℓ) + N2↑ |
|
Ni (ℓ) → Ni (Ti ~ 0,5 %) + ₪ Ni/Ni3Mo |
(20) |
|||
TiN0,95 |
+ Ni (Mo) 3 ч |
Ni (ℓ) + N2↑ |
|
|
a) Ni (ℓ) → Ni (Ti ~ 1,5 %) + ₪ Ni/Ni3Mo |
(21) |
|||
TiN0,95 |
+ Ni (Mo) 25 ч |
Ni (ℓ) + N2↑ |
|
|
a) Ni (ℓ) → Ni (Ti ~ 5,0 %) |
|
(22) |
||
С отклонением состава нитрида титана от стехиометрического скорость его растворения в Ni–Mo-расплаве увеличивается. Соответственно изменяется состав продуктов взаимодействия:
TiN0,61 |
+ Ni (Mo) |
1 ч |
TiN0,61+z + Ni (ℓ) |
|
Ni (ℓ) → Ni (Ti ~ 3,0 %) + ₪ Ni/Ni3Mo |
(23) |
|||
TiN0,61 |
+ Ni (Mo) |
3 ч |
TiN0,61+z + Ni (ℓ) |
|
a) Ni (ℓ) → Ni (Ti ~ 7,5 %) + ₪ Ni/Ni3Ti |
(24) |
|||
TiN0,61 |
+ Ni (Mo) |
25 ч |
TiN~0,95 + Ni (ℓ) |
|
Ni (ℓ) → Ni3Ti (Mo ≤10 %) + ₪ Ni/Ni3Ti |
(25) |
|||
Какие-либо признаки газовыделения (характерная пористость на границах зерен с металлом) в этом случае отсутствуют.
23

Начальные стадии фазообразования при взаимодействии нитрида TiN0,95 с расплавом Ni–25%Mo–1%C фактически не отличаются от наблюдаемых в системе TiC0,96 /Ni–25%Mo (ср. реакции (4), (5) и (26), (27)). И это неудивительно, так как азот нитридной фазы из-за низкой растворимости в расплавах никеля не принимает активного участия в фазообразовании, а остальные компоненты обеих систем одни и те же:
TiN0,95 |
+ Ni (Mo,C) 1 ч |
Ni (ℓ) + N2↑ |
|
а) Ni (ℓ) → Mo2C (Ti ~ 0,3 %) + ₪ Ni/Mo2C |
(26) |
||
TiN0,95 |
+ Ni (Mo,C) 3 ч |
Ni (ℓ) + N2↑ |
|
Ni (ℓ) → Mo2C (Ti ~ 1,5 %) + ₪ Ni/Mo2C |
(27) |
||
TiN0,95 |
+ Ni (Mo,C) 25 ч |
Ni (ℓ) + N2↑ |
|
Ni (ℓ) → Ti0,5Mo0,5Cx + ₪ Ni/(Ti,Mo)C |
(28) |
||
Отметим, однако, следующие важные особенности. Во-первых, растворенный углерод в рассматриваемой системе, в отличие от системы TiN/Ni–1%C, химически не взаимодействует с нитридом титана из-за резкого снижения своей активности в присутствии 25 % молибдена [122]. Во-вторых, из-за появления пор в результате выделения азота на границе растворяющихся нитридных зерен К-фаза на них не осаждается.
Основное же отличие сравниваемых систем – в кинетике фазообразования. Так, если в карбидной системе первичные выделения К-фазы в значительном количестве обнаруживаются уже после 0,5-часовой выдержки при 1450 ºC, то в нитридной – только после 25-часовой экспозиции при 1500 ºC (реакция (28)).
2.4.Одновременное взаимодействие карбида и нитрида титана
сNi- и Ni–Mo-расплавами
Система TiC–TiN / Ni. Трехфазные системы TiC-TiN/Ni изучались в литературе в основном с точки зрения спекаемости композиции [99, 100, 105], миграции межфазных границ [106] и роста зерен
24

[107]. Какие-либо сведения о кинетике и механизме начальных стадий взаимодействия в этой системе отсутствуют.
Подготовка двухфазных образцов ТФВ для исследования проводилась следующим образом. Горячепрессованные образцы TiC0,96 и TiN0,95 измельчались до среднего размера частиц 0,2±0,1 мм, тщательно перемешивались с порошковым никелем в объемном соотношении TiC/TiN/Ni = 1/1/2 и прессовались в таблетки. В остальном методика проведения экспериментов не отличалась от изложенной выше. Анализ состава и микроструктуры образцов проводился на шлифах методами РЭС, РСМА и ЛАММА.
Обобщенные результаты исследования приводятся ниже в виде соответствующих химических уравнений:
TiC0,96 + TiN0,95 + Ni0,5 ч |
TiC0,96–x + Ni (C) + TiN0,95 |
|
TiN0,95|TiCx + N2↑ + Ni (ℓ) |
|
|
Ni (ℓ) → Ni (Ti ~ 3,0 %) + ₪ Ni/TiC |
(29) |
|
TiC0,96 + TiN0,95 + Ni 1 ч |
TiC0,96–x + TiN0,95–zCx ↔ TiCxNz + Ni (ℓ) |
|
Ni (ℓ) → Ni (Ti ~ 4,5 %) + ₪ Ni/TiC |
(30) |
|
TiC0,96 + TiN0,95 + Ni 3 ч |
TiC0,96–x + TiNpCq + Ni (ℓ) |
|
a) Ni (ℓ) → TiC0,6 + ₪ Ni/TiC |
(31) |
|
Видно, что начальная |
стадия взаимодействия |
компонентов |
в системе TiC–TiN/Ni сводится к преимущественному растворению углерода карбидной фазы в расплаве. Достигнув границы с нитридной фазой, он вступает с ней в химическую реакцию с образованием карбида TiCx (N < 1 %). Азот при этом выделяется в газовую фазу, о чем свидетельствует появление микропор в области межфазного контакта. Эвтектические выделения в системе после ее охлаждения также имеют карбидный характер (N ~ 0,1 %)
Со временем инициируются процессы диффузионной гомогенизации состава двухфазных образований по неметаллам (реакция (30)), что сопровождается размытием первоначально четких границ раздела фаз. Под влиянием растущих напряжений формирующаяся оболочка карбонитрида титана отслаивается.
25

При охлаждении |
системы |
после 3-часовой термообработки |
в металлической зоне |
образца |
выпадают ограненные кристаллы |
сильнодефектного карбида TiC0,6 (C = 13 ± 1 %, N ~ 0,1 %) в окружении своих эвтектических выделений (реакция (31)).
Система TiC–TiN / Ni–Mo. Введение молибдена в рассматриваемую систему качественно изменяет механизм процессов фазо- и структурообразования. Во-первых, из-за сильного снижения активности углерода в присутствии молибдена реакция типа [C] + TiN0,95 → → TiCx + N2↑ уже не протекает. Во-вторых, К-фаза, формирующаяся в расплаве в изотермических условиях, осаждается теперь как на зернах TiC0,96, так и на зернах нитридной фазы:
TiC0,96 + TiN0,95 + Ni (Mo) 0,5 ч TiC0,96–x // Ti0,5Mo0,5Cx + |
|
+ TiN0,95 //Ti0,5Mo0,5Cx + Ni (ℓ) |
|
a) Ni (ℓ) → Ti0,5Mo0,5C0,6 + ₪ Ni/(Ti,Mo)C |
(32) |
По данным ЛАММА содержание азота в К-фазе не превышает
0,1 %, а углерода – 10 ± 1 % (рис. 14).
Рис. 14. Масс-спектр автономных выделений К-фазы в металле: TiC–TiN/Ni–25%Mo, 1450 ºC, 0,5 ч
26
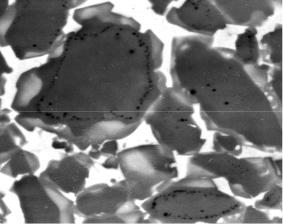
Рис. 15. Выделения К-фазы на зернах нитрида титана: TiC–TiN/Ni–25 %Mo, 1450 ºC, 3 ч
Следует особо отметить, что первичные выделения К-фазы на зернах TiN0,95 имеют островковый характер. Со временем они разрастаются и смыкаются. В результате диффузионного взаимодейст-
вия компонентов К-фазы с нитридом TiN0,95 выделяется азот, что приводит к формированию на границах таких образований харак-
терной цепочки микропор (рис. 15).
27
СПИСОК ЛИТЕРАТУРЫ
1.Pastor H. Titanium Carbonitride Based Hard Alloys for Cutting Tools // Materials Science and Engineering. – 1988. – Vol. 105/106. – P. 401–409.
2.Ettmayer P., Kolaska H., Lengauer W., Dreyer K. Ti(C,N) Cermets – Metallurgy and Properties // Int. J. Refract. Met. & Hard Mater. – 1995. – Vol. 13. – P. 343–356.
3.Bellosi A., Calzavarini R., Faga M.G., Monteverde F., Zancolo C., D’Errico. Characterization and application of titanium carbonitride-based cutting tools // J. Mater. Proc. Technology. – 2003. – Vol. 143–144. – P. 527–532.
4.Третьяков В.И. Основы металловедения и технологии производства спеченных твердых сплавов. – М.: Металлургия, 1976. – 527 с.
5.Clark E.B., Roebuck B. Extending the application areas for titanium carbonitride cermets // Int. J. Refr. Met. & Hard Mater. – 1992. – Vol. 11. – P. 23–27.
6.Третьяков В.И., Клячко Л.И. Твердые сплавы, тугоплавкие металлы, сверхтвердые материалы. – М.: Руда и металлы, 1999. – 264 с.
7.Панов В.С., Чувилин А.М. Технология и свойства спеченных твердых сплавов и изделий из них. – М.: МИСИС, 2001. – 428 с.
8.Гуревич Ю.Г., Нарва В.К., Фраге Н.Р. Карбидостали. – М.: Металлургия, 1988. – 144 с.
9.Симс Ч., Хагель В. Жаропрочные сплавы. – М.: Металлургия, 1976. – 568 с.
10.Жаропрочность литейных никелевых сплавов и защита их от окисления / Б.Е. Патон, Г.Б. Строганов, С.Т. Кишкин [и др.]. – Киев: Наукова думка, 1987. – 256 с.
11.Самсонов Г.В., Эпик А.П. Тугоплавкие покрытия. – М.: Ме-
таллургия, 1973. – 400 с.
28
12.Кудинов В.В., Иванов В.М. Нанесение плазмой тугоплавких покрытий. – М.: Машиностроение, 1981. – 192 с.
13.Шеенко И.Н., Орешкин В.Д., Репкин Ю.Д. Современные наплавочные материалы. – Киев: Наукова думка, 1970. – 238 с.
14.Игнатов М.Н. Физикохимия и технология процессов сварки никеля с применением карбидсодержащих материалов: дис. … д-ра техн. наук / Перм. гос. техн. ун-т. – Пермь, 1998. – 320 с.
15.Самсонов Г.В., Виницкий И.М. Тугоплавкие соединения
(справочник). – М.: Мир, 1976. – 558 с.
16.Свойства, получение и применение тугоплавких соединений (справочник) / под ред. Т.Я. Косолаповой. – М.: Металлургия, 1986. – 928 с.
17.Панасюк А.Д., Фоменко В.С., Глебова Г.Г. Стойкость неметаллических материалов в расплавах (справочник). – Киев: Наукова думка, 1986. – 352 с.
18.Гольдштейн М.И., Попов В.В. Растворимость фаз внедрения
всталях притермической обработке. – М.: Металлургия, 1989. – 200 с.
19.Ramqvist L. Wetting of metallic carbides by liquid copper, nickel, cobalt and iron // Int. J. Powder Met. – 1965. – Vol. 1. – № 4. – P. 2–21.
20.Самсонов Г.В., Панасюк А.Д., Козина Г.К., Дьяконова Л.В. Взаимодействие карбидов металлов IVа подгруппы с металлами семейства железа // Порошковая металлургия. – 1972. – № 7. – С. 66–71.
21.Самсонов Г.В., Панасюк А.Д., Козина Г.К., Дьяконова Л.В. Взаимодействие карбидов металлов Vа–VIа с жидкими переходны-
ми металлами // Порошковая металлургия. – 1972. – № 8. –
С. 35–38.
22. Самсонов Г.В., Панасюк А.Д., Козина Г.К., Боровикова М.С., Дьяконова Л.В. Физико-химические основы межфазного взаимодействия в системе металлоподобное тугоплавкое соединение – жидкий металл // Методы исследования и свойства границ раздела контактирующих фаз. – Киев: Наукова думка, 1977. – С. 99–107.
29
23.Фаткуллин О.Х., Офицерова А.А. Термодинамическая оценка взаимодействия карбидов с никелевыми сплавами // Технология легких сплавов. – 1979. – № 6. – С. 55–58.
24.Фраге Н.Р., Гуревич Ю. Г., Соколова Е.В., Леонович Б.И. Взаимодействие карбонитрида титана с железом и никелем // Изв.
АН СССР. Металлы. – 1989. – Т. 4. – С. 171–175.
25.Уточкин В.В., Шмаков А.М. Взаимодействие компонентов
вгетерофазной системе карбонитрид титана – расплав никель – молибден // Физика и химия обработки материалов. – 1994. – № 6. –
С. 116–120.
26.Попов В.В. Моделирование превращений карбонитридов при термической обработке сталей. – Екатеринбург: УрО РАН, 2003. – 378 с.
27.Lengauer W. Transition metal carbides, nitrides and carbonitrides // Handbook of Ceramic Hard Materials, ed. R. Riedel; WilleyVCH Verlag GmbH, Weinheim. – 2000. – P. 203–252.
28.Lengauer W., Eder A. Carbides: Transition Metal Solid-state Chemistry // Encyclopedia of Inorganic Chemistry / ed. R.B. King. – Chichester: John Willey & Sons, 2005. – P. 674–690.
29.Lengauer W., Eder A. Nitrides: Transition Metal Solid-state Chemistry // Encyclopedia of Inorganic Chemistry / ed. R.B. King. – Chichester: John Willey & Sons, 2005. – P. 3515–3531.
30.Pastor H. Titanium Carbonitride Based Hard Alloys for Cutting Tools // Materials Science and Engineering. – 1988. – Vol. 105/106. – P. 401–409.
31.Ettmayer P., Kolaska H., Lengauer W., Dreyer K. Ti(C,N) Cermets – Metallurgy and Properties // Int. J. Refract. Met. & Hard Mater. – 1995. – Vol. 13. – P. 343–356.
32.Bellosi A., Calzavarini R., Faga M.G., Monteverde F., Zancolo C., D’Errico. Characterization and application of titanium carbonitridebased cutting tools // J. Mater. Proc. Technology. – 2003. – Vol. 143– 144. – P. 527–532.
33.Exner H.E. Physical and chemical nature of cemented carbides // Int. Met. Rev. – 1979. – Vol. 24. – № 4. – P. 149–173.
30
