
книги / Механизмы органических реакций
..pdf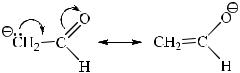
атома водорода с электронной парой или за счет 1,2-сдвига алкильной или фенильной группы.
4.2. Карбанионы
Карбанионы – это частицы, имеющие атом углерода с неподеленной электронной парой.
Карбанионы преимущественно образуются в результате отщепления протона от атома углерода органической молекулы. Карбанионы являются основаниями Бренстеда. В результате присоединения протона карбанион превращается в сопряженную кислоту, поэтому образование карбанионов, их устойчивость и реакционная способность связаны с силой сопряженной кислоты. Чем слабее кислота, тем сильнее сопряженное основание и, как следствие, менее устойчив карбанион.
Косновным факторам стабилизации относятся резонансный фактор и природа и положение заместителей в углеродной цепи.
Акцепторные заместители стабилизируют карбанион вследствие делокализации отрицательного заряда карбаниона и смещения электронной плотности к более электроотрицательным атомам:
Кзаместителям, оказывающим сильное стабилизирующее влияние на карбанионы, относятся карбонильная группа, нитро-, сульфонил- и цианогруппы. Чем больше резонансных структур имеет карбанион, тем более он стабилен.
Знание структуры карбанионов важно для понимания стереохимии их реакций. Карбанионный центр имеет пирамидальную конфигурацию, претерпевающую быструю инверсию:
41
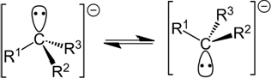
Карбанионы получаются в растворах в результате гетеролитического расщепления связи С–Н. Более легкому гетеролитическому разрыву связи будут способствовать делокализация образующегося заряда и эффективная сольватация карбаниона. В роли оснований для депротонирования используют спиртовые растворы щелочей, амид натрия в жидком аммиаке, диизопропиламид лития и фениллитий и другие соединения. Еще одним источником карбанионов являются металлоорганические соединения с ионной связью углерод – металл.
Легкость отрыва протона тем больше, чем более устойчив образующийся карбанион.
Чем меньше константа кислотности С–Н-кислоты, тем больше основность сопряженного этой кислоте основания (карбаниона) и тем выше его реакционная способность.
4.3. Радикалы
Впервые образование радикалов в реакционной среде было зарегистрировано в 1900 г. Мозесом Гомбергом. При взаимодействии трифенилхлорметана с серебром в растворе бензола он получил трифенилметильный радикал (С6Н5)3С•, этот радикал образовывал
с атмосферным кислородом пероксид (С6Н5)3С–О–О–С(С6Н5)3, строение которого было подтверждено встречным синтезом. Обра-
зование этого пероксида в реакционной среде можно было объяснить только появлением радикала (С6Н5)3С•.
Развитие хроматографических и спектроскопических методов анализа продуктов реакции к середине ХХ в. представило неопровержимые доказательства возможности протекания радикальных реакций в растворах. Применение метода электронного
42
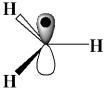
парамагнитного резонанса (ЭПР) позволило обнаружить свободные радикалы во многих реакциях.
Радикалы – это атомы или группы атомов, обладающие одним неспаренным электроном. Алкильные радикалы, как правило, имеют плоскую структуру с неспаренным электроном на р-орбитали, расположенной перпендикулярно плоскости sp2-орбиталей. Физикохимическими методами установлено, что метильный радикал имеет плоскую структуру:
На геометрию радикала сильное влияние оказывают заместители. С увеличением числа заместителей и усилением их π- донорных свойств увеличивается тенденция к непланарности. Например, трет-бутильный радикал имеет пирамидальную геометрию. Исследования таких радикалов показали, что радикальные центры не представляют собой жесткие пирамиды, а являются либо плоскими, либо имеют геометрию уплощенных пирамид. По-видимому, радикалы могут также испытывать незначительные геометрические искажения, возникающие в напряженных циклах, но без значительного повышения их энергии.
Как правило, радикалы существуют короткое время и присутствуют в незначительных количествах. Несмотря на это, установить протекание реакции именно по радикальному механизму можно исходя из природы реагентов, продуктов реакции и условий ее проведения.
Радикальные реакции можно затормозить ингибиторами или ускорить введением инициаторов.
Инициаторы радикальных реакций – это соединения, которые легко подвергаются гомолитическому разрыву связей. Так, в качестве инициаторов часто используют пероксид бензоила (1),
43

ди-(трет-бутилпероксид) (2), азо-бис-изобутиронитрил (3), тетраэтилсвинец (4):
В качестве ингибиторов радикальных процессов используются вещества, которые активно взаимодействуют с радикалами с образованием новых более устойчивых (менее реакционноспособных) радикалов. Такими ингибиторами обычно являются кислород, йод, полифенолы, амины и другие соединения. Например, кислород образует с алкильными радикалами более устойчивые перекисные радикалы R-O-O•.
Существует два способа образования свободных радикалов: а) гомолитический разрыв ковалентной связи:
А – В → А• + В•
б) перенос электрона на ион или с иона:
R+ + ē → R•
R– – ē → R•
Энергия, необходимая для разрыва связи, может передаваться молекуле при термолизе, фотолизе и радиолизе. Перенос электрона осуществляется при действии неорганических ионов или происходит электрохимическим путем.
44

Свободные радикалы также могут образоваться из других радикалов в следующих случаях:
–при реакции между радикалом и молекулой:
–при расщеплении радикала:
Стабильность радикалов в первую очередь определяется делокализацией неспаренного электрона. Так, в алкильных радикалах стабилизация может обеспечиваться за счет эффекта гиперконъюгации, когда наибольшее влияние на стабильность радикала оказывают электроны связей β-С–Н соседних алкильных групп. В трет- бутильном радикале девять связей С–Н участвуют в стабилизации радикала, в изопропильном – шесть, в метильном – ни одного. Поэтому трет-бутильный радикал устойчивее, чем изопропильный, а изопропильный радикал устойчивее, чем метильный. В общем, устойчивость алкильных радикалов увеличивается в ряду:
первичный < вторичный < третичный.
Электронодонорные и электроноакцепторные заместители способствуют делокализации электрона, что также стабилизирует радикал:
45
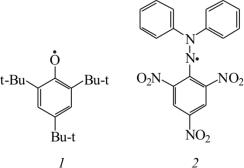
Делокализация неспаренного электрона за счет системы сопряженных двойных и (или) тройных связей также приводит к стабилизации радикалов. Например, вследствие делокализации неспаренного электрона за счет сопряжения с бензольным кольцом бензильный радикал более устойчив, чем трет-бутильный, а феноксильный радикал устойчивее алкоксильного.
На стабильность радикалов достаточно сильное влияние могут оказывать пространственные факторы, затрудняющие бимолекулярные реакции димеризации или диспропорционирования. Стабильность феноксильных радикалов повышается при введении объемных заместителей в орто-положение (рис. 3). Например, 2,4,6-три-трет-бутилфеноксильный радикал (1) обладает очень высокой устойчивостью и низкой реакционной способностью вследствие стерического экранирования радикального центра объемными трет-бутильными заместителями. Еще бóльшей устойчивостью обладает радикал 2,2-дифенил-1-пикрилгидразил (2), которому наряду со стерическим экранированием радикального центра стабильность придает и высокая степень делокализации неспаренного электрона.
Рис. 3. Радикалы с высокой устойчивостью
Пространственные факторы не оказывают существенного влияния в реакциях радикалов с малыми молекулами.
46
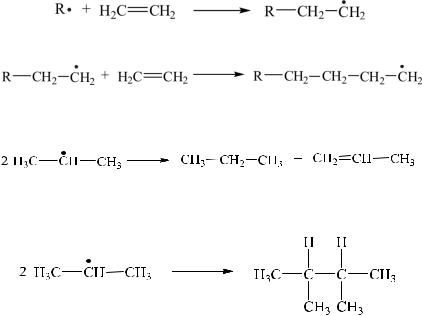
Еще одним фактором стабилизации углеводородных радикалов может служить конформационный эффект. Он связан со способностью радикального центра принимать плоскую конформацию. Отклонение от плоской структуры обычно понижает стабильность радикала.
Радикалы, как правило, обладают высокой реакционной способностью вследствие дефицита одного электрона и проявляют электрофильный характер. Поэтому они склонны атаковать электронные пары π-, n- и даже С–Н-связей. Можно выделить четыре основных типа реакций с участием радикалов:
1. Реакции присоединения радикалов к ненасыщенным субстратам – алкенам, алкинам, аренам и другим ненасыщенным соединениям. Большое значение этих реакций связано с их участием в процессах роста цепи при радикальной полимеризации:
–стадия инициирования цепи:
–стадия роста цепи:
2.Реакции диспропорционирования, которые включают перенос атома водорода от одного радикала к другому:
3.Реакции рекомбинации, при которых происходит соединение радикалов с образованием новой связи:
47
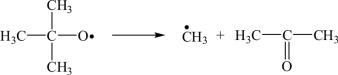
4. Реакции фрагментации, протекающие в растворах и в газовой фазе. Например, трет-бутоксильный радикал распадается на метильный радикал и молекулу ацетона:
4.4. Карбены и арины
Карбены – нестабильные соединения двухвалентного углерода. Они участвуют во многих химических реакциях. С их участием протекают такие важные процессы, как реакция Фишера– Тропша, полимеризация циклоолефинов с раскрытием цикла, синтез оптически активных производных циклопропана.
Общая формула карбенов RR'C:, простейший карбен (метилен) имеет строение :СН2.
Арины являются производными дегидробензола и образуются, например, при взаимодействии галогенсодержащих ароматических соединений с сильными основаниями.
48
5. ОСНОВНЫЕ ПОНЯТИЯ СТЕРЕОХИМИИ
Стереохимия изучает пространственное строение молекул и его влияние на химические и физические свойства вещества. В основе стереохимии лежат три фундаментальных понятия: конфигурация, конформация и хиральность.
Стереохимия начала развиваться с открытия оптической активности органических соединений в растворах. В настоящее время ее методы применимы ко всем без исключения молекулярным объектам: органическим, неорганическим, металлоорганическим.
Основная практическая цель стереохимии – это развитие стереохимического синтеза. Развитие стереохимии имеет большое значение, как фундаментальное, так и практическое, например, при разработке новых лекарств и материалов. Нобелевская премия по химии 2001 года присуждена Уильяму Нойлесу, Рьойи Нойори и Барри Шарплессу за развитие каталитического асимметричного синтеза.
Одно из основных понятий стереохимии – это конфигурация молекул, которая отражает пространственное расположение заместителей вокруг стерических центров молекулы (двойной связи, цикла или элемента хиральности).
Различные конфигурации молекул связаны с существованием геометрических и оптических изомеров.
Конфигурация в целом не отражает пространственной формы молекулы; при одинаковой конфигурации молекула может иметь множество конформаций.
5.1. Конформация
Конформации молекул – различные пространственные формы молекул, возникающие при изменении относительной ориентации отдельных ее частей в результате внутреннего вращения атомов или групп атомов вокруг одинарных связей, изгиба связей и др. При этом стереохимическая конфигурация молекулы остается неизменной, а каждой конформации соответствует оп-
49
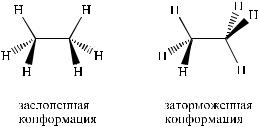
ределенная энергия. Так, для молекулы этана можно представить существование двух максимально различающихся по энергии конформаций – заслоненной и заторможенной:
Заслоненная |
|
Заторможенная |
конформация |
|
конформация |
Первой из них (заслоненной) соответствует максимум энергии, а второй (заторможенной) – минимум. Разница составляет 12 кДж/моль, поэтому при комнатной температуре молекула этана существует практически только в заторможенной конформации.
Если для молекулы возможно существование нескольких конформаций, которым соответствует минимум энергии, то они называются конформационными изомерами, или конформерами, а их взаимное превращение – конформационным переходом. Устойчивые при данной температуре изомеры можно наблюдать лишь при достаточно высоком энергетическом барьере для конформационного перехода.
Обычно, изображая трехмерные структуры молекул насыщенных соединений на плоскости, используют проекции Ньюмена. При этом молекулу рассматривают в направлении одной, специально выбранной связи, соединяющей два атома углерода так, что эти два атома «заслоняют» друг друга и поэтому изображаются одним кругом. Группы у этих атомов углерода проектируются на плоскость чертежа, перпендикулярную выбранной связи. Три линии, расходящиеся под углом 120° из центра круга, – это связи ближайшего к наблюдателю атома углерода, три линии, оканчивающиеся на окружности, – это связи удаленного атома. Например, проекции Ньюмена для разных конформаций молекулы этана имеют вид:
50
